家蝇抗菌肽MAF-1A的串联表达与抗白念珠菌体外活性检测
2018-05-28,,,,
,,,,
近年来,真菌感染性疾病的发病率不断增高,其中白念珠菌(Candidaalbicans)是主要病原体之一[1-2]。使用抗真菌药物是控制真菌感染的主要手段,但随着耐药菌株的不断增加,抗真菌药物种类较少及抗真菌药物的毒副作用等问题的出现,寻找新药源、研发新型安全有效的抗真菌感染治疗药物已经成为医学科研工作者迫切需要解决的问题[2-3]。
抗菌肽(Antimicrobial peptides,AMPs)是生物体内具有抑杀细菌、真菌、病毒以及肿瘤细胞等生物活性的小分子肽类物质。由于AMPs具有抗菌谱广、低毒、不易产生耐药性等特点,因此受到广泛关注[4-6]。MAF-1A(Muscadomesticaantifungal peptide-1A)是来源于家蝇幼虫由26个氨基酸残基组成的线性小分子抗菌肽。前期研究发现, MAF-1A为是一阳离子多肽,N 端富含赖氨酸(Lys),其二级结构主要为α-螺旋结构,具有较好的双亲性,且具有一定耐热性,MAF-1A可通过多靶点作用方式对白念珠菌敏感株及耐药菌株产生较强的抑杀作用,具有新型抗真菌药物的开发潜力[7-8]。但MAF-1A在家蝇幼虫体内含量少且提取纯化方法复杂,采用化学合成费用昂贵。因此,利用基因工程技术生产MAF-1A具有重要意义。本研究拟利用大肠杆菌原核表达系统对抗菌肽MAF-1A进行体外表达和纯化,并测定所表达MAF-1A的抗C.albicans活性,为后续深入研究MAF-1A和抗真菌新药的研发提供基础。
1 材料与方法
1.1 材料
1.1.1质粒和菌株 原核表达载体pET-28a购自宝生物工程(大连)有限公司;大肠杆菌Roseeta(DE3)购自北京全式金生物技术有限公司;白念珠菌(Candidaalbicans,ATCC10231)由贵州医科大学微生物学教研室保存。
1.1.2主要试剂 Tricine、Tris、蛋白Marker、SDS-PAGE凝胶试剂盒、His标签蛋白纯化试剂盒和肠激酶(EK)、ECL发光液均购自北京索莱宝科技有限公司。
1.2 方法
1.2.1序列合成与表达载体的构建 以MAF-1A氨基酸序列(KKFKETADKLIESAKQQLESLAKEMK)[7-8]为单体进行串联;根据大肠杆菌密码子偏嗜性优化编码序列,在5个MAF-1A单体核苷酸序列间设计肠激酶(EK)酶切位点;在序列的5′和3′端分别引入BamHⅠ和HindIII酶切位点,3′端引入6×His标签,化学合成串联基因序列5×MAF-1A-6×His;将基因序列克隆到pET-28a表达载体中以构建重组质粒,并测序鉴定。序列合成及克隆由生工生物工程(上海)有限公司完成。
1.2.2重组蛋白的表达与纯化 将重组质粒转化大肠杆菌Roseeta(DE3)感受态细胞,LB平板(含卡那霉素100 μg/mL)筛选阳性转化子,进行测序鉴定,鉴定结果正确的单菌落再继续接种于液体培养基(含卡那霉素100 μg/mL)中,37 ℃振摇培养12 h后,以1∶100接种于新鲜LB液体培养基(含卡那霉素100 μg/mL)中,37 ℃振摇培养至OD600值为0.8,分别以不同浓度的IPTG、温度及培养时间进行诱导表达。培养物在4 ℃,12 000 r/min离心10 min,收集菌体,加适量pH7.4的PBS重悬,取适量菌液加入SDS-PAGE蛋白上样缓冲液,沸水浴5 min,15% SDS-PAGE电泳检测目的蛋白的表达,以确定重组串联多肽的最佳表达条件。超声破碎诱导表达的菌体,取上清与沉淀分别进行15%SDS-PAGE电泳。按照His标签纯化试剂盒说明书,纯化重组蛋白,15%SDS-PAGE电泳鉴定目的蛋白,Nanodrop2000检测纯化蛋白浓度。
1.2.3重组蛋白的兔多抗血清制备 取含有400 μg重组蛋白的溶液与等体积完全弗氏佐剂进行乳化,将乳化的重组蛋白于新西兰兔背部皮下多点注射;第14 d及第28 d,各取含有100 μg重组蛋白的溶液与等体积不完全弗氏佐剂进行乳化,于新西兰兔背部皮下多点注射进行加强免疫;加强免疫后第14 d耳缘静脉采血测定抗体效价,然后采血并分离血清存于-80 ℃备用。
1.2.4纯化重组蛋白的Western Blot鉴定 将纯化的重组蛋白经15% SDS-PAGE电泳分离后电转移至硝酸纤维素膜(PVDF)上,用5%脱脂奶粉室温封闭2 h;用TBST洗涤3次;将PVDF与1∶2 000稀释5×MAF-1A兔多抗血清孵育4 ℃过夜,TBST洗涤3次;再将PVDF与1∶15 000稀释的羊抗兔IgG(H+L)于37 ℃孵育1 h,TBST洗涤3次;ECL化学发光显色,同时作空白对照。
1.2.5重组蛋白的酶切 用EK对纯化的重组蛋白进行酶切,按说明书操作。使用SDS-PAGE电泳检测酶切产物,采用Nanodrop2000检测MAF-1A单体浓度。
1.2.6酶切产物的抗菌活性检测 采用K-B纸片琼脂扩散法[9]检测酶切产物对C.albicans的体外抗菌活性;参考美国临床实验室标准化协会(CLSI)推荐的M27-A3方法[10],检测酶切产物对C.albicans的最低抑菌浓度(MIC)和最低杀菌浓度(MBC)。
2 结 果
2.1重组质粒的鉴定 重组质粒转化大肠杆菌Roseeta(DE3)阳性转化子测序结果证明碱基序列正确,MAF-1A编码序列、酶切位点和6×His标签依次正确连接。
2.2重组串联多肽的表达、纯化及SDS-PAGE电泳检测 将含有重组质粒的大肠杆菌在200 r/min振摇培养,经过SDS-PAGE电泳分析发现,IPTG终浓度为0.8 mmol/L时蛋白的表达量较其他浓度高;在28 ℃、0.8 mmol/L IPTG诱导条件下蛋白主要以可溶性状态存在,在该条件下诱导12 h,蛋白表达量达高峰(图1,2,3)。SDS-PAGE电泳结果中,目的条带在23 kDa,与预期一致。经Ni-NTA纯化后的融合蛋白与未纯化时相比,条带较为单一,表明大部分杂蛋白被去除,最后得到的融合蛋白纯度较高,Nanodrop2000检测纯化蛋白浓度为2.0 mg/mL(图4)。
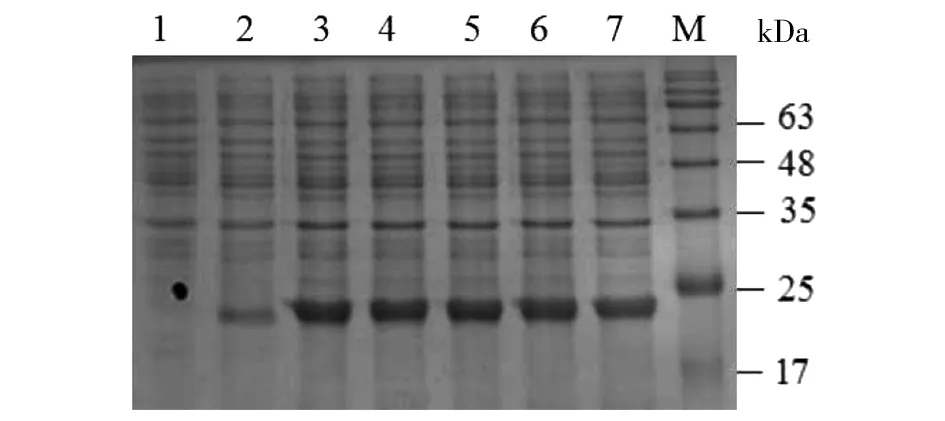
1:空载体转化对照组;2:未诱导对照组;3-7:IPTG诱导浓度分别为0.2、0.4、0.6、0.8、1.0mmol/L;M:Marker图1 不同IPTG浓度对重组蛋白表达的影响Fig.1 Effects of different IPTG concentrations on the expression of recombinant protein
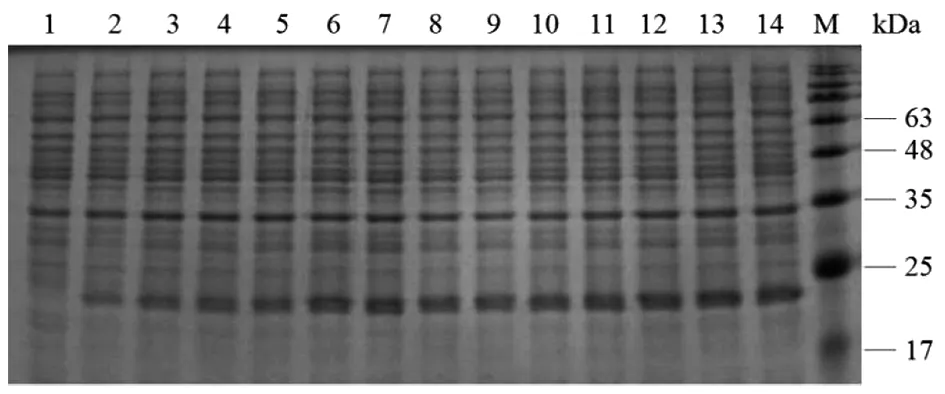
1:空载体转化对照组;2:未诱导对照组;3-14:诱导时间为2、4、6、8、10、12、14、16、18、20、22、24 h;M:Marker图2 不同培养时间对重组蛋白表达的影响Fig.2 Effects of different time on the expression of recombinant protein
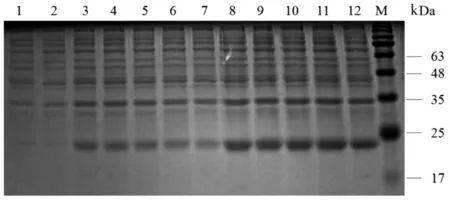
1:空载体转化对照组;2:未诱导对照组;3-12:诱导温度为18、20、22、24、26、28、30、32、34、36 ℃;M:Marker图3 不同培养温度对重组蛋白表达的影响Fig.3 Effects of different temperature on the expression of recombinant protein
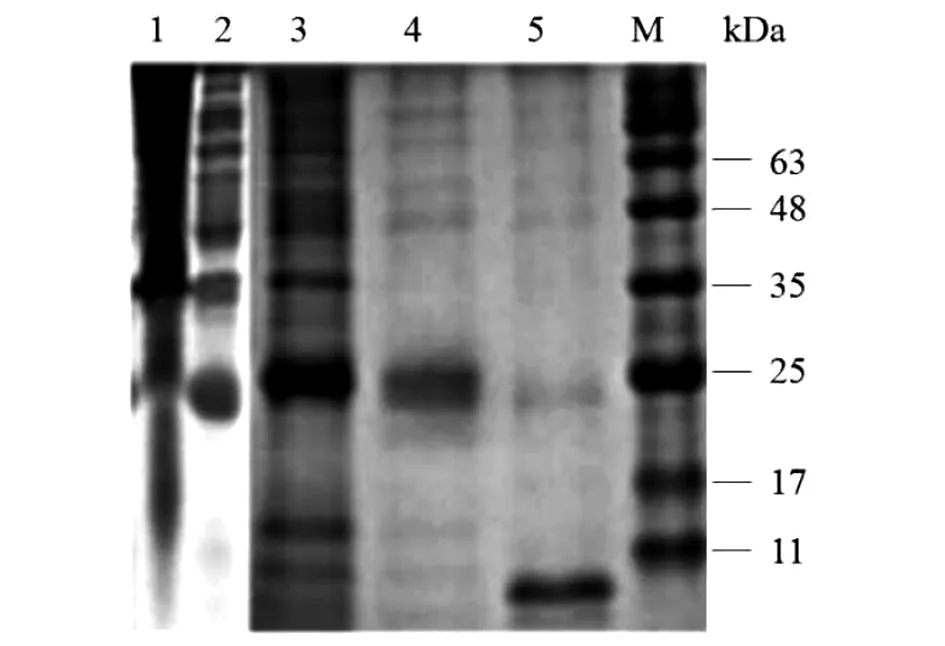
1:诱导表达的重组菌超声后沉淀;2:诱导表达的重组菌超声后上清;3:被诱导表达的重组菌全菌蛋白;4:纯化后重组蛋白;5:重组蛋白酶切产物;M:Marker图4 SDS-PAGE分析蛋白表达与纯化情况Fig.4 SDS-PAGE analysis of the expression and purification of recombinant protein
2.3纯化重组蛋白的Western Blot鉴定 以抗重组蛋白兔血清为一抗、羊抗兔IgG(H+L)作为二抗进行检测,结果显示5×MAF-1A蛋白能与多抗血清反应,在23 kDa处出现单一的特异性条带(图5),表明重组蛋白得到很好纯化。
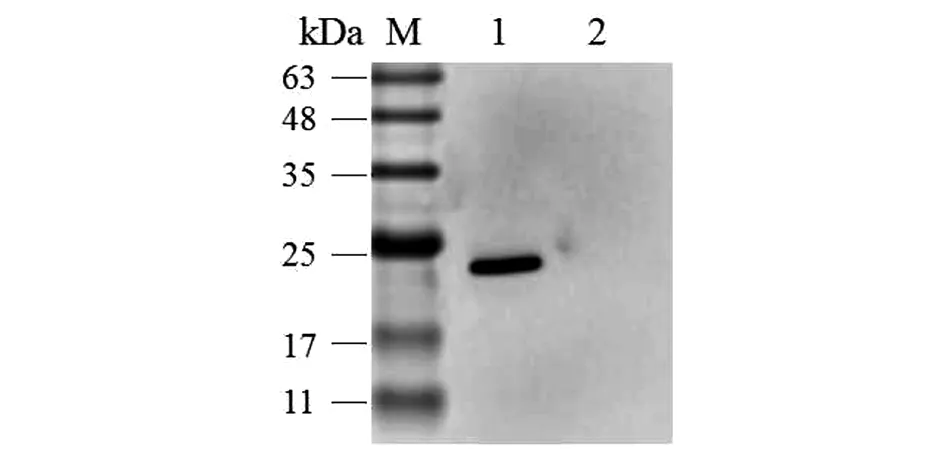
1:纯化后的重组蛋白与抗重组蛋白兔血清的免疫印迹反应;2:阴性对照;M:Marker图5 重组蛋白的Western Blot分析Fig.5 Western Blot analysis of recombinant protein
2.4MAF-1A单体的抗菌活性检测 经K-B纸片琼脂扩散法初步检测酶切获得的MAF-1A单体对C.albicans的抗菌活性,结果显示MAF-1A单体对C.albicans具有抑杀活性(图6)。采用微量稀释法检测MAF-1A单体对C.albicans的MIC值和MBC值分别为0.25 mg/mL、0.5 mg/mL。
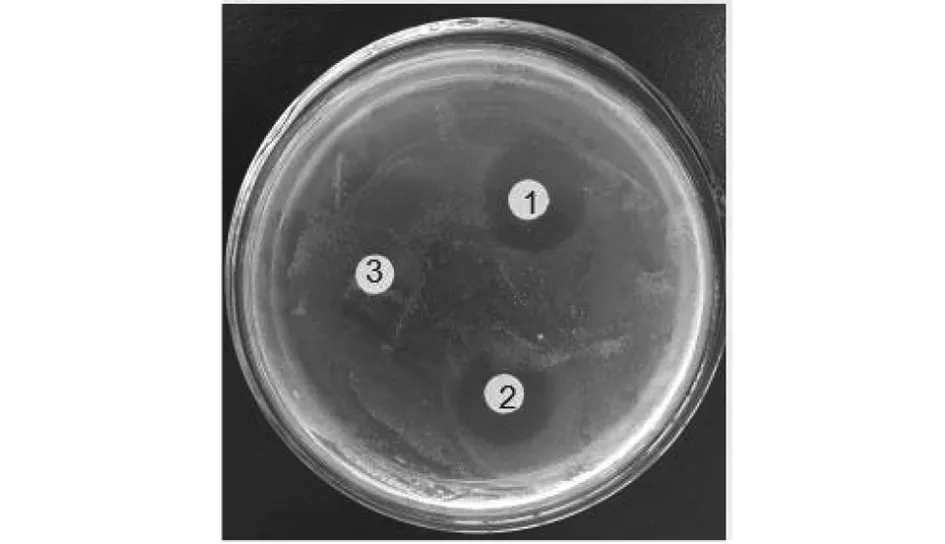
1、2:MAF-1单体;3:阴性对照。图6 MAF-1A单体的抗白念珠菌活性Fig.6 Anti-C. albicans activity of MAF-1A monomer
3 讨 论
MAF-1A是来源于家蝇幼虫体内的一类新型小分子AMPs,实验研究证实其具有较强的抗真菌活性[7-8]。尽管MAF-1A显示了作为新型肽类抗真菌药物的开发前景,但天然MAF-1A在虫体内含量极微,而且分离纯化困难,难以满足后续研究及产业化需求。目前,获得高纯度的AMPs途径主要包括化学合成以及重组表达。重组表达AMPs的生产成本低,提取工艺简单,产量高,能更好的满足研究和产业化需求[11]。大肠杆菌和酵母菌是最为常用的AMPs重组表达宿主。由于MAF-1A具有对真菌较强的抑杀活性而对细菌影响小的特点,在本实验研究中,选用大肠杆菌作为重组表达宿主,以减少MAF-1A表达后对宿主的毒性。
小分子多肽的克隆表达、分离、纯化、鉴定都相对复杂,在表达宿主菌体内很容易降解[12]。MAF-1A是由26个氨基酸残基构成的多肽,由于其相对分子量较小,也不适合直接在重组表达宿主中表达。为了增加小分子多肽的表达量和稳定性、提高目的多肽的得率、保持多肽活性,国内外许多学者采用了串联表达方式,由于串联设计可以表达出大分子肽聚体,肽聚体通过酶或其他位点的切割可以释放多个肽单体,这不仅解决了小分子多肽单体不易分离、鉴定的问题,也提高了表达效率[13-15]。目前,已有MagaininII,LNK-16,BuIFN-T1a2,BuIFN-T8等多种AMPs的大肠杆菌串联表达系统被构建,其不仅能诱导表达出相应AMPs的串联分子,而且其水解产物均具有抑菌活性[16-19]。本实验研究根据大肠杆菌密码子偏嗜性,以MAF-1A的氨基酸序列为单体,肠激酶(EK)为裂解识别点,6×His为标签,设计合成含5个MAF-1A拷贝的人工融合基因5×MAF-1A-6×His,并构建了含该融合基因序列的大肠杆菌重组表达系统pET28a-5×MAF-1A-E.coliRoseeta(DE3)。实验结果显示,所构建的重组表达系统可在 IPTG 诱导下表达目的重组蛋白,表达量为2.0 mg/mL。结果表明,MAF-1A原核串联表达体系构建成功,该串联表达系统能够较好的表达重组蛋白。
可溶性蛋白适合采用亲和层析法进行纯化,并且由于纯化的蛋白溶液中没有变性剂和过多的盐离子,对后期蛋白酶切和抗菌活性的影响不大[20]。实验结果显示,宿主菌所表达的目的重组蛋白主要以可溶形式存在,经Ni-NTA 提纯后在SDS-PAGE电泳中呈现为较为单一的目的蛋白条带,表明该重组蛋白能够得到较好纯化;纯化后的重组蛋白经EK酶切后获得的MAF-1A单体对C.albicans具有抑杀活性,其对C.albicansMIC和MBC值分别为0.5 mg/mL、1.0 mg/mL,表明构建的串联表达系统可以有效表达具有抗菌活性的MAF-1A。
本研究构建的串联表达体系能高效表达具有生物学活性的MAF-1A,为MAF-1A的进一步研究和抗真菌新药的研发提供实验基础。
参考文献:
[1] Lo HJ, Tseng KY, Kao YY, et al. Cph1p negatively regulates MDR1 involved in drug resistance inCandidaalbicans[J]. Int J Antimicrob Agents, 2015, 45(6): 617-621. DOI: 10.1016/ j. ijantimicag. 2015. 01. 017
[2] Guilhelmelli F, Vilela N, Smidt KS, et al. Activity of scorpion venom-derived antifungal peptides against planktonic cells ofCandidaspp. andCryptococcusneoformansandCandidaalbicansbiofilms[J]. Front Microbiol, 2016, 7(B4698): 1844. DOI: 10. 3389/ fmicb. 2016. 01844
[3] Pfaller MA. Antifungal drug resistance: mechanisms, epidemiology, and consequences for treatment[J]. Am J Med, 2012, 125(1 Suppl): S3-13. DOI: 10.1016/j. amjmed. 2011. 11. 001
[4] Wang G, Mishra B, Lau K, et al. Antimicrobial peptides in 2014[J]. Pharmaceuticals, 2015, 8(1): 123-150. DOI: 10. 3390/ph8010123
[5] Zhan YO, Wiradharma N, Yi YY. Strategies employed in the design and optimization of synthetic antimicrobial peptide amphiphiles with enhanced therapeutic potentials[J]. Adv Drug Delivery Rev, 2014, 78: 28-45. DOI: 10. 1016/j. addr. 2014. 10.013
[6] Kocourková L, Novotná P, Cujová S, et al. Conformational study of melectin and antapin antimicrobial peptides in model membrane environments[J]. Spectrochim Acta A MolBiomol Spectrosc, 2017, 170: 247-255. DOI: 10. 1016/j. saa. 2016. 07. 015
[7] Wang T, Xiu J, Zhang Y, et al. Transcriptional responses ofCandidaalbicansto antimicrobial peptide MAF-1A[J]. Front Microbiol, 2017, 8: 894. DOI: 10.3389 / fmicb. 2017. 00894
[8] 罗振华,吴建伟,付萍,等.人工合成家蝇抗真菌肽MAF-1A对白色念珠菌致病性的影响[J].第三军医大学学报, 2013, 35(20): 2203-2207.
[9] Kusmiati K, Priadi D, Rahayu RKB. Antibacterial activity test, evaluation of pharmacognosy and phytochemical screening of some extracts of globe amaranth (gomphrena globosa)[J]. J Pure Appl Chem Res, 2017, 6(1): 27-33. DOI: 10.21776/ub. jpacr. 2017. 006. 01. 288
[10] John HR, Borbara DA, David A, et al. Reference method for broth dilution antifungal susceptibility testing of yeasts; Approved standard-Third Edition[M]. Clinical and Laboratory Standards Institute document M27-A3, 2008, 28(14): 1-40
[11] Klint JK, Senff S, Saez NJ, et al. Production of recombinant disulfide-rich venom peptides for structural and functional analysis via expression in the periplasm ofE.coli[J]. PLoS One. 2013, 8(5): e63865. DOI: 10.1371/ journal. pone. 0063865
[12] 祁丽,姜宁,张爱忠,等. 抗菌肽研发现状及其改造策略[J].中国畜牧兽医,2016, 43(2): 450-456.DOI:10.16431/j.cnki.1671-7236.2016.02.024
[13] Yi T, Sun S, Huang Y, et al. Prokaryotic expression and mechanism of action of helical antimicrobial peptide A20L using fusion tags[J]. Bmc Biotechnol, 2014, 15(1): 1-10. DOI: 10. 1186/s12896-015-0189-x
[14] 贾红,袁维峰,李杰,等. 细粒棘球蚴EG95s重组蛋白串联表达免疫原性分析[J]. 中国人兽共患病学报, 2014, 30(8): 843-847.DOI:10.3969/j.issn.1002-2694.2014.08.014
[15] 易方浩,张俊爱,黎四平,等. 4种血清型登革病毒多表位重组抗原的表达及血清学初步评价[J]. 中国人兽共患病学报,2017,33(1): 32-37.DOI:10.3969/j.issn.1002-2694.2017.01.006
[16] 郑华,杨柳,付利芝,等.串联线性抗菌肽在大肠杆菌中的表达及活性抗菌肽的制备[J]. 黑龙江畜牧兽医, 2015,9: 192-194.DOI:10.13881/j.cnki.hljxmsy.2015.0711
[17] Saugandhika S, Sharma V, Malik H, et al. Molecular characterization of IFN-T expressed in buffalo embryonic trophoblasts and expression of recombinant BuIFN-T1a2 and BuIFN-T8 isoforms inE.coli[J]. Protein Exp Purificat, 2016, 122: 8-14. DOI: 10. 1016/j. pep. 2016. 02. 005
[18] 成娟丽,李锋,王红,等.抗菌肽MagaininⅡ多拷贝串联体的设计与构建[J].生物技术, 2014, 24(4): 75-79.
[19] Xu Y, Wang Q, Hang B, et al. Serial expression and activity analysis of LNK-16: a bovine antimicrobial peptide analogue[J]. Protein J, 2014, 33(4): 309-31. DOI: 10.1007/ s10930-014-9563-0
[20] Gordon YJ, Romanowski EG, McDermott AM. A review of antimicrobial peptides and their therapeutic potential as anti-infective drugs[J]. Curr Eye Res, 2005, 30(7): 505-515. DOI: 10. 1080/02713680590968637
