大肠杆菌cirA基因缺失对耐药性影响
2018-05-28,,,,,,
,, ,,, ,
抗生素的广泛应用对控制人和动物疫病发挥巨大作用,有力推动了医学的发展,但近二十年来,随着抗生素的大量使用,特别是无指征的滥用、过度治疗以及频繁更换使用,造成各种病原的耐药率和耐药程度越来越高,多重耐药问题日益严重且不容忽视[1-4]。细菌耐药机制十分复杂,是当今病原细菌学的一个重要内容,也是指导药物靶点设计、新药研发及正确、合理使用抗生素的重要依据。
致病性大肠杆菌是临床感染中最为常见的病原之一,能造成人和多种动物感染,其发病率一直位于细菌性疾病的首位[5]。作为人兽最为重要的病原之一,大肠杆菌的多重耐药情况十分普遍,但不容忽视[6]。目前针对大肠杆菌多重耐药的研究已经取得一些进展,有资料表明细胞膜通透性的改变与主动外输系统的超量表达在大肠杆菌耐药过程中发挥重要作用[7]。研究发现大肠杆菌外膜中存在的多种膜孔蛋白如OmpF[8]和OmpC[9]与多重耐药密切相关。尽管研究人员在病原菌耐药机制方面做了大量研究,但我们所发现的仅是冰山一角。
研究以大肠杆菌膜表面的大肠菌素受体蛋白CirA为研究对象,用Red同源重组方法构建大肠杆菌cirA基因缺失株,并对其生物学特性进行研究,为探索大肠杆菌多重耐药机制寻找合适疫苗靶点奠定基础。
1 材料与方法
1.1材料 禽致病性大肠杆菌分离株CE129(O1∶K89)、pKD3、pKD46、pCP20以及pBR322质粒由扬州大学朱国强教授惠赠;鼠源巨噬细胞Raw264.7由吉林农业大学单晓枫教授惠赠。LATaqDNA 聚合酶、限制性内切酶及T4连接酶均购自TaKaRa(大连); L-阿拉伯糖购自Sigma 公司;His标签单克隆抗体、HRP标记山羊抗小鼠IgG抗体、胎牛血清及DMEM高糖培养基购自Gibico公司。
1.2引物设计 引物P1、P2分别由前后两部分组成,5′端加下划线的部分与待敲除基因序列同源,3′端未加下划线部分与质粒 pKD3氯霉素抗性基因cat两侧序列互补,P3、P4为质粒pKD46鉴定引物,P5、P6引物位于cirA基因开放阅读框外侧,用于缺失株的鉴定;P7、P8引物用于扩增cirA基因完整开放阅读框,构建回补质粒。所有引物序列由上海生工生物技术服务有限公司合成(表1)。
表1 文章中涉及引物
Tab.1 Primers involved in this study

引物引物序列(5′⁃3′)长度/bpP1AAGACCTGCAGCGAAAACCGGTA⁃CAGAATCTGAAGGATGTCCT⁃CAAAGAAGTGCCTGGCGTGTAG⁃GCTGGAGCTGCTTCG1104P2TTTGACGTCTTTAGTCACCTGCCAG⁃GCCGCGCCGGTATTCCAGATGG⁃TATAACCGCCCGATGAATATCCTC⁃CTTAGP3ATGTTTAGGTTGAACCCTTTCGTAC2089/1596∗/492∗∗P4AGAAGCGATAATCCACTGCCATP5GGAATTCATGTTTAGGTTGAAC⁃CCTTTCGTAC(EcoRⅠ)1992P6CTAGCTAGCTCAGAAGCGATAATC⁃CACTGCC(NheⅠ)
*一次重组扩增片段大小,**二次重组扩增片段大小
1.3大肠杆菌cirA基因缺失株的构建 首先利用氯化钙方法将pKD46转入大肠杆菌CE129中,挑取氨苄青霉素抗性菌株接种于Amp抗性LB中,30℃培养,添加终浓度为30 mmol/L L-阿拉伯糖诱导培养,待菌液OD600值达到0.4~0.6时制备电转化感受态。将P1、P2扩增纯化的打靶片段电转化到制备好的感受态细胞中,电转化条件为电压1.8 kV,脉冲25μF,电阻200Ω,挑取氯霉素抗性菌落进行鉴定。阳性菌落制备电转化感受态细胞,导入pCP20质粒,消除抗性标记,最终得到目的菌株CE129ΔcirA(KO)。利用特异性鉴定引物进行PCR,对基因缺失菌株进行鉴定。此外利用试剂盒提取基因缺失株基因组DNA,利用鉴定引物进行PCR扩增后,产物送交北京生工生物有限公司测序进行进一步验证。
1.4回补菌株构建 提取大肠杆菌CE129基因组,以其为模板,利用P7、P8引物扩增cirA基因完整开放阅读框,将其克隆到pBR322质粒上。将回补质粒pBR322-cirA转化至突变菌株中,构建回补菌株(RS)。
1.5生长特性检测 分别将大肠杆菌cirA基因缺失株和野生型菌株接种液体LB中,37 ℃培养过夜。用液体LB调节两种菌液至OD600值达到一致。分别吸取两种菌液按照1∶100比例接种新鲜LB培养基中,37 ℃同步培养;每隔 0.5 h 取样测定其在600 nm处吸光度,重复上述试验3次并绘制生长速率曲线。
1.6生化特性测定 利用梅里埃自动生化鉴定系统对大肠杆菌cirA基因缺失株和野生型菌株进行生化特性比较:将待检菌株于营养琼脂上划线培养,刮取菌落重悬于无菌生理盐水,调整菌液浓度到0.5个麦氏浊度,分别吸取40 L菌液滴于ID32E生化鉴定卡检测孔中,特定孔需滴加灭菌石蜡厌氧培养,置于湿盒37 ℃培养16 h;将测试卡上机进行鉴定。
1.7耐药性鉴定 参照NCCLS药敏试验标准,利用K-B纸片法对目的菌株进行药物敏感性测试,质控菌为大肠杆菌菌株ATCC25922。分别将大肠杆菌cirA基因缺失株和野生型菌株接种液体LB中,37 ℃培养过夜。将过夜培养物调整至0.5个麦氏浊度,无菌棉签将细菌涂布于无抗生素的LB固体培养基上,并在培养基表面贴上药敏纸片,培养24 h测定药敏纸片的抑菌圈直径,以检测抗生素对该菌的抑制程度。试验重复3次,结果为测量平均值±标准差。
1.8生物被膜的检测 参照文献[10],将各待检菌株接种液体LB中30℃培养过夜,菌液按1∶100的比例转接生物膜诱导培养基,再加入96 孔板中,150 L/孔。置于30℃恒温摇床(80 r/min)中培养24 h。小心弃掉菌液,蒸馏水洗去游离细菌,2%结晶紫室温染色15 min,蒸馏水洗涤。用95%的乙醇将溶解结晶紫,测量OD600处吸光值。试验重复3 次,实验数据统计采用prism 5.0 软件分析。
2 结 果
2.1大肠杆菌cirA基因缺失株的构建 PCR扩增含有cirA基因同源序列的打靶片段,纯化后将其导入含有pKD46质粒的CE129菌株感受态细胞,使氯霉素基因Cat替换目的基因cirA。经抗性与PCR检测(图1)筛选得到阳性重组子CE129::Cat,进一步将 pCP20 质粒转化到CE129::Cat菌株中,消除引入的Cat基因,经PCR检测(图1)和序列测定后得到最终的基因缺失菌株。
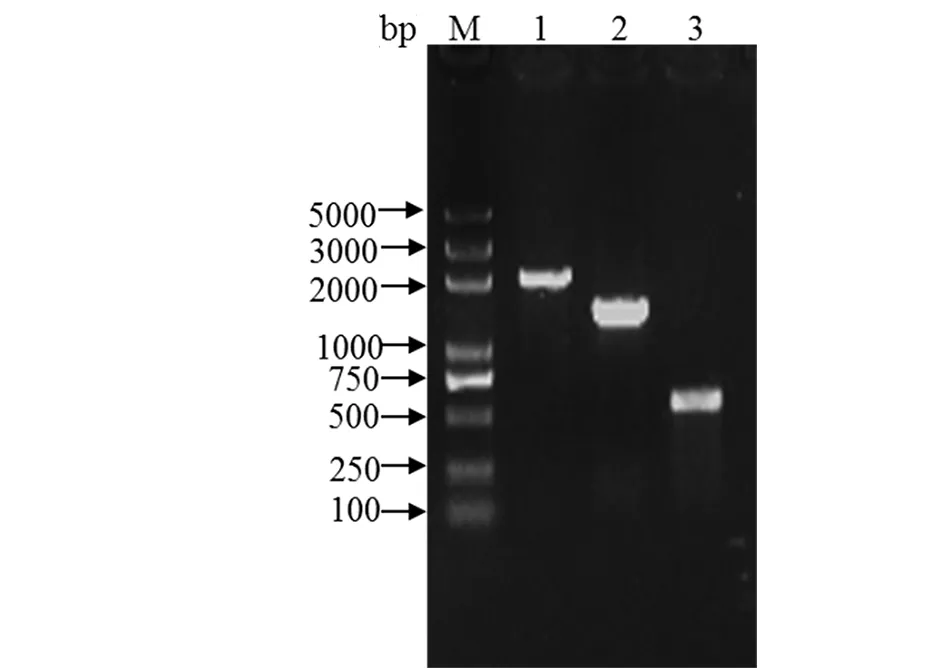
图1 大肠杆菌CE129ΔcirA基因缺失株验证Fig.1 Identification the knockout of cirA gene in E. coli strain CE129
2.2生长速率比较 绘制CE129野生型菌株、cirA基因缺失株及回补菌株的生长曲线,结果显示(图2)三者生长趋势基本一致,生长速率无明显差异。
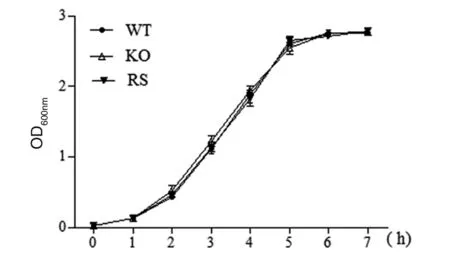
图2 生长曲线测定Fig.2 Growth characteristics of CE129 related strains
2.3生化特性比较 利用ATB全自动生化鉴定系统对大肠杆菌CE129野生型菌株与cirA基因缺失株的生化反应谱进行测定,结果表明:二者生化反应谱一致,均能够利用葡萄糖、乳糖、鸟氨酸和赖氨酸。
2.4生物膜形成能力比较 将CE129野生型菌株与cirA基因缺失株分别接种到生物膜诱导培养基中,30 ℃静置培养24 h,对生物膜进行结晶紫染色结果表明,cirA基因缺失后,大肠杆菌CE129生物膜形成能力明显下降(图3A)。进一步通过96孔定量实验进行验证,发现缺失株生物膜减少近60%,cirA基因回复后生物膜形成能力部分恢复(图3B)。
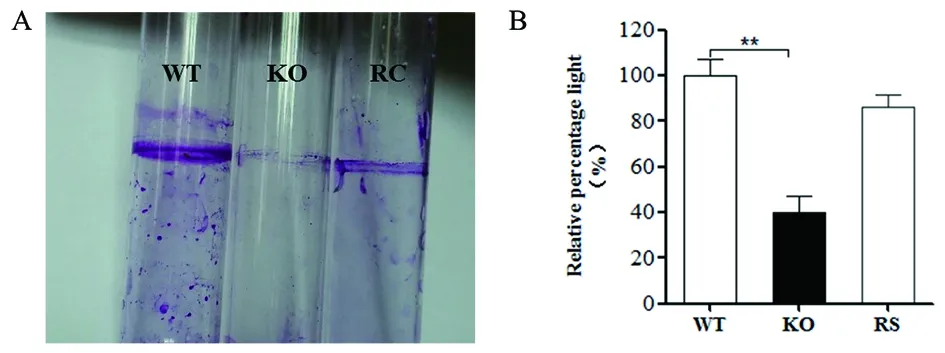
图3 大肠杆菌生物膜形成能力测定Fig.3 Biofilm formation assay of E.coli CE129 related strains
2.5大肠杆菌ΔcirA基因缺失株耐药性分析 药敏试验结果(见表 2)表明,相较于野生型菌株,大肠杆菌CE129ΔcirA基因缺失株对多种抗生素敏感增强,揭示cirA基因缺失对大肠杆菌耐药性产生影响。
表2 大肠杆菌CE129 ΔcirA基因缺失株和野生型菌株的药敏试验结果敏试验结果
Tab.2 Resistance to antibotics of E.coli CE129 ΔcirA mutant and wild-type strain
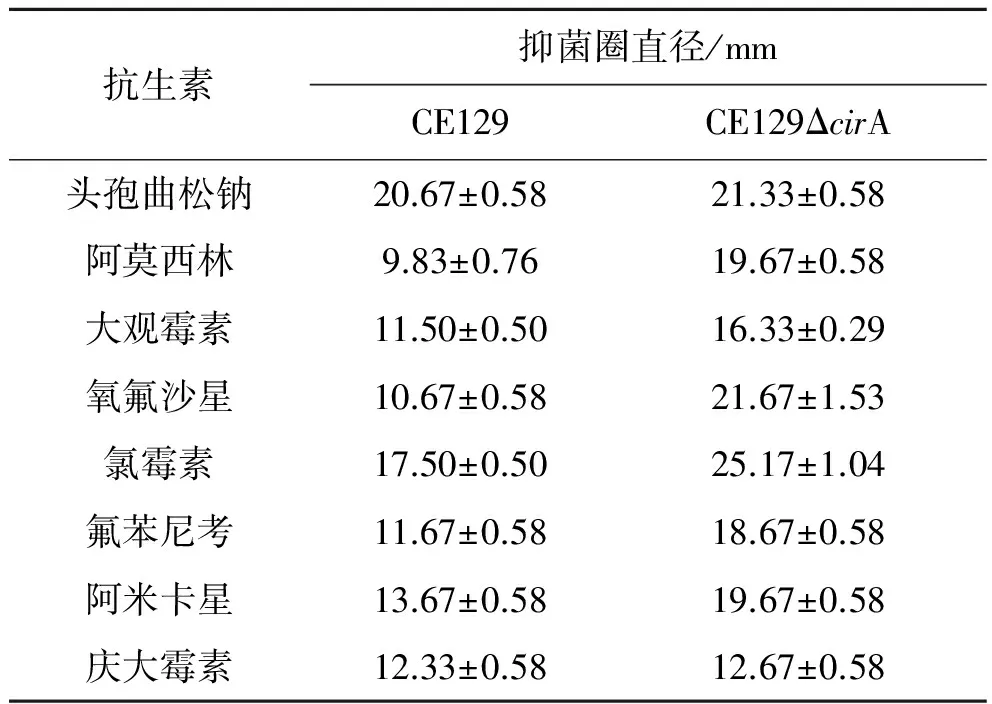
抗生素抑菌圈直径/mmCE129CE129ΔcirA头孢曲松钠20.67±0.5821.33±0.58阿莫西林9.83±0.7619.67±0.58大观霉素11.50±0.5016.33±0.29氧氟沙星10.67±0.5821.67±1.53氯霉素17.50±0.5025.17±1.04氟苯尼考11.67±0.5818.67±0.58阿米卡星13.67±0.5819.67±0.58庆大霉素12.33±0.5812.67±0.58
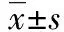
3 讨 论
致病性大肠杆菌是一种重要的人兽共患病病原,也是临床上最常见的病原之一,常在人和多种动物的引起多种类型的感染。长久以来针对大肠杆菌感染多以抗生素为主要治疗手段,也取得了较好的治疗效果,但近年,大肠杆菌多重耐药菌株不断涌现,出现了对几种甚至几十种抗生素均不敏感的耐药菌株,给临床用药带来极大的困难[6]。卫生部全国细菌耐药监测网(Mohnarin)及中国CHINET 2006-2011年间细菌耐药性监测数据显示,大肠杆菌居于首位,其耐药性问题日益引起人们关注[11]。多重耐药大肠杆菌感染给养殖业持续发展和人类身体健康带来的公共卫生问题,更是医学和兽医共同面临的重要难题之一。
大肠杆菌耐药机制较为复杂,是多个基因、多重机制协同作用的结果。目前,在大肠杆菌中发现的多重耐药相关操纵子有marRAB[12]、soxRS[13]、crAB[14]、emrAB[15]等,其中mar操纵子研究最多,也是非常重要的耐药调控因子。此外大肠杆菌外膜蛋白OmpF、LamB也被证实参与细菌耐药过程[8, 16]。本研究中所涉及的CirA蛋白也是存在于大肠杆菌外膜表面的孔道蛋白,为大肠菌素的受体蛋白[17],而关于该蛋白研究较少,仅局限于其受体功能。在本研究中我们发现cirA与细菌耐药相关,大肠杆菌cirA基因缺失后对多种抗生素敏感性显著提高。大肠杆菌生物膜是细菌生长过程中分泌于胞外的成分,参与细菌应对不利环境,有研究发现细菌生物膜能够协助对抗抗生素的杀伤作用,因此本研究探索了cirA基因缺失对大肠杆菌生物膜的影响,结果表明基因缺失株的生物膜形成被明显削弱,可能是其抗生素耐受能力降低的重要原因。本研究对大肠杆菌CE129菌株进行基因缺失,缺失株的生长和生化特性未发生明显改变,排除了生长和生化特性改变的干扰。
本研究利用Red同源重组方法构建大肠杆菌cirA基因缺失株,并对其生物学特性进行研究,为探索大肠杆菌多重耐药机制寻找合适疫苗靶点奠定基础。
参考文献:
[1] 陈代杰.新世纪以来全球新型抗菌药物研发及前沿研究进展[J].中国抗生素杂志,2017,42(3):161-168.DOI:10.13461/j.cnki.cja.005843
[2] 黄勋,邓子德,倪语星,等.多重耐药菌医院感染预防与控制中国专家共识[J].中国感染控制杂志,2015,14(1):1-9.
[3] 王娟,王新华,徐海.多重耐药菌在人类、动物和环境的耐药和传播机制的研究进展[J]. 微生物学报,2016,56(11):1-10.DOI:10.13343/j.cnki.wsxb.20160044
[4] 侯芳,吕媛.不容忽视的细菌耐药[J].中国抗生素杂志,2017,42(3):203-206.DOI:10.13461/j.cnki.cja.005849
[5] Terlizzi ME, Gribaudo G, Maffei ME. UropathogenicEscherichiacoli(UPEC) Infections: virulence factors, bladder responses, antibiotic, and non-antibiotic antimicrobial strategies[J]. Front Microbiol,2017,8(Article1566):1-23. DOI: 10.3389/fmicb.2017.01566
[6] 雷连成,韩文瑜,郑丹,等.耐药大肠杆菌的致病性与免疫原性[J].中国生物制品学杂志,2006,19(4):340-343.DOI:10.13200/j.cjb.2006.04.17.leilch.004
[7] Alibert S, N’Gompaza DJ, Hernandez J, et al. Multidrug efflux pumps and their role in antibiotic and antiseptic resistance: a pharmacodynamic perspective[J]. Expert Opin Drug Metab Toxicol,2017,13(3):301-309. DOI: 10.1080/17425255.2017.1251581
[8] Lim JA, Hong J, Kim J, et al. OmpF ofPectobacteriumcarotovorumsubsp.carotovorumPcc3 is required for carocin D sensitivity[J]. FEMS Microbiol Lett,2016,363(23):1-7. DOI:10.1093/femsle/fnw258
[9] Ghai I, Winterhalter M, Wagner R. Probing transport of charged beta-lactamase inhibitors through OmpC, a membrane channel fromE.coli[J]. Biochem Biophys Res Commun,2017,484(1):51-55. DOI: 10.1016/j.bbrc.2017.01.076
[10] 姚丰华,董立伟,张钰,等.肠炎沙门菌hcp基因对生物被膜形成的影响分析[J].中国预防兽医学报,2014,36(7):534-537.
[11] 胡付品,朱德妹,汪复,等.2011年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2012,12(5):321-329.DOI:10.16718/j.1009-7708.2012.05.002
[12] Zhang H, Gao L, Zhang J, et al. A novel marRAB operon contributes to the rifampicin resistance inMycobacteriumsmegmatis[J]. PLoS One,2014,9(8):1-13. DOI: 10.1371/journal.pone.0106016
[13] Lee JH, Lee KL, Yeo WS, et al. SoxRS-mediated lipopolysaccharide modification enhances resistance against multiple drugs inEscherichiacoli[J]. J Bacteriol,2009,191(13):4441-4450. DOI: 10.1128/JB.01474-08
[14] Zhang CZ, Chen PX, Yang L, et al. Coordinated expression of acrAB-tolC and eight other functional efflux pumps through activatingramAandmarAinSalmonellaentericaserovarTyphimurium[J]. Microb Drug Resist,2017,24(2):120-125.DOI: 10.1089/mdr.2017.0086
[15] Lin MF, Lin YY, Lan CY. Contribution of EmrAB efflux pumps to colistin resistance inAcinetobacterbaumannii[J]. J Microbiol,2017,55 (2):130-136. DOI: 10.1007/s12275-017-6408-5
[16] Lin XM, Yang MJ, Li H, et al. Decreased expression of LamB and Odp1 complex is crucial for antibiotic resistance inEscherichiacoli[J]. J Proteomics,2014,98(26):244-253. DOI: 10.1016/j.jprot.2013
[17] Zarate-Bonilla LJ, Del PP, Saenz-Suarez H, et al. Computational modeling and preliminary iroN, fepA, andcirA gene expression inSalmonellaEnteritidisunder iron-deficiency-induced conditions[J]. Poult Sci,2014,93(1):221-230. DOI: 10.3382/ps.2012-02993
