幽门螺杆菌克拉霉素异质性耐药及其特征分析
2018-05-28,,,
,,,
幽门螺杆菌(Helicobacterpylori,H.pylori,HP)对抗生素的耐药性是导致根除治疗失败的重要原因,药敏实验为判定HP是否具有抗药性的金标准方法。异质性耐药(heteroresistance),是指同一患者体内同时存在对某种抗生素敏感和耐药的菌株。异质性耐药的原因可能是最初的混合感染,也可能是菌株在宿主体内的长期感染过程中基因突变造的多种突变体[1],HP感染的相关特征尤为突出,因为HP一旦感染,不经规范根除治疗,慢性感染往往会持续多年。克拉霉素是HP根除疗法的一线药物,HP克拉霉素耐药问题已于2017年被世界卫生组织列为全球耐药问题高度优先级[2]。临床HP药敏试验通常选取数个分离培养单菌落,很难充分反映HP的异质性耐药情况。目前,国外关于HP对甲硝唑[3],克拉霉素[4],阿莫西林[5-6]的异质性耐药均有报道,中国人群感染的HP具有甲硝唑和克拉霉素高耐药特征,但对其异质性耐药的报道较少。Kao等[7]报道台湾存在左氧氟沙星、克拉霉素和甲硝唑的异质性耐药,Wong等[8]报道了香港的甲硝唑异质性耐药,但均缺乏对相关特征的深入分析。
多位点序列分型(multi-locus sequence typing,MLST)是对微生物的管家基因序列进行比对分析的常用分型方法。本研究通过对6个克拉霉素异质性耐药样本来源的81个HP克隆进行MLST分析,以期对HP的异质性耐药特征进行分析。
1 材料与方法
1.1分离培养及抗生素耐药检测 选用特制的黏液刷于胃镜下刷取某医院50例13C呼气试验阳性患者的胃窦黏液样本,进行HP分离培养 (Karmali培养基:OXOID公司,脱纤维羊血:北京兰博瑞生物制品有限公司),分离培养阳性者44例,对每个培养阳性样本挑选16个HP克隆(不足16个克隆者挑取所有HP克隆),用Etest法测定每个克隆的克拉霉素最低抑菌浓度(minimum inhibitory concentration, MIC)。依照CLSI的标准,将克拉霉素MIC≥1 mg/L的HP判定为耐药克隆。最终得到全敏感克隆相关病例24例,异质性耐药病例11例,全耐药克隆相关病例9例。从11例异质性耐药患者中选取6例MIC值差异较大的标本(编号1,2,3,4,5,6),共81个HP克隆,进行进一步的进化特征分析。
1.2 基于MLST的进化特征分析
1.2.1核酸提取 每个克隆进行扩大培养,并用QIAGEN公司的QIAamp DNA Mini Kit试剂盒(QIAGEN公司,德国)进行基因组的提取。
1.2.2PCR扩增测序 选取MLST官网推荐的8个管家基因(atpA,efp,mutY,ppa,trpC,ureI,vacA,yphC),引物序列参考http://pubmlst.org/helicobacter,见表1,对PCR扩增产物进行纯化并测序。引物合成由上海生工生物工程有限公司进行,扩增产物的纯化及测序由北京天一辉远生物科技有限公司进行。
表1 PCR扩增和测序引物
Tab.1 Primers used in PCR amplification and sequencing

基因引物序列(5′⁃3′)长度/bpatpAatpA_FGGACTAGCGTTAAACGCACG626⁃627atpA_RCTTGAAACCGACAAGCCCACefpefp_FGGCAATTTGGAT⁃GAGCGAGCTC410efp_RCTTCACCTTTTCAAGATACTCmutYmutY_FGTGGTTGTAGYTGGAAACTT⁃TACAC419⁃420mutY_RCTTAAGCGTGTGTYTTTCTAGGppappa_FGGAGATTGCAATGAATTTAGA398ppa_RGTGGGGTTAARATCGTTAAAT⁃TGtrpCtrpC_FTAGAATGCAAAAAAG⁃CATCGCCCTC456trpC_RTAAGCCCGCACACTT⁃TATTTTCGCCureIureI_FAGGTTATTCGTAAGGTGCG585ureI_RGTTTAAATCCCTTAGATTGCCvacAvacA_FACAACCGTGATCATTCCAGC364⁃445vacA_RATACGCTCCCACGTATTGCyphCyphC_FCACGCCTATTTTTTTGACTA⁃AAAAC504⁃531yphC_RCATTYACCCTCCCAATGATGC
1.2.3MLST分析 将81个HP克隆的8个管家基因进行序列分析,用MEGA 7.0软件中的clusterW程序对所有序列进行多序列比对,并与MLST数据库中的已有等位基因进行比对,将新的等位基因序列提交,以获得已有或新发现的等位基因序列号;提交新的等位基因谱(7个管家基因:atpA,efp,mutY,ppa,trpC,ureI,yphC),以获得已有或新发现的ST型别。
1.2.4菌株进化关系分析 将每个克隆的8个管家基因的核心序列串联成1个3 850 bp的序列,用MEGA 7.0软件中的clusterW程序对串联序列进行比对和分析,采用Bootstrap的1 000次重复,进化距离用最大似然法(Maximum Composite Likelihood method)计算,构建Neighbor-Joining系统发生树[9-12]。
2 结 果
2.1异质性耐药情况 44个分离培养成功的样本中,有20(46.51%)个克拉霉素耐药,耐药样本中有11(55.00%)例为异质性耐药,异质性耐药占全部分离培养阳性样本的25.58%。对6个异质性耐药样本分离所得的81个克隆对克拉霉素的MIC值,见图1。6个样本中耐药克隆所占比例为21.43%~90.91%(平均值62.00%,中位数75.00%)。6个样本内部MIC值差异很大。
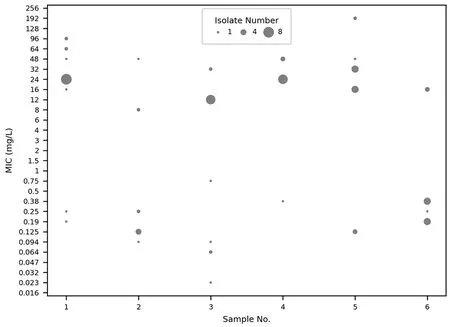
图1 6个异质性耐药样本中的81个HP克隆对克拉霉素的MIC值Fig.1 Clarithromycin MIC values of all 81 isolates in 6 heteroresistant samples
2.2MLST分析结果 对81个HP克隆的8个管家基因的核酸片段进行扩增、测序,得到的序列剪切后上传至MLST数据库,共获得17个ST型别,均为新发现的ST型。每个病例的9~16个分离株被分为1~6种不同的ST型,各分离株间vacA基因的差异又将其分为不同的基因型,见表2。
表2 81个HP克隆的ST型别,vacA基因型及对应克隆耐药情况
Tab.2 ST type, vacA genotype and clarithromycin susceptibility of all 81 isolates

样本ST型别vacA基因型分离株132067271⁃2,1⁃4,1⁃5,1⁃6,1⁃7,1⁃8,1⁃9,1⁃10,1⁃11,1⁃12,1⁃13,1⁃14,1⁃15,1⁃1632066611⁃1,1⁃3232077342⁃1,2⁃2,2⁃4,2⁃7,2⁃10,2⁃14,2⁃15,2⁃1632087342⁃3332097433⁃1,3⁃3,3⁃4,3⁃6,3⁃7,3⁃9,3⁃12,3⁃14,3⁃1632107433⁃232117433⁃5,3⁃8,3⁃11,3⁃13,3⁃15432127584⁃2,4⁃3,4⁃4,4⁃6,4⁃7,4⁃8,4⁃9,4⁃10,4⁃13,4⁃1432127594⁃11532137695⁃1,5⁃3,5⁃7,5⁃1032137735⁃4,5⁃13,5⁃15,5⁃1632137745⁃1432147695⁃2,5⁃932157695⁃5,5⁃632647695⁃832167695⁃1132177695⁃12632187856⁃2,6⁃832197856⁃3,6⁃4,6⁃5,6⁃10,6⁃1532207856⁃6,6⁃7,6⁃9,6⁃11,6⁃13,6⁃1632217856⁃14
注:克隆编号以下划线表示耐药克隆
对81个HP克隆构建进化树,见图2。1号样本的2个敏感克隆和14个耐药克隆同属ST3206型,但耐药克隆相比敏感克隆,vacA基因有2个碱基缺失,遗传距离为17.97%;2号样本的2个ST型别间有5个碱基差异,均位于yphC基因,遗传距离为0.13%;3号样本的3个ST型别间仅有1个碱基差异,遗传距离为0.03%~0.05%;4号样本的所有克隆同属1个ST型,但vacA基因有1个碱基差异,遗传距离为0.03%;5号样本的6个ST型各克隆间共有149个碱基差异,分布在7个等位基因(atpA,efp,mutY,ppa,ureI,yphC,vacA)中,两两组间遗传距离为0.03%~3.84%,eBURST分析将其分为2组,3213,3216,3264为1组,3215,2314,3217为1组;6号样本的4个ST型,atpA,mutY,ureI等位基因间分别相差10,13,7个碱基,组间遗传距离为0.18%~0.78%。可见来源于5号标本的克隆明显来源于至少2个型克隆,其他5例病人体内的HP在进化树中分别独立聚为单一克隆群,6份标本中的克隆在聚类中没有发现标本中的交叉。
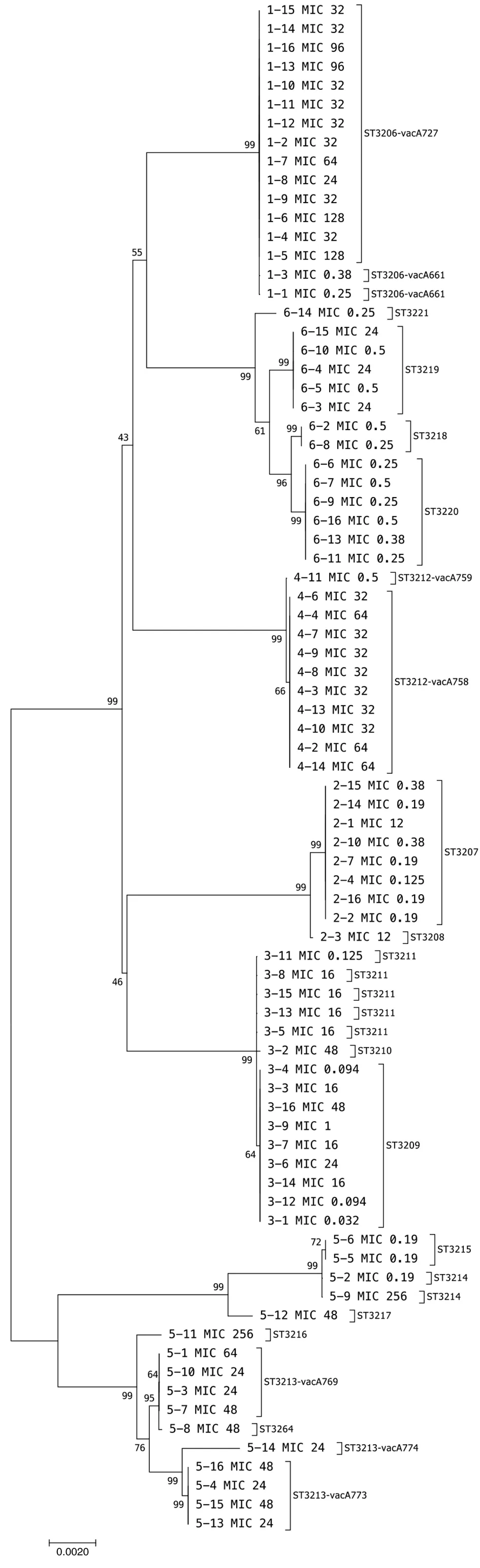
注:标尺单位为每个位点的碱基替换率图2 全部81个HP克隆的MLST系统进化分析Fig.2 Evolutionary relationships of 81 isolates
3 讨 论
本研究发现HP克拉霉素异质性耐药占全部分离培养阳性样本的25.58%,占耐药样本的55.00%,这种高异质性耐药现象应引起高度重视;其中耐药性克隆比例较低的异质性耐药样本,常规耐药性检测有较高的检测假阴性可能。
应用MLST方法对菌株进行遗传相关性分析,发现对6例异质性耐药患者的样本分离所得克隆,在5例中分别聚成单独的克隆群。推测在患者感染HP过程中引起异质性耐药的原因分为两类:一类是由于胃内的HP在长期感染的过程中一次或多次接触抗生素压力[13],因此尽管MIC值差异很大,克隆间遗传距离很近;另一类可能与不同HP菌株的混合感染相关[14]。
异质性耐药是对现有耐药检测方法的一大挑战,本研究提示来自中国人群的HP感染菌株存在明显的克拉霉素异质性耐药现象,进行传统药敏试验中对少数培养菌落的检测方式在某些病例可能不足以反映克拉霉素耐药的真实情况;如何改进HP克拉霉素耐药检测评价方法并指导临床HP感染的精准治疗,应引起高度重视。
参考文献:
[1] Mansour KB, Fendri C, Battikh H, et al. Multiple and mixedHelicobacterpyloriinfections: comparison of two epidemiological situations in Tunisia and France[J]. Infect Genet Evol, 2016, 37(7): 43-48. DOI: 10.1016/j.meegid.2015.10.028
[2] WHO. Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics [EB/OL]. (2017-02-27) [2018-01-09]. http://www.who.int/medicines/publications/global-priority-list-antibiotic-resistant-bacteria/en/.
[3] de la Obra P, Alarcon T, Domingo D, et al. Heteroresistance to metronidazole and genetic relationship ofHelicobacterpyloriclinical isolates[J]. Gut, 2001, 49(4): A4-A4
[4] Van der Ende A, Van Doorn LJ, Rooijakkers S, et al. Clarithromycin-susceptible and-resistantHelicobacterpyloriisolates with identical randomly amplified polymorphic DNA-PCR genotypes cultured from single gastric biopsy specimens prior to antibiotic therapy[J]. J Clin Microbiol, 2001, 39(7): 2648-2651. DOI: 10.1128/JCM.39.7.2648-2651.2001
[5] Mascellino MT, Porowska B, Nicosia R, et al. Impact ofHelicobacterpyloriresistance in unsuccessfully pluritreated patients in a Department of Infectious Diseases in Rome[J]. Microbiol Res, 2010, 1(e3): 15-20. DOI: 10.4 081/mr.2010.e3
[6] Matteo MJ, Granados G, Olmos M, et al.Helicobacterpyloriamoxicillin heteroresistance due to point mutations in PBP-1A in isogenic isolates[J]. J Antimicrob Chemother, 2008, 61(3): 474-477. DOI: 10.1093/jac/dkm504
[7] Kao CY, Lee AY, Huang AH, et al. Heteroresistance ofHelicobacterpylorifrom the same patient prior to antibiotic treatment[J]. Infect Genet Evol, 2014, 23(2): 196-202. DOI: 10.1016/j.meegid.2014.02.009
[8] Wong BCY, Wang WH, Berg DE, et al. High prevalence of mixed infections byHelicobacterpyloriin Hong Kong: metronidazole sensitivity and overall genotype[J]. Aliment Pharmacol Ther, 2001, 15(4): 493-503
[9] Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Mol Biol Evol, 1987, 4(4): 406-425
[10] Felsenstein J. Confidence limits on phylogenies: an approach using the bootstrap[J]. Evolution, 1985, 39(4): 783-791. DOI: 10.1111/j.1558-5646.1985.tb00420.x
[11] Tamura K, Nei M, Kumar S. Prospects for inferring very large phylogenies by using the neighbor-joining method[J]. Proc Natl Acad Sci U S A, 2004, 101(30): 11030-11035. DOI: 10.1073/pnas.0404206101
[12] Kumar S, Stecher G, Tamura K. MEGA7: Molecular evolutionary genetics analysis version 70 for bigger datasets[J]. Mol Biol Evol, 2016, 33(7): 1870-1874. DOI: 10.1093/molbev/msw054
[13] Mascellino MT, Porowska B, De Angelis M, et al. Antibiotic susceptibility, heteroresistance, and updated treatment strategies inHelicobacterpyloriinfection[J]. Drug Des Devel Ther, 2017, 11: 2209-2220. DOI: 10.2147/DDDT.S136240
[14] Cao Q, Didelot X, Wu Z, et al. Progressive genomic convergence of twoHelicobacterpyloristrains during mixed infection of a patient with chronic gastritis[J]. Gut, 2015, 64(4): 554-561. DOI: 10.1136/gutjnl-2014-307345
