豆清发酵液中乳酸菌的分离鉴定
2018-05-25邵阳学院食品与化学工程学院尹乐斌邵阳学院食品与化学工程学院豆制品加工技术湖南省应用基础研究基地罗健涛何宏亮杨凤凤邵阳学院食品与化学工程学院
□ 阳 慧 邵阳学院食品与化学工程学院 尹乐斌 邵阳学院食品与化学工程学院 豆制品加工技术湖南省应用基础研究基地 罗健涛何宏亮 杨凤凤 邵阳学院食品与化学工程学院
目前,食品安全问题越来越突出,食品安全问题一方面会对人的身体健康造成危害,另一方面也会对国家的经济和企业的发展造成一定的影响。自然发酵工艺的弊端有:①豆腐的凝乳效果极易受生产车间环境及生产的气候的影响;②食用安全性差,会有致病菌或者腐败菌混入;③发酵条件不稳定,不利于豆制品行业的工厂化、规模化及标准化;④不易操作、对人员、设备的要求高等特点,不仅影响了豆腐得率和豆腐的品质,更是阻碍了此类休闲豆干的进一步推广。这种快速发展的良好势头下,主要在于市场上对豆制品消费的认可,其中国家的调控也产生了很大的积极影响,这样能够更好地促进豆制品加工企业的发展,使之更加规范,同时也会给豆制品企业带来一个更好的适应环境,推动我国豆制品行业进入一个快速成长期,带动整个行业内部的调整。因此,我国豆制品企业在重点关注行业发展方向的同时,也要注重自身管理水平的提高,做出能够推动并适应市场发展的新产品,重点提高产品的质量,这样才能在新时代中把握住发展的机遇。
自汉代以来,豆腐就成为我国最主要的传统大豆加工产品,遍布大街小巷的豆腐作坊数不胜数。可见豆腐以及豆制品深受广大消费者喜爱,但是豆清发酵液中的微生物情况一直不清楚,有何种微生物产酸以及微生物的具体代谢情况尚不明确,所以难以实现工业化生产,产品质量难以控制。乳酸菌的分离鉴定方法有很多,本文通过传统分离培养方法从豆清发酵液中分离得到乳酸菌,通过产酸量等指标筛选出优势产酸菌,再经过菌体菌落特征、生理生化实验以及16S-rDNA分子生物学鉴定[1],进一步确定该株产酸菌。为后续纯种发酵提供产酸菌株,为点浆技术提供一定的基础。
1 材料与方法
1.1 样品与试剂来源
豆清发酵液(湖南省恭兵食品有限公司);NaOH(分析纯,天津市化学试剂厂);酚酞(分析纯,天津市化学试剂厂);葡萄糖(食品级,天津市致远化学试剂有限公司);盐酸(分析纯,西晚化工股份有限公司);柠檬酸(食品级,天津市博迪化工股份有限公司);硫酸铜(分析纯,天津市双船化学试剂厂);硫酸钾(分析纯,天津市天力化学试剂有限公司);碳酸钠(食品级,天津市双船化学试剂厂)。
乳酸菌选择性培养基(M RS):蛋白胨10 g,酵母提取物5 g,葡萄糖20 g,牛肉膏5 g,柠檬酸三铵2 g,吐温80 1.08 g,磷酸氢二钾2 g,硫酸镁0.2 g,硫酸锰0.05 g醋酸钠5 g,,蒸馏水1 000 mL ,琼脂15 g,调节pH值6.2~6.4。
1.2 仪器来源
电热恒温培养箱(上海博迅实业有限公司医疗设备厂);手提式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂等)。
1.3 试验方法
1.3.1 稀释涂布
用已灭菌的移液枪吸取1 mL的豆清发酵液样品,使用无菌的生理盐水分别对其进行1-1、10-2、10-3梯度的稀释处理,不同稀释度悬液分别吸取0.1 mL进行涂布并将其接种0于MRS固体的培养基上[2],等菌液渗入培养基后,倒置于37 ℃恒温培养24 h。
1.3.2 分离纯化
挑取菌落特征不同的单菌落在固体培养基上进行划线分离,分离纯化多次,直至划线培养得到单菌落。
1.3.3 产酸菌的初筛
分别挑取分离纯化后的菌株接种于改良MRS固体培养基上,置于37℃恒温培养箱静置培养48 h后,观察是否有溶钙圈。如果没有溶钙圈,不是目标菌株。
1.3.4 产酸菌的复筛
通过纸层析法检测分离[3]得到的菌株发酵产物中是否产生乳酸(用乳酸作对照)使用甲酸二正丁醇∶水=2∶10∶1的展开剂展开,紧接着用甲基红-溴酚蓝显色剂5(0.04%溴甲酚紫酒精溶液)进行显色,若层析纸上的斑点显现黄色,则此菌株为阳性,进一步确定Rf值,若Rf值与乳酸的值相近,可确定检测菌株为乳酸菌。
1.3.5 优势产酸菌的确定
测定比较菌种在不同发酵时期的产酸量与pH,筛选出产酸能力强的菌株,编号为LDS201。
①酸量的测定:将产乳酸的纯种菌株接入MRS液体培养基中,于37 ℃的培养箱中摇瓶培养,分别在0、4、8、16、20、24 h时取出测定摇瓶内培养液的乳酸量。乳酸含量测定用总酸测定方法,用标定后的NaOH标准溶液(约0.10 moL/L)进行滴定测量。②pH值的测定:采用EL20 pH计测定。
1.3.6 产酸菌菌落菌体形态的鉴定
观察细菌的菌落形态、菌落颜色、形状、透明度,并挑取单菌落进行革兰氏染色后镜检,蓝色或紫色为革兰氏阳性菌,红色则为革兰氏阴性菌。
1.3.7 产酸菌菌体的生理生化鉴定
对筛出的优势菌株进行生理生化特性实验,本文应用Sensititre(先德)微生物鉴定仪进行鉴定。
(1)富集培养:将分离纯化后的菌种接种到营养琼脂培养基上,划线培养,于37 ℃的恒温培养箱中培养18~24 h。
(2)浊度调整:取标准浊度管,在浊度仪上进行调整,显示灯亮绿色就表示可以了,再用灭菌棉签挑取培养24 h的细菌菌落,在无菌状态下接到浊度管中,振荡摇匀,再将浊度管放在浊度仪上测量,直到调至显示灯亮绿色。
(3)接种鉴定板:将浓度调好之后的菌悬液在无菌操作台下倒入V型加样槽中,然后用50μL的移液枪吸取已调好的菌悬液滴加到标准的鉴定板上,再于制定的孔中滴加石蜡油,然后贴好膜后置于恒温培养箱中于35 ℃条件下培养。
(4)读取数据:开启鉴定系统,将已培养16~24 h的微生物鉴定板放到Sensititre微生物自动鉴定仪的读数仪上,点击读板操作,之后仪器根据反应情况,按照概率值得出该菌株的名称。
参考《伯杰氏细菌鉴定手册》[4]第8版、《常见细菌系统鉴定手册》和《乳酸菌分类鉴定及实验方法》。
1.3.8 LDS201菌株16s rDNA序列鉴定
送上海美吉生物有限公司测序[5],技术路线:基因组DNA提取→预实验摸索PCR扩增条件→特定引物PCR扩增并纯化→产物测序→进化树分析。
1.3.8.1 提取DNA
收集100 mg菌体,加液氮研磨充分;加入400 μL DNA 提取缓冲液,充分混匀;65 ℃水浴,10 min。再加入130μL 3 mol/L 醋酸钾(KAC),冰浴5 min;加入400 μL 氯仿:异戊醇(24∶1),充分混匀;13 000 g离心10 min;移取400 μL上清入新的1.5 mL 离心管,并加入等体积的异丙醇,室温放置10 min;弃去上清,加 入1 mL 75%乙 醇,13 000 g,2 min;弃净上清,加入 20~30 μL ddH2O,溶解沉淀。
1.3.8.2 PCR扩增rDNA序列
EX Taq 酶(TaKaRa),dNTP(TaKaRa),引物(Invitrogen 合成)。反应条件:95 ℃预变性5 min,95 ℃变性 30 s,55 ℃退火2 min,72 ℃延伸1 min 30 s,共24个循环;72 ℃总延伸10 min。
1.3.8.3 测序
将扩增片段进行测序。
1.3.8.4 BLAST
根据测序结果与NCBI网站[6]已有序列进行BLAST,进而确定其分类地位。
1.3.8.5 BLAST结果的确认
根据BLAST结果,搜索该菌种相关报道,确认其形态特征是否吻合。如果尚且不能确定,添加相应的实验来证明。
2 结果与分析
2.1 产酸菌的初筛
由于改良的选择性乳酸培养基中添加了CaCO3,所以随着乳酸菌的生长,乳酸菌产生的酸会溶解培养基中的CaCO3,在菌落周围形成透明圈。有透明圈说明A、B、C菌株都产酸。
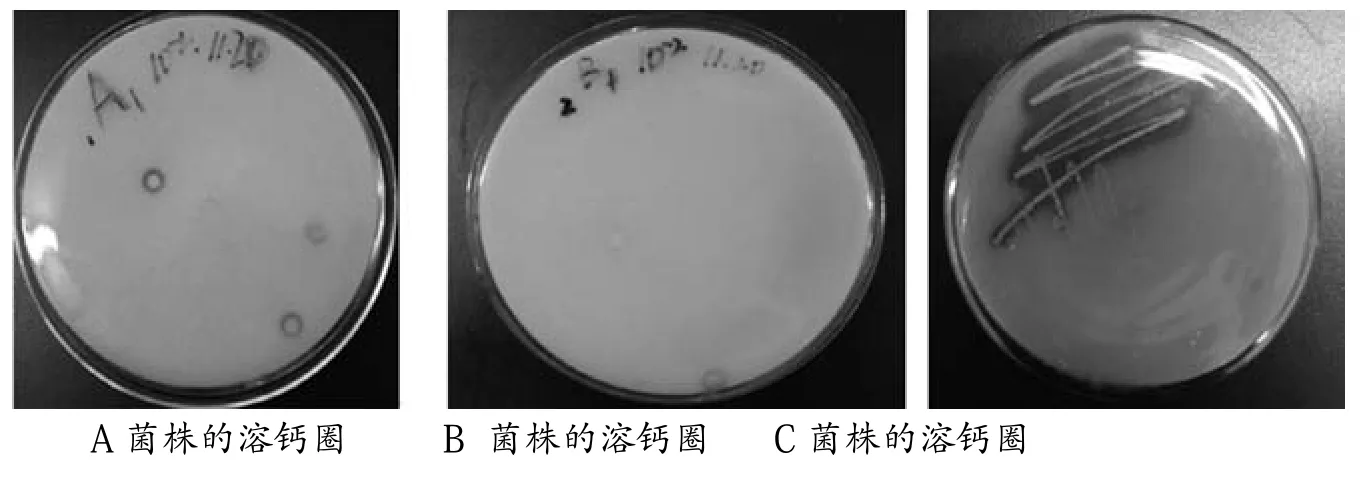
图1 各菌株的溶钙圈平板图

表1 菌株发酵液Rf值比较
2.2 产酸菌的复筛
通过对所分离得到的菌株进行纸层析法检测结果发现,如表1所示菌株发酵液与标准乳酸纸层析具有相近Rf值,表明菌株发酵产物中有乳酸。菌株C的Rf值为8.102与乳酸的最接近。
2.3 确定优势产酸菌[7]
由于乳酸菌在豆清液中的生长速度不同,所产生的总酸量的多少及发酵液pH值下降速度有所不同,如图2、图3所示。
从图2、图3可知,在相同的条件下,菌株C比菌株A和菌株B产酸多,发酵24 h内,菌株C 产酸量直线上升,产酸性能比较稳定,说明可以用于后续纯种生产发酵。菌株C命名为LDS201。
2.4 菌株LDS201菌落特征和菌体形态的鉴定结果
观察LDS201平板发现:菌落呈乳白色,呈圆形,中心有白点凸起,边缘整齐光滑,不透明(如图4所示),直径约为0.7 μm,容易用针挑起,菌落质地均匀。从平板上挑取菌株进行革兰氏染色,发现该菌体为短杆状,革兰氏阳性菌,如图5所示。
2.5 菌株LDS201生理生化鉴定结果
用先德微生物仪鉴定菌株LDS201无结果,可能是微生物鉴定仪中没有收录这个菌株。所以设置生理生化实验,结果表明葡萄糖产酸试验、柠檬酸盐利用试验、牛奶石蕊试验以及淀粉水解试验呈阳性,过氧化氢酶、V.P.试验、M.R.试验、蔗糖产酸试验、乳糖产酸试验、明胶水解试验、吲哚试验呈阴性。根据上述结果结合菌株菌落特征以及菌体形态并参照伯杰氏细菌鉴定手册(第8版)推断,得出LDS201菌株为乳杆菌属,并且此菌能利用葡萄糖产酸,不能利用蔗糖和乳糖产酸,能水解淀粉,这为后续的培养基优化条件提供参考。
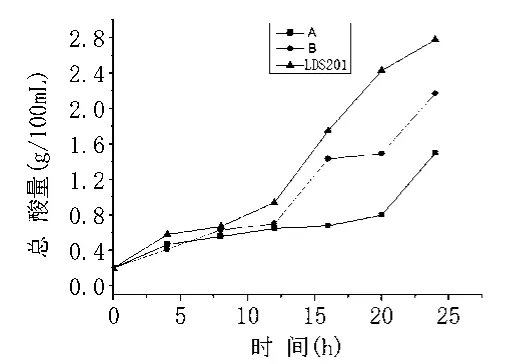
图2 24 h内发酵液总酸量的变化

图3 24 h内发酵液pH值的变化
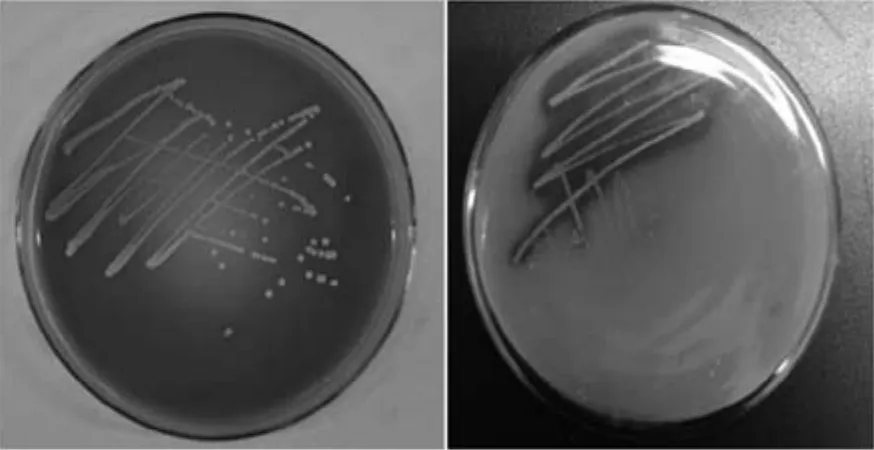
图4 LDS201菌落形态
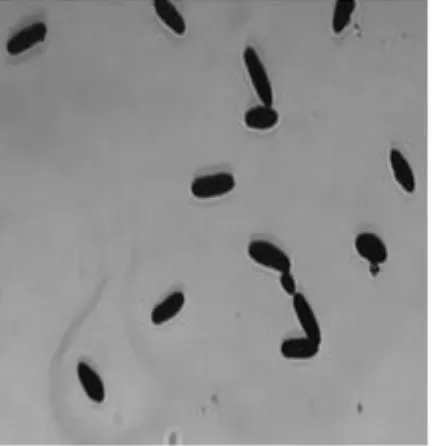
图5 LDS201菌体形态

图6 菌株LDS201的16S-rDNA PCR产物电泳
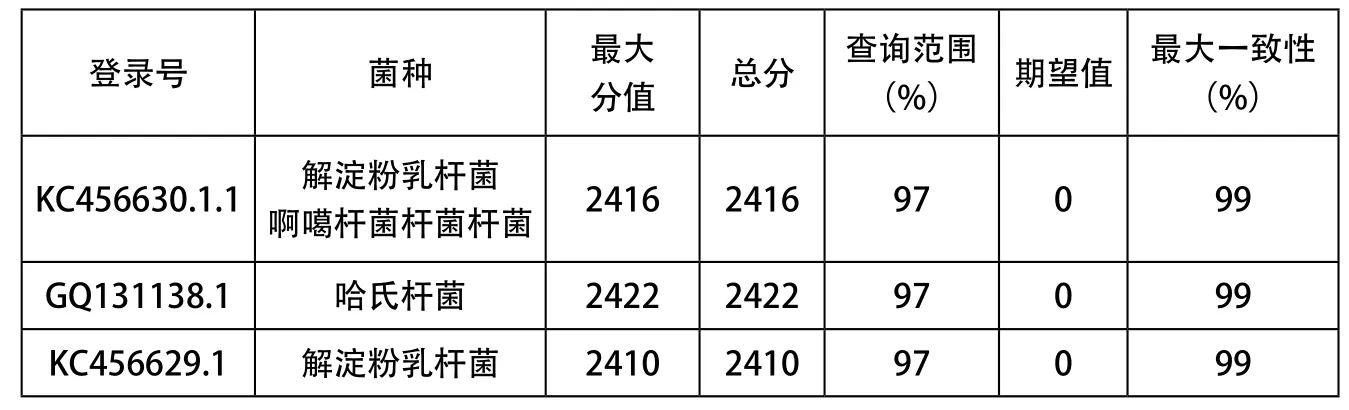
表2 rDNA序列有意义的对比序列
2.6 LDS201菌株16s rDNA鉴定
将测序得到的16S rDNA序列在NCBI上进行Blast比对,即可获知与该序列同源性较高的已知序列,为确定菌种的分类学地位提供依据。微生物因为体积小、质量轻、适应性强、繁殖能力强等特点,广泛分布于自然界中。DNA测序进行菌种鉴定比传统生化鉴定更加精确。DNA测序不依赖菌种本身特点,对所有菌种均可适用。比传统生化鉴定更加快速,准确。关键是得到纯菌株,获得足够的基因片段。
2.6.1 16S rDNA PCR产物电泳
菌株LDS201的16SRNA的PCR扩增产物经1%琼脂糖凝胶电泳,检测显示基因组DNA条带的位置正确,清晰可辨。结果如图6所示。
由图6可知, Marker自左到右分 别 为 2 000、1 000、750、500、250、100。产物中最亮的条带与1 500 bp位置相近,亮度和纯度都达到了要求,可以继续后续实验。DNA总长度大概在1 314 bp左右,把菌株LDS201的16S rDNA测序结果提交到基因库中,利用NCBI GenBank数据库的BLAST程序进行序列同源性比对,按照总分从高到低,期望值由小到大,选择前3株列于表3中。
2.6.2 构建菌株LDS201系统发育树
本文构建了菌株LDS201系统发育树,如图7所示。
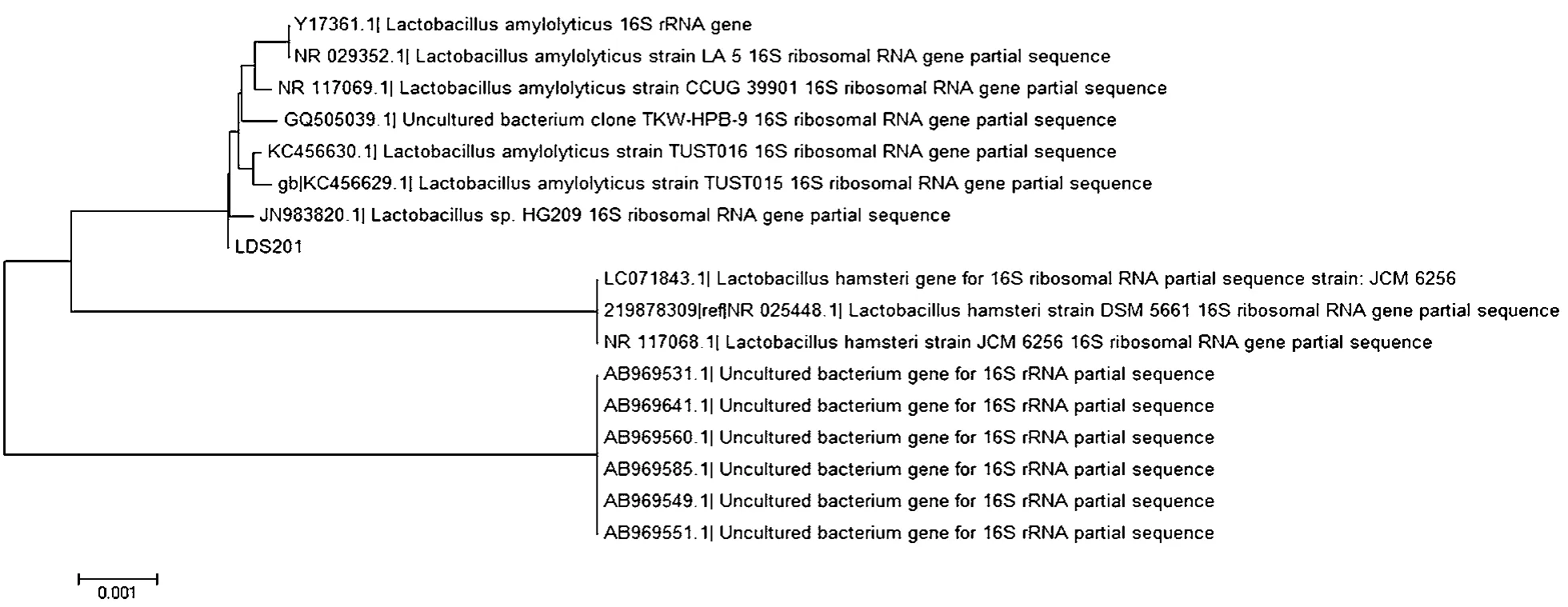
图7 LDS201菌株16S-rDNA系统发育树
结果显示菌株LDS201的16S-rDNA序列与解淀粉乳杆菌(Lactobacillus amylolyticus)同源性达99%。再结合形态特征、生理生化特征,鉴定该菌为乳杆菌属中的解淀粉乳杆菌(Lactobacillus amylolyticus)[8]。
3 结论
(1)通过乳酸菌选择性培养基分离培养得到单菌株,有溶钙圈说明菌株产酸,乳酸定性分析可以初步确定为乳酸菌。
(2)通过比较不同菌株在相同发酵时间下的产酸量与发酵液pH值,筛选出产酸量能力强的菌株C,编号为LDS201。
(3)通过观察LDS201的菌落形态特征:菌落呈乳白色,呈圆形,中心有白点凸起,边缘整齐平滑,不透明无光泽(如图4所示),直径约为0.7 μm,容易用针挑起,菌落质地均匀,从平板上挑取菌株进行革兰氏染色,发现该菌体为短杆状,革兰氏阳性菌。通过生理生化指标的测定可以初步确定为乳杆菌。经16S-rDNA序列分析以及同源性比对,进一步确定优势菌为解淀粉乳杆菌(Lactobacillus amylolyticus LDS201)。
