椪柑浮皮时挥发性成分变化及萜烯类物质合成基因表达特征
2018-05-23姚世响邓丽莉曾凯芳
姚世响,曹 琦,谢 姣,邓丽莉,曾凯芳,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
浮皮是柑橘果实在采后衰老过程中的一种生理紊乱,表现为果皮与果肉分离,常伴随着果肉的枯水,果实糖酸品质劣变、风味变淡,严重时不堪食用,丧失商品价值[1-2]。浮皮发生于温州蜜柑、椪柑、红橘等多类柑橘果实,是目前柑橘产业面临的重要问题[1,3]。浮皮的发生机制非常复杂,与采前因素(包括品种、砧木、气候和果园管理等)和采后因素(贮藏条件等)都密切相关[1,4-5];目前从细胞壁降解酶、呼吸作用、矿质元素、内源激素等角度对柑橘果实浮皮进行了多方面研究[3,6-10];迄今为止,对浮皮发生的机理尚不明确,还需从更多角度、更深层次进行分析。
柑橘果皮具有的特殊香味主要来源于果皮油胞所合成的挥发性物质[11],其主要成分为萜烯类化合物[12-13]。萜烯类化合物的基本结构是异戊二烯,在植物中有2 种合成途径:甲羟戊酸(mevalonate pathway,MVA)途径和2-C-甲基-D-赤藓糖醇-4-磷酸(methyl-erythritol-4-phosphate pathway,MEP)途径[14]。MVA途径的产物主要为倍半萜和三萜,MEP途径的产物主要为半萜、单萜、二萜和多萜。异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)和二甲基烯丙基焦磷酸酯(dimethylallyl pyrophosphate,DMAPP)是萜类化合物合成的2 种前体。IPP合成途径中,乙酰乙酰辅酶A硫解酶(acetoacetyl-CoA thiolase,ACAT)将两分子乙酰辅酶A合成乙酰乙酰辅酶A。在MEP途径中,1-去氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase,DXR)催化5-磷酸脱氧木酮糖(1-deoxy-D-xylulose 5-phosphate,DOXP)生成MEP[14]。4-羟基-3-甲基-2-丁烯-焦磷酸合成酶(4-hydroxy-3-methylbut-2-enyl diphosphate synthase,HDS)催化2-C-甲基赤藓糖醇2,4-环焦磷酸(2-C-methyl-D-erythritol 2,4-cyclodiphosphate,ME-cPP)生成1-羟基-2-甲基-2-丁烯-4-焦磷酸(1-hydroxy-2-methyl-2-butenyl 4-diphosphate,HMBPP)[14]。HMBPP进一步由4-羟基-3-甲基-2-领苯基二磷酸还原酶(4-hydroxy-3-methylbut-2-enyl diphosphate reductase,HDR)和IPP异构酶(isopentenyl diphosphate isomerase,IPI)催化生成IPP。香叶基香叶基焦磷酸合成酶(geranylgeranyl pyrophosphate synthase,GGPS)和香叶基香叶基还原酶(geranylgeranyl reductase,GGR)参与催化二甲基烯丙基焦磷酸酯(dimethylallyl pyrophosphate,DMAPP)生成香叶基焦磷酸(Geranyl-PP,GPP),而GPP则是合成单萜类化合物的前体[14]。在二萜类化合物合成途径中,贝壳杉烯酸羟化酶(ent-kaurenoic acid hydroxylase,KAO)和GA20-氧化酶(gibberellin 20 oxidase 2,GA20ox2)是2 个重要的酶[15]。在倍半萜和三萜合成途径中,鲨烯合酶(squalene synthase,SQS)和萜类环化酶(terpenoidcyclases,TCS)是2 个重要的酶,SQS催化合成鲨烯,而鲨烯则是植物体内三萜、甾醇等萜烯类物质合成的共同前体[16]。
柑橘果实在采后贮藏过程中,果皮是响应外界逆境和应对果实衰老的第一道防线,其生理状态也可在某种程度上反映果实的内部状况[17]。但目前对于果皮挥发性物质在发生浮皮时是否会发生改变,还缺乏更多的实验证据。另外,尽管前人对柑橘果皮挥发性物质合成途径中的相关基因已经进行了研究[14,18-19],但这些基因的表达情况在采后贮藏过程中尤其是浮皮时的变化规律尚不清楚。
柑橘是世界产量最大的水果,其中椪柑(Citrus reticulata Blanco cv. Ponkan)有“橘中之王”的美誉,果实糖分含量高、香气浓郁,具有较高的商品价值[20]。重庆地区的椪柑常在11~12月成熟并上市,果农和相关企业为了缓解这种短时间大量上市造成的滞销和价廉等问题,需要对果实进行贮藏;椪柑的耐贮性能并不好,在贮藏过程中极易发生浮皮[5,21]。本研究以采后贮藏过程中的椪柑果实为实验材料,运用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)技术和RNA-Seq技术,分别分析椪柑果实浮皮时,果皮挥发性物质的变化规律和萜烯类合成途径相关基因表达的变化特征,研究结果对理解浮皮的发生机制具有重要意义。
1 材料与方法
1.1 材料与试剂
椪柑果实于2015年12月采于重庆市北碚区柑橘果园。成熟的果实在采收后运回实验室,挑选大小和色泽一致、表面无机械损伤和疤痕的果实,经2,4-二氯苯氧乙酸和咪鲜胺处理后,用聚乙烯薄膜单果套袋。椪柑果实贮存于冷库中(8~10 ℃、相对湿度80%~85%)。在贮藏期间,观察浮皮发生情况,在贮藏100 d时部分果实出现明显的浮皮症状,即果皮与果肉分离、有明显间隙,此时选择浮皮程度一致的果实作为浮皮样品,正常果实作为对照组样品。果皮样品用液氮冷冻后,存于-80 ℃冰箱备用。实验重复3 次。
癸酸乙酯(纯度>98%) 阿达玛斯试剂有限公司;甲基叔丁基醚(methyl tert-butyl ether,MTBE)(色谱纯) 上海梯希爱化成工业发展有限公司;TRIzol试剂 上海英俊生物技术有限公司。
1.2 仪器与设备
GCMS-QP2010 plus GC-MS联用仪 日本岛津公司;ZLS-1真空离心浓缩仪 湖南赫西仪器装备有限公司。
1.3 方法
1.3.1 GC-MS样品制备
采用Ding Yuduan等[17]的方法,准确称取1.00 g果皮样品,用液氮充分研磨成粉末。加入5 mL MTBE和42.5 μg癸酸乙酯(内标),充分混匀,低温超声1 h。将有机相在离心浓缩仪中浓缩至0.3 mL,用直径0.22 μm的滤膜过滤后上机。
1.3.2 GC-MS条件
GC条件:DB-5MS石英毛细管柱(30 m×0.25 mm i.d.,0.25 µm);升温程序:初始温度40 ℃,以3 ℃/min升到50 ℃,保持1 min;以2 ℃/min升至70 ℃,保持3 min;以3 ℃/min升至160 ℃,保持2 min;以8 ℃/min升至220 ℃,保持2 min;载气(He,99.999%)流速0.80 mL/min;压力33.8 kPa;进样口温度250 ℃;进样量1 µL;不分流进样。
MS条件:电子电离源;电子能量70 eV;离子源温度230 ℃;接口温度250 ℃;ACQ方式:扫描;质量扫描范围m/z 30~400。
1.3.3 RNA-Seq分析
用TRIzol试剂提取果皮RNA,取3 μg用NEBNext Ultra RNA Library Prep Kit for Illumina(New England BioLabs, MA, USA)构建cDNA文库;然后用Illumina Hiseq平台测序。原始测序文件(RAW data)用Perl脚本语言处理获得高质量的数据,然后用TopHat v2.0.12与柑橘(Citrus clementina)基因组进行比对。基因表达水平用FPKM方法表示[22]。运用校正的P值衡量2 个样品之间的差异显著性。
1.4 数据分析与处理
谱图基于NIST 08和NIST 08S数据库的检索结果,进行定性分析,采用内标对各组分进行定量分析。作图采用Graphpad Prism 7.0和Photoshop软件进行。数据之间差异的显著性采用t检验进行统计学判断(P<0.05)。
2 结果与分析
2.1 椪柑果皮挥发性物质成分的鉴定

表1 椪柑果皮中挥发性物质含量Table 1 Contents of volatile components in peel of ponkan fruit

续表1
对提取的椪柑果皮挥发性物质采用GC-MS分析,将获得的质谱图检索NIST 08和NIST 08S数据,根据相似度、洗脱时间和相关文献报道对挥发性物质进行鉴定。结果显示,本实验鉴定出53 种挥发性成分,如表1所示,其中萜烯类物质24 种(包括单萜烯类、倍半萜烯类和其他萜烯类)、醇类物质11 种、醛类和酮类物质13 种、酯类物质4 种和1 种其他类物质(柠檬烯氧化物)。
2.2 浮皮对椪柑果皮挥发性物质组分及含量的影响
本研究对正常和浮皮果实的果皮挥发性物质进行鉴定分析,发现组分均为53 种,即挥发性物质的数量在正常和浮皮果实之间不存在差异。进一步用内标法对这53 种组分进行定量分析,在正常果实中,萜烯类物质占果皮总挥发性物质含量的96%,表明萜烯类物质是椪柑果皮挥发性物质中含量最高的一类。而萜烯类物质中D-柠檬烯占果皮总挥发性物质含量的69%,表明D-柠檬烯是椪柑果皮挥发性物质中丰度最高的组分。定量分析结果显示,在两类果实中,浮皮果实的果皮挥发性物质总含量显著降低,为正常果实的82%(P<0.05),其中浮皮果实中果皮萜烯类物质的含量下降为正常果实的81.4%。在这53 种组分中,32 种组分的含量有显著性差异(P<0.05),其余21 种组分的含量无显著性差异。浮皮前、后挥发性物质的定性与定量结果见表1。
2.2.1 萜烯类物质
本研究通过鉴定共得到24 种萜烯类物质,可分为单萜烯类、倍半萜烯类和其他烯类3 大类,总含量在浮皮时降低为对照果实的81.4%。单萜烯类物质组分有8 种,其中α-蒎烯、β-月桂烯、D-柠檬烯、γ-松油烯和α-异松油烯在浮皮时含量显著降低,分别为正常果皮的79.7%、78.2%、79.7%、85.7%和86.9%,仅顺-β-罗勒烯的含量在浮皮果实果皮中升高,α-侧柏烯和水芹烯等组分的含量在浮皮时没有发生显著改变(表1)。倍半萜烯类物质组分有15 种,大多数(10 种)组分的含量在浮皮时没有发生显著改变,β-倍半水芹烯在浮皮时含量减少为正常果实的12.8%,α-金合欢烯和β-金合欢烯2 种组分在浮皮时含量升高(表1)。其他烯类物质有2-甲基-1-苯基丙烯,在浮皮时含量显著升高。
2.2.2 醇类物质
通过鉴定共得到11 种醇类物质,总含量在浮皮时升高了28.8%。其中,1-辛醇、榄香醇、橙花叔醇和白千层醇在浮皮时含量显著降低,为正常果实的96.4%、54.4%、48.3%和64.3%;而芳樟醇、香芹醇、4-萜品醇和α-松油醇在浮皮时含量显著升高,其余3 种醇类物质的含量在2 种果皮间不存在显著性差异。
2.2.3 醛类和酮类物质
通过鉴定得到了13 种醛类和酮类物质,总含量在浮皮果实中降低为对照果实的87.9%,其中壬醛、癸醛、十一醛、柠檬醛和α-甜橙醛在浮皮果实的含量均显著低于正常果实,2,6,10-三甲基-2,6,9,11-十二碳四烯醛与香芹酮在浮皮时含量显著升高。
2.2.4 酯类物质和其他类挥发性物质
本研究成功鉴定得到了4 种酯类物质,总含量在浮皮时降低为正常果实的76.1%。这4类挥发性物质包括乙酸辛酯、乙酸香茅酯、乙酸橙花酯和乙酸香叶酯,在浮皮时分别降低为对照的83.0%、69.5%、81.1%和84.8%。另外,柠檬烯氧化物在浮皮果实中的含量显著高于正常果实(表1)。
2.3 浮皮对椪柑果皮萜烯类合成途径基因表达的影响
2.3.1 萜烯骨架合成途径基因
如图1所示,在萜类化合物骨架合成途径中,一共鉴定到8 个差异表达的基因,分别为acat2、dxr、hds、hdr、ipi1、ggps1、ggr、pcme。其中,pcme表达量显著升高,由对照组的11.4升高至19.1(P<0.05)。acat2、dxr、hds、hdr、ipi1、ggps1、ggr表达量显著下调,分别由对照组的95.2、214.3、333.1、215.2、300.0、65.8、47.3下降至浮皮时的66.3、145.6、252.0、170.9、235.4、48.1、39.8(P<0.05)。
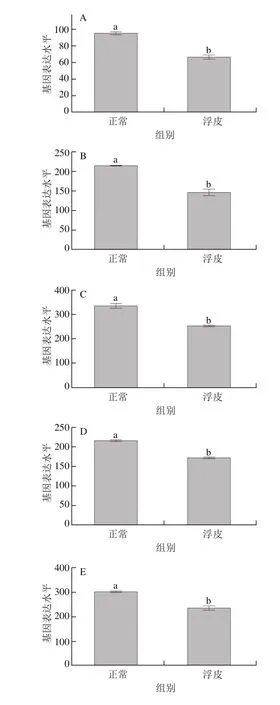
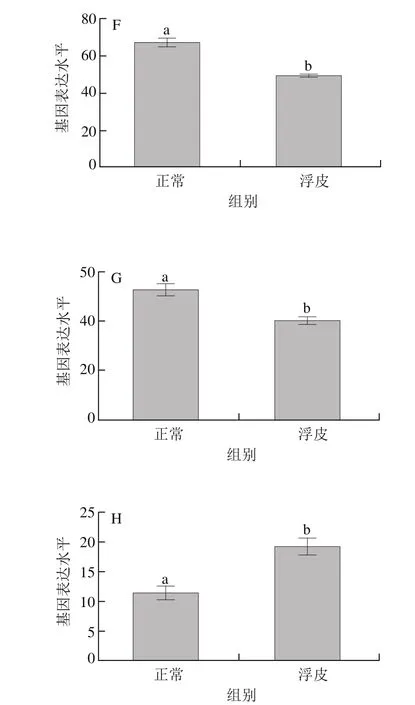
图1 萜类骨架合成途径基因在浮皮时的表达特征Fig. 1 Expression patterns of genes involved in terpenoid backbone biosynthesis during peel puffing
2.3.2 二萜合成途径基因
如图2所示,在二萜合成途径中,一共鉴定到4 个差异表达基因,在浮皮时均呈现显著下调的趋势(P<0.05)。本研究鉴定到3 个编码KAO的基因,分别是kao1、kao2和kao3,在浮皮时均显著下调表达(P<0.05),表达量在正常果实中分别为18.9、11.0、47.0,在浮皮果实中分别为10.6、4.9、27.3。本研究还鉴定到一个编码GA20ox的基因ga20ox,在浮皮时表达量显著下调(P<0.05),由正常果实中的8.8降低为浮皮果实中的4.6。


图2 二萜合成途径基因在浮皮时的表达特征Fig. 2 Expression patterns of genes involved in diterpenoid biosynthesis during peel puffing
2.3.3 倍半萜和三萜合成途径基因

图3 倍半萜和三萜合成途径基因在浮皮时的表达特征Fig. 3 Expression patterns of genes involved in sesquiterpenoid and triterpenoid biosynthesis during peel puffing
如图3所示,在倍半萜和三萜合成途径中,一共鉴定到2 个差异表达的基因。本研究鉴定到一个编码SQS的基因sqs1,在浮皮时显著下调(P<0.05),sqs1表达量由正常果实中的47.1下降为浮皮中的35.9。本研究鉴定到一个编码TCS的基因tcs,在浮皮时表达量显著下调(P<0.05),tcs表达量由正常果实中的5.8下降为浮皮中的3.2。
3 讨 论
浮皮是柑橘在贮藏时高发的一种生理性病害,表现为果皮与果肉明显分离,常与果肉枯水伴生,严重影响柑橘食用价值[1]。目前对于柑橘浮皮的发生机制还没有明确结论。本研究以重庆地区生产的椪柑为研究材料,发现在贮藏3 个月后,部分果实开始出现浮皮症状。并且随着贮藏时间延长,浮皮果实的数量逐渐增加,浮皮症状也逐渐加重。在采前并没有观察到椪柑的浮皮现象,这表明采后贮藏是椪柑果实浮皮的关键诱发因素。本研究选择贮藏100 d时浮皮程度一致的果实作为浮皮样品,正常果实作为对照组样品,从挥发性物质的角度研究椪柑的浮皮机制。结果表明椪柑果实浮皮时,挥发性物质组分没有变化,但含量显著降低。进一步分析了浮皮对萜烯类物质合成代谢途径相关基因表达的影响,结果显示与萜烯合成相关的基因表达量显著下降,这表明果实发生浮皮时挥发性物质含量的降低,与芳香物质合成受到抑制密切相关。
本研究从椪柑果皮一共鉴定了53 种挥发性物质组分,包括单萜烯类、倍半萜烯类、醛酮类和酯类等,其中萜烯类物质含量占96%,D-柠檬烯含量占单萜烯类物质的67%,是含量最高的单一组分。椪柑的其他研究也有类似结果,科学家从印度东北地区和日本高知县的椪柑中分别鉴定到37 种和39 种果皮挥发性物质,含量最多的为萜烯类化合物[23-24]。这种挥发性物质的组成特征与之前在莽山野柑[11]、柠檬[25]、柚类果实[26]的研究结果一致。占果皮挥发性物质绝大部分含量的萜烯类物质在浮皮时降低为正常果实的81.4%,相应地,果皮挥发性物质总量在浮皮时降低为正常果实的82%(P<0.05)。本研究鉴定的24 种萜烯类物质分为单萜烯类、倍半萜烯类和其他烯类,包括α-蒎烯、β-月桂烯、D-柠檬烯、γ-松油烯和α-异松油烯在内的单萜烯类物质在浮皮时含量显著降低,分别为正常果皮的79.7%、78.2%、79.7%、85.7%和86.9%,其中,β-倍半水芹烯在浮皮时含量减少为正常果实的12.8%。这些萜烯类物质含量的降低是椪柑在浮皮时挥发性物质含量降低的主要原因。为了进一步分析萜烯类物质含量降低的原因,本研究首次运用RNA-Seq技术[22]对椪柑果实在浮皮时基因表达的变化进行分析,结果显示编码萜烯类物质合成的基因在浮皮时表达量显著下降。在萜类化合物骨架合成途径中,共有7 个基因在浮皮时表达下调,包括acat2、dxr、hds、hdr、ipi1、ggps1和ggr,其中,acat2与dxr分别具有调控MVA合成途径与MEP途径的功能。在二萜合成途径[19]中,kao1、kao2、kao3和GA20ox在浮皮时表达量显著下降。在倍半萜和三萜合成途径[19]中,sqs1和tcs在浮皮时表达量显著下降。芳香类物质的含量在细胞内处于合成与降解的动态变化中,其含量的高低取决于合成和降解的速度[27-28]。本研究基于正常果实和浮皮果实中基因的差异表达模式得出如下结论:浮皮时,果皮挥发性物质的合成途径受到抑制,从而导致挥发性物质总含量下降。
由于柑橘浮皮的发生机制十分复杂,仅根据某些相关基因表达量的变化进行分析无法系统地阐释浮皮发生的机理。未来的研究需要借助于高通量组学技术,如代谢组学技术[29]和以第2代测序技术[22]和第3代测序技术[30]为主的转录组技术和定量蛋白质组学技术[31-32],对不同柑橘品种,柑橘果实浮皮的动态过程中的果皮挥发性物质组分与含量、全基因组水平的基因转录和翻译特征系统解析,在组学水平理解柑橘浮皮的发生机制,这对于从根本上阐明柑橘果实浮皮的原因具有重要意义。
4 结 论
综合以上结果与分析,本研究运用GC-MS技术分析了果皮挥发性物质在椪柑果实浮皮时的变化,结果显示挥发性物质的组分在浮皮时没有改变,但其含量呈显著降低趋势。为了探讨其背后的生物学机制,本研究进一步运用转录组学技术RNA-Seq系统分析了萜烯类物质代谢途径中相关基因的表达情况,结果显示参与萜烯合成的基因在浮皮时表达量呈下降趋势。这表明,在浮皮发生时,果皮挥发性物质含量显著下降,与萜烯类合成途径相关基因表达量下调密切相关。本研究首次揭示了果皮挥发性物质在浮皮时的降解特征,并初步探讨了其背后的生物学的机制。这对于未来进一步研究柑橘浮皮的发生机制具有重要意义,为柑橘浮皮防控措施的开发提供理论依据。
参考文献:
[1]张世怡, 柯甫志, 赵迪, 等. 柑橘果实浮皮发生机理的研究进展[J].园艺学报, 2016, 43(9): 1719-1725. DOI:10.16420/j.issn.0513-353x.2016-0221.
[2]刘燕德, 吴明明, 孙旭东, 等. 柑橘浮皮果与可溶性固形物光谱同时在线检测[J]. 食品与机械, 2016, 32(11): 116-121. DOI:10.13652/j.issn.1003-5788.2016.11.026.
[3]陈秀伟, 张百超. 红桔果实浮皮的研究[J]. 园艺学报, 1988, 15(1):13-17.
[4]BURDON J, LALLU N, YEARSLEY C, et al. Postharvest conditioning of Satsuma mandarins for reduction of acidity and skin puffiness[J]. Postharvest Biology and Technology, 2007, 43(1): 102-114. DOI:10.1016/j.postharvbio.2006.07.014.
[5]石学根, 徐建国, 张林, 等. 温州蜜柑完熟果实的浮皮与贮藏性之间的关系[J]. 浙江农业学报, 2008, 20(4): 304-307. DOI:10.3969/j.issn.1004-1524.2008.04.019.
[6]MARTINELLI F, IBANEZ A M, REAGAN R L, et al. Stress responses in citrus peel: comparative analysis of host responses to Huanglongbing disease and puffing disorder[J]. Scientia Horticulturae,2015, 192: 409-420. DOI:10.1016/j.scienta.2015.06.037.
[7]GARCIALUIS A, AGUSTI M, ALMELA V, et al. Effect of gibberellicacid on ripening and peel puffing in Satsuma mandarins[J]. Scientia Horticulturae, 1985, 27(1/2): 75-86. DOI:10.1016/0304-4238(85)90057-3.
[8]张百超, 江义智, 陈远祥, 等. 红桔果实浮皮生理生化的研究[J].中国柑桔, 1983(4): 4-6.
[9]IBANEZ A M, MARTINELLI F, REAGAN R L, et al. Transcriptome and metabolome analysis of citrus fruit to elucidate puffing disorder[J].Plant Science, 2014, 217: 87-98. DOI:10.1016/j.plantsci.2013.12.003.
[10]张天志. 内源激素变化与宽皮柑橘浮皮关系的研究[D]. 杭州: 浙江农林大学, 2016.
[11]LIU C, CHENG Y, ZHANG H, et al. Volatile constituents of wild citrus Mangshanyegan (Citrus nobilis Lauriro) peel oil[J]. Journal of Agricultural and Food Chemistry, 2012, 60(10): 2617-2628.DOI:10.1021/jf2039197.
[12]SARROU E, CHATZOPOULOU P, DIMASSI-THERIOU K, et al.Volatile constituents and antioxidant activity of peel, flowers and leaf oils of Citrus aurantium L. growing in Greece[J]. Molecules, 2013,18(9): 10639-10647. DOI:10.3390/molecules180910639.
[13]CANNON R J, KAZIMIERSKI A, CURTO N L, et al. Identification,synthesis, and characterization of novel sulfur-containing volatile compounds from the in-depth analysis of Lisbon lemon peels (Citrus limon L. Burm. f. cv. Lisbon)[J]. Journal of Agricultural and Food Chemistry, 2015, 63(7): 1915-1931. DOI:10.1021/jf505177r.
[14]冯桂蓉, 谢姣, 邓丽莉, 等. 柑橘果实萜烯类挥发性物质研究进展[J]. 食品与机械, 2017, 33(10): 200-204. DOI:10.13652/j.issn.1003-5788.2017.10.001.
[15]HELLIWELL C A, SHELDON C C, OLIVE M R, et al. Cloning of the Arabidopsis ent-kaurene oxidase gene GA3[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998,95(15): 9019-9024.
[16]LEE M H, JEONG J H, SEO J W, et al. Enhanced triterpene and phytosterol biosynthesis in Panax ginseng overexpressing squalene synthase gene[J]. Plant Cell Physiology, 2004, 45(8): 976-984.DOI:10.1093/pcp/pch126.
[17]DING Y D, CHANG J, MA Q, et al. Network analysis of postharvest senescence process in citrus fruits revealed by transcriptomic and metabolomic profiling[J]. Plant Physiology, 2015, 168(1): 357-376.DOI:10.1104/pp.114.255711.
[18]SHARON-ASA L, SHALIT M, FRYDMAN A, et al. Citrus fruit flavor and aroma biosynthesis: isolation, functional characterization, and developmental regulation of Cstps1, a key gene in the production of the sesquiterpene aroma compound valencene[J]. Plant Journal, 2003,36(5): 664-674. DOI:10.1046/j.1365-313X.2003.01910.x.
[19]NAGEGOWDA D A. Plant volatile terpenoid metabolism: biosynthetic genes, transcriptional regulation and subcellular compartmentation[J].FEBS Letters, 2010, 584(14): 2965-2973. DOI:10.1016/j.febslet.2010.05.045.
[20]LIN Q, JIANG Q, LIN J, et al. Heat shock transcription factors expression during fruit development and under hot air stress in Ponkan(Citrus reticulata Blanco cv. Ponkan) fruit[J]. Gene, 2015, 559(2):129-136. DOI:10.1016/j.gene.2015.01.024.
[21]姚世响, 谢姣, 曾凯芳. 温州蜜柑和椪柑橘络主要矿质元素含量的比较分析[J]. 光谱学与光谱分析, 2017, 37(4): 1250-1253.DOI:10.3964/j.issn.1000-0593(2017)04-1250-04.
[22]GARBER M, GRABHERR M G, GUTTMAN M, et al. Computational methods for transcriptome annotation and quantification using RNA-seq[J]. Nature Methods, 2011, 8(6): 469-477. DOI:10.1038/nmeth.1613.
[23]CHUTIA M, BHUYAN P D, PATHAK M G, et al. Antifungal activity and chemical composition of Citrus reticulata Blanco essential oil against phytopathogens from North East India[J]. LWTFood Science and Technology, 2009, 42(3): 777-780. DOI:10.1016/j.lwt.2008.09.015.
[24]SAWAMURA M, TU N, ONISHI Y, et al. Characteristic odor components of Citrus reticulata Blanco (Ponkan) cold-pressed oil[J].Bioscience Biotechnology and Biochemistry, 2004, 68(8): 1690-1697.DOI:10.1271/bbb.68.1690.
[25]LOTA M L, SERRA D D, TOMI F, et al. Volatile components of peel and leaf oils of lemon and lime species[J]. Journal of Agricultural and Food Chemistry, 2002, 50(4): 796-805. DOI:10.1021/jf010924l.
[26]NJOROGE S M, KOAZE H, KARANJA P N, et al. Volatile constituents of redblush grapefruit (Citrus paradisi) and pummelo(Citrus grandis) peel essential oils from Kenya[J]. Journal of Agricultural and Food Chemistry, 2005, 53(25): 9790-9794.DOI:10.1021/jf051373s.
[27]AHARONI A, JONGSMA M A, BOUWMEESTER H J. Volatile science? Metabolic engineering of terpenoids in plants[J].Trends in Plant Science, 2005, 10(12): 594-602. DOI:10.1016/j.tplants.2005.10.005.
[28]DUDAREVA N, KLEMPIEN A, MUHLEMANN J K, et al.Biosynthesis, function and metabolic engineering of plant volatile organic compounds[J]. New Phytologist, 2013, 198(1): 16-32.DOI:10.1111/nph.12145.
[29]吴超. 高产油微藻基于基因组的初级代谢网络重构和代谢流分析[D]. 北京: 清华大学, 2015.
[30]VANBUREN R, BRYANT D, EDGER P P, et al. Single-molecule sequencing of the desiccation-tolerant grass Oropetium thomaeum[J].Nature, 2015, 527: 508-511. DOI:10.1038/nature15714.
[31]GOUW J W, KRIJGSVELD J, HECK A J. Quantitative proteomics by metabolic labeling of model organisms[J]. Molecular and Cellular Proteomics, 2010, 9(1): 11-24. DOI:10.1074/mcp.R900001-MCP200.
[32]姚世响. 稳定同位素标记水稻幼苗的定量蛋白质组学新方法的研究[D]. 北京: 清华大学, 2015.
