乳清分离蛋白-阿拉伯胶分子内复合物制备共轭亚油酸微球及其稳定性分析
2018-05-23姚晓琳姜发堂
姚晓琳,陈 玉,舒 蒙,张 琨,姜发堂
(1.华中科技大学同济医学院公共卫生学院,湖北 武汉 430030;2.湖北工业大学生物工程与食品学院,湖北 武汉 430068;3.福格森(武汉)生物科技股份有限公司,湖北 武汉 430056)
蛋白质和多糖是食品中最常用的乳化剂,是影响乳液物理化学稳定性的重要因素之一。在水包油型乳液中,蛋白质可在油滴表面吸附形成具有一定黏弹性的界面膜,防止由乳滴聚集或絮凝导致的乳液分层。多糖可增加连续相的黏度,通过阻碍乳滴的运动提高乳液稳定性[1-2]。多糖和蛋白质相互作用以赋形和提高稳定性,被广泛应用到食品科学与生物医学中,形成的非共价静电复合物具有重要的生物学意义,且易于在产品配方中使用,引起了学术界的广大关注[3]。利用明胶和果胶间的静电作用,制备与低热量淀粉颗粒类似尺寸和功能性的水凝胶颗粒[4]。在益生菌微囊包封技术中,利用多糖-蛋白复合物可改善在不同应力下的益生菌活性[5]。利用大豆分离蛋白-海藻酸钠共聚物制备番茄红素胶束,解决了番茄红素溶解性及稳定性差等问题[6]。多糖-蛋白复合物兼具蛋白质优越的乳化活性和多糖的空间稳定性,有效提高食品乳液的稳定性[7-8]。
静电力是蛋白质和多糖相互作用的最主要推动力。在pH值低于蛋白质等电点时,蛋白质带净正电荷,可与阴离子多糖形成复合物。研究表明,蛋白质与多糖在静电作用下结合,使蛋白质界面层得到保护;多糖的高分子质量和高亲水性,使乳滴之间存在空间斥力,防止乳滴的聚结[1]。蛋白质和多糖的相互作用受到许多因素的影响,如pH值、离子强度、混合比例等。随着蛋白与多糖混合比例的不同,可形成可溶性分子内复合物、可溶性分子间复合物、不溶性分子间复合物等[9-11]。前期研究表明,阿拉伯胶(gum arabic,GA)和乳清分离蛋白(whey protein isolation,WPI)以质量比2∶1混和,pH 4.4时可形成稳定的可溶性分子内复合物,具有非常优越的乳化活性和乳液稳定性[12]。但WPI-GA分子内复合物对pH值敏感,当乳液体系偏离pH 4.4时便会发生解离,从而引起乳液稳定性下降。
本实验中以WPI-GA分子内复合物为乳化剂,采用乳化-溶剂挥发法制备共轭亚油酸(conjugated linoleic acid,CLA)微球,通过评价CLA微球的稳定性及其胃肠消化释放特性,旨在提高WPI-GA分子内复合物的pH值稳定性,为扩大WPI-GA分子内复合物的应用提供理论支撑。
1 材料与方法
1.1 材料与试剂
GA 日本San-Ei Gen食品公司;WPI 美国戴维斯柯公司;CLA(纯度80%) 北京豪尔斯科技有限公司;胃蛋白酶、胰蛋白酶 美国Sigma公司;NaCl、CaCl2、胆盐3号 国药集团化学试剂有限公司。
1.2 仪器与设备
Mastersizer 2000激光粒度仪 英国马尔文仪器有限公司;PT-MR2100高速剪切预乳化机 瑞士Kinematica公司;ORION 4 STAR pH计 梅特勒-托利多仪器(上海)有限公司;真空冷冻干燥机 北京博医康实验仪器有限公司;旋转蒸发仪 艾卡仪器设备有限公司;双光束紫外分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 CLA微球的制备
GA和WPI按质量比2∶1,称取适量的WPI和GA溶于纯水之中,置于滚轴混合器上室温混合12 h,使其充分溶解混匀,用HCl溶液调节pH值为4.4,搅拌1 h,形成稳定的WPI-GA可溶性分子内复合物。取适量CLA于无水乙醇中,制备100 mg/mL的CLA-乙醇溶液,搅拌1 h。将CLA-乙醇溶液缓慢逐滴加入高速剪切搅拌(20 000 r/min)的WPI-GA溶液中。45 ℃旋转蒸发,快速除去乙醇,即得CLA微球分散液,CLA质量分数为2%,按照上述方法,制备质量分数分别为0.1%、0.5%、1%、2%和5%的WPI-GA分子内复合物。将新鲜制备的样品进行冷冻干燥,可得到粉末状CLA微球。
1.3.2 CLA微球粒径的测定
将乳液轻微振荡摇匀,逐滴加至超纯水分散剂中,通过Hydro 2000MU型湿法进样器进样。分散相和连续相的折光率分别为1.52和1.33,样品的吸收率为0.01,泵速为2 000 r/min。添加样品至激光指数略大于10%,即可开始测定。乳液的平均粒径用表面积加权平均值D[3,2]表示,按公式(1)计算:

式中:ni表示粒径大小为di的颗粒数目。
1.3.3 CLA微球物理稳定性的评价
将制备得到的新鲜CLA微球分散液置于40 ℃恒温培养箱中,放置0、3、5、7 d后进行乳液粒径测定。
1.3.4 CLA微球微观形貌的观察
取极少量CLA微球粉末于扫描电镜样品台上,喷金,置于扫描电镜下观察,拍照记录。
1.3.5 CLA微球包封率的测定
采用正己烷配制一定质量浓度CLA溶液,用紫外分光光度计进行波长扫描,测定CLA的最大吸收波长为234 nm。在最大吸收波长下,测定不同质量浓度CLA溶液(0~10 μg/mL)的吸光度,绘制吸光度与CLA质量浓度的标准曲线,得到相关性方程为y=0.097 5x-0.010 8,相关系数R2=0.996 2,线性关系良好。
取1 mL CLA微球分散液乳液,加入10 mL正己烷,充分振荡萃取,离心取正己烷相,在234 nm波长下测定CLA的吸光度。根据CLA在正己烷中的标准曲线方程,按公式(2)计算CLA包封率[13]:

1.3.6 CLA微球在模拟胃肠环境下释放率的测定
取1.0 mL CLA微球混悬液置于37 ℃预温的29.0 mL模拟胃液(2 mg/mL NaCl、3.2 mg/mL胃蛋白酶、HCl溶液调pH值至2.0)中,37 ℃恒温水浴,搅拌速率为100 r/min,消化3 h,期间每30 min调一次pH值使其稳定于2.0,分别于30、60、90、120、150、180 min取样品测定CLA的释放率。取1.0 mL用于测定粒径,1.0 mL加等量正己烷萃取,并定容至10.0 mL,测定234 nm波长处的吸光度,并计算含量。
胃消化阶段结束后,用1 mol/L NaOH溶液调pH值至7.0,转移至30 mL模拟肠液(8 mg/mL NaCl,40 mg/mL CaCl2,5 mg/mL胆盐,10 mg/mL胰蛋白酶)中,继续37 ℃恒温水浴,搅拌速率为100 r/min,消化3 h,期间每30 min调一次pH值使其稳定于7.0,分别于30、60、90、120、150、180 min取样品测定CLA的释放率。取1.0 mL用于测定粒径,1.0 mL加等量正己烷萃取,并定容至10.0 mL,测定234 nm波长处的吸光度,并计算含量[6,14]。按公式(3)计算CLA释放率:

2 结果与分析
2.1 WPI-GA分子内复合物质量分数对CLA微球粒径的影响

图1 不同质量分数WPI-GA分子内复合物制备的CLA微球平均粒径(A)和分布(B)Fig. 1 Mean particle size of D[3,2] (A) and distribution (B) of CLA microspheres stabilized with different concentrations of WPI-GA intramolecular complex
以WPI-GA分子内复合物为乳化剂,采用乳化-溶剂挥发法制备CLA微球,由图1可知,随着WPI-GA分子内复合物质量分数的提高,新鲜CLA微球平均粒径呈现先减小后增大趋势。质量分数0.1% WPI-GA分子内复合物的粒径较大,质量分数0.5%~2%制备的CLA微球粒径分布接近,平均粒径趋于恒定,意味着WPI-GA分子内复合物在CLA微球界面吸附已达到饱和[15]。当质量分数增大到5%时,平均粒径呈现增大趋势,CLA微球发生轻微絮凝。这是由于水相中游离的过量乳化剂会导致由排空效应造成的微球絮凝[16-18]。由图1B可知,不同质量分数WPI-GA分子内复合物的CLA微球粒径均呈现单峰分布,且质量分数为1%~2%的CLA微球粒径较小。表明该质量分数的由乳化-溶剂挥发法制备CLA微球分布均一、稳定性较好。
2.2 CLA微球的物理稳定性
由不同质量分数WPI-GA分子内复合物制备的GLA微球40 ℃贮存条件下的粒径变化见图2,各质量分数下的CLA微球在7 d贮存期内粒径分布无明显变化,5% WPI-GA分子内复合物制备的CLA微球随着贮存时间的延长出现少量的颗粒絮凝,表明CLA微球具有较好的物理稳定性。

图2 不同质量分数WPI-GA分子内复合物制备的CLA微球的贮存稳定性Fig. 2 Mean particle size distribution of CLA microspheres stabilized with different concentrations of WPI-GA intramolecular complex during 7 d storage
2.3 CLA微球的微观形貌和复溶特性

图3 2%WPI-GA分子内复合物制备的CLA微球的微观形貌Fig. 3 Micrograph of CLA microspheres stabilized with 2% WPI-GA intramolecular complex
由图3可知,乳化-溶剂挥发法制备的CLA微球,分布较均匀,颗粒表面皱褶塌陷,具有较厚的界面层。这是由于乳化后进行的溶剂挥发,导致包裹在CLA微球内部的乙醇逸去,使乳化形成的圆形颗粒发生塌陷和界面皱缩[19]。由于WPI-GA分子内复合物在pH值4.4时形成,当pH值偏离4.4时WPI-GA分子内复合物会发生解离、或由凝聚导致生成沉淀。本实验选用乳化-溶剂挥发法制备CLA微球,利用溶剂的挥发从而使CLA乳滴界面发生皱缩和聚集,以提高乳滴界面吸附的WPI-GA分子内复合物的稳定性。

图4 WPI-GA分子内复合物制备的CLA微球冻干性状(A)及复溶特性(B)Fig. 4 Freeze drying (A) and re-dissolution (B) properties of CLA microspheres stabilized with WPI-GA intramolecular complex
由图4A可知,当WPI-GA分子内复合物质量分数为0.1%时,制备的CLA微球基本无法冻干,出油严重,WPI-GA在界面无法完全包覆CLA液滴,导致冻干过程中CLA大量溢出。当WPI-GA分子内复合物质量分数为0.5%时,CLA微球冻干后出现明显聚结而形成块状;当WPI-GA分子内复合物质量分数升高至1%以上,CLA微球冻干后呈现粉末状,以5% WPI-GA分子内复合物制备的CLA微球粉末状最为细腻,贮存分散性最好。将冻干后的CLA微球粉末溶解还原至新鲜制备的分散液浓度,进行粒径分析,由图4B可知,1% WPI-GA分子内复合物制备的CLA微球粉末复溶后出现部分颗粒聚集,粒径变大,质量分数2%和5%的WPI-GA分子内复合物制备的CLA微球粉末复溶后的粒径分布与新鲜制备的相接近,CLA微球粉末复溶效果较好。
2.4 CLA微球的包封率

表1 WPI-GA分子内复合物制备的CLA微球的包封率Table 1 Encapsulation efficiency of CLA microspheres stabilized with different concentrations of WPI-GA intramolecular complex
从表1可以看出,当CLA质量分数一定时,随着WPI-GA分子内复合物质量分数的增加,对CLA微球的包封率逐渐升高。当WPI-GA分子内复合物质量分数增加到2%时,包封率达到97%以上,包封效果良好。本实验选用乳化-溶剂挥发法制备CLA微球,利用溶剂的挥发使CLA乳滴界面发生皱缩和聚集,提高了乳滴界面吸附的WPI-GA分子内复合物的稳定性,使CLA微球界面厚度增加,可有效防止CLA的溢出与氧化。
2.5 CLA微球在模拟胃肠环境中的稳定性和释放率
由图5可知,乳化-溶剂挥发法制备的CLA微球,由于WPI-GA分子内复合物在界面的聚集,提高了复合物的pH值稳定性。CLA微球在模拟胃液中较为稳定,基本保持单峰分布,随着在模拟胃液中时间的延长,出现大颗粒聚集峰,CLA的释放率缓慢增加。推测是由于CLA微球界面上的WPI-GA分子内复合物在胃蛋白酶的作用下开始逐渐被酶解,导致CLA微球的界面保护屏障降低[20-21]。因此CLA向体系扩散的速率逐渐增大,在胃液180 min时释放率达到36.0%。在模拟肠液中,随着时间延长,CLA微球的大颗粒聚集峰增加明显,CLA释放率也呈现迅速增大的趋势,在180 min时CLA释放率达到约62.2%。与模拟胃液相比,CLA在模拟肠液中的释放速率较快。这是由于CLA微球在模拟肠液中出现明显的大颗粒聚集,推测是小肠内的胆盐取代了微球界面的WPI-GA分子内复合物[22-28],加速了胰蛋白酶在界面的吸附和微球界面保护屏障的破坏,相对更易出现微球间的聚集[29-30],导致CLA释放率显著增大。
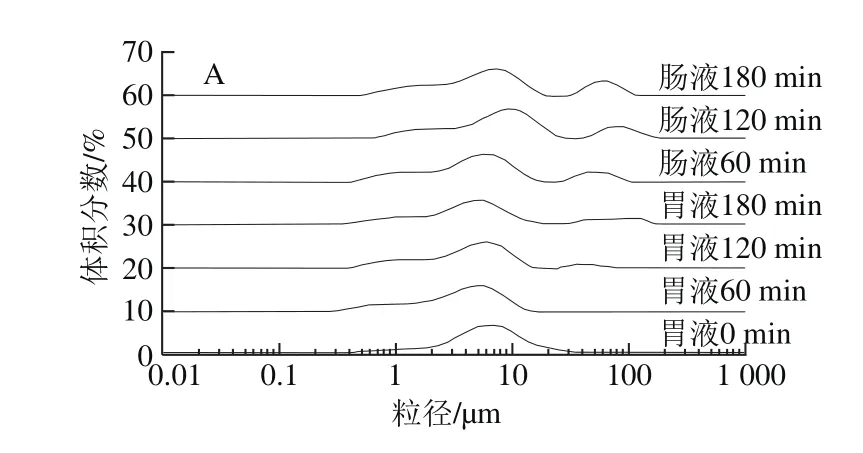

图5 2%WPI-GA分子内复合物制备的CLA微球在模拟胃肠环境中的粒径变化(A)和CLA释放率(B)Fig. 5 Particle size distribution (A) and release kinetics (B) of CLA microspheres stabilized with 2% WPI-GA intramolecular complex in simulated gastrointestinal juice
3 结 论
本实验以WPI-GA分子内复合物为乳化剂,采用乳化-溶剂挥发法制备CLA颗粒,利用溶剂挥发使CLA微球界面上的WPI-GA分子内复合物发生界面聚集,CLA微球界面出现塌陷皱缩,提高了WPI-GA分子内复合物的pH
值稳定性,使其具备良好的CLA胃肠输送特性,提高了多糖-蛋白质静电复合物的应用价值。
参考文献:
[1]BENICHOU A, ASERIN A, GARTI N. Protein-polysaccharide interactions for stabilization of food emulsions[J]. Journal of Dispersion Science and Technology, 2002, 23(1/2/3): 93-123.DOI:10.1080/01932690208984192.
[2]DICKINSON E. Stability and rheological implications of electrostatic milk protein-polysaccharide interactions[J]. Trends in Food Science & Technology,1998, 9(10): 347-354. DOI:10.1016/S0924-2244(98)00057-0.
[3]SCHMITT C, ABERKANE L, SANCHEZ C, et al. Proteinpolysaccharide complexes and coacervates[J]. Advances in Colloid &Interface Science, 2011, 167(1/2): 63-70. DOI:10.1016/j.cis.2010.10.001.
[4]WU B C, DEGNER B, MCCLEMENTS D J. Soft matter strategies for controlling food texture: formation of hydrogel particles by biopolymer complex coacervation[J]. Journal of Physics Condensed Matter, 2014,26(46): 464104-464114. DOI:10.1088/0953-8984/26/46/464104.
[5]BOSNEA L A, MOSCHAKIS T, BILIADERIS C G. Complex coacervation as a novel microencapsulation technique to improve viability of probiotics under different stresses[J]. Food and Bioprocess Technology,2014, 7(10): 2767-2781. DOI:10.1007/s11947-014-1317-7.
[6]赵磊, 张晓蕾, 胡济美, 等. 大豆分离蛋白联合海藻酸钠制备番茄红素胶束[J]. 食品科学, 2016, 37(21): 1-6. DOI:10.7506/spkx1002-6630-201621001.
[7]LI X, FANG Y, AL-ASSAF S, et al. Complexation of bovine serum albumin and sugar beet pectin: stabilising oil-in-water emulsions[J].Journal of Colloid & Interface Science, 2012, 388(1): 103-111.DOI:10.1016/j.jcis.2012.08.018.
[8]LI X, FANG Y, PHILLIPS G O, et al. Improved sugar beet pectinstabilized emulsions through complexation with sodium caseinate[J].Journal of Agricultural & Food Chemistry, 2013, 61(6): 1388-1396.DOI:10.1021/jf304658q.
[9]WEINBRECK F, VRIES R D, SCHROOYEN P, et al. Complex coacervation of whey proteins and gum arabic[J]. Biomacromolecules,2003, 4(2): 293-303. DOI:10.1021/bm025667n.
[10]WEINBRECK F, ROLLEMA H S, TROMP R H, et al. Diffusivity of whey protein and gum arabic in their coacervates[J]. Langmuir, 2004,20(15): 6389-6395. DOI:10.1021/la049908j.
[11]LI X, FANG Y, AL-ASSAF S, et al. Complexation of bovine serum albumin and sugar beet pectin: structural transitions and phase diagram[J]. Langmuir, 2012, 28(27): 10164-10176. DOI:10.1021/la302063u.
[12]YAO X, XIANG S, NIE K, et al. Whey protein isolate/gum arabic intramolecular soluble complexes improving the physical and oxidative stabilities of conjugated linoleic acid emulsions[J]. RSC Advances, 2016, 6(18): 14635-14642. DOI:10.1039/C5RA26040J.
[13]薛芳芳. 用于共轭亚油酸运送的海藻酸-壳聚糖微纳米复合粒子的研究[D]. 青岛: 中国海洋大学, 2012.
[14]姚晓琳, 向圣萍, 聂珂, 等. 阿拉伯胶乳液对共轭亚油酸的氧化保护和在模拟胃肠液中的释放研究[J]. 现代食品科技, 2016(3): 24-29.
[15]XIANG S, YAO X, ZHANG W, et al. Gum Arabic-stabilized conjugated linoleic acid emulsions: emulsion properties in relation to interfacial adsorption behaviors[J]. Food Hydrocolloids, 2015, 48:110-116. DOI:10.1016/j.foodhyd.2015.01.033.
[16]YAO X, XU Q, TIAN D, et al. Physical and chemical stability of gum arabic-stabilized conjugated linoleic acid oil-in-water emulsions[J].Journal of Agricultural & Food Chemistry, 2013, 61(19): 4639-4645.DOI:10.1021/jf400439d.
[17]DICKINSON E. Hydrocolloids as emulsifiers and emulsion stabilizers[J]. Food Hydrocolloids, 2009, 23(6): 1473-1482.DOI:10.1016/j.foodhyd.2008.08.005.
[18]MOSCHAKIS T, MURRAY B S, DICKINSON E. Particle tracking using confocal microscopy to probe the microrheology in a phaseseparating emulsion containing nonadsorbing polysaccharide[J].Langmuir, 2006, 22(10): 4710-4719. DOI:10.1021/la0533258.
[19]MCCLEMENTS D J, LI Y. Structured emulsion-based delivery systems: controlling the digestion and release of lipophilic food components[J]. Advances in Colloid & Interface Science, 2010,159(2): 213-228. DOI:10.1016/j.cis.2010.06.010.
[20]FAVE G, COSTE T C, ARMAND M. Physicochemical properties of lipids: new strategies to manage fatty acid bioavailability[J]. Cellular and Molecular Biology, 2004, 50(7): 815-831. DOI:10.1170/T575.
[21]BAUER E, JAKOB S, MOSENTHIN R. Principles of physiology of lipid digestion[J]. Asian-Australasian Journal of Animal Sciences,2005, 18(2): 282-295. DOI:10.5713/ajas.2005.282.
[22]YAO X, WANG N, FANG Y, et al. Impact of surfactants on the lipase digestibility of gum arabic-stabilized O/W emulsions[J].Food Hydrocolloids, 2013, 33: 393-401. DOI:10.1016/j.foodhyd.2013.04.013.
[23]YAO X, ZHANG W, NIE K, et al. Effect of gum arabic, gum ghatti and sugar beet pectin as interfacial layer on lipid digestibility in oil-in-water emulsions[J]. Food Biophysics, 2016, 11(3): 292-301.DOI:10.1007/s11483-016-9441-8.
[24]SARKAR A, YE A, SINGH H. On the role of bile salts in the digestion of emulsified lipids[J]. Food Hydrocolloids, 2016, 60: 77-84.DOI:10.1016/j.foodhyd.2016.03.018.
[25]MALDONADO-VALDERRAMA J, WOODWARD N C, GUNNING A P, et al. Interfacial characterization of beta-lactoglobulin networks:displacement by bile salts[J]. Langmuir, 2008, 24(13): 6759-6767.DOI:10.1021/la800551u.
[26]WICKHAM M, GARROOD M, LENEY J, et al. Modification of a phospholipid stabilized emulsion interface by bile salt: effect on pancreatic lipase activity[J]. Journal of Lipid Research, 1998, 39(3):623-632.
[27]TORCELLO-GÓMEZ A, JÓDAR-REYES A B, MALDONADOVALDERRAMA J, et al. Effect of emulsifier type against the action of bile salts at oil-water interfaces[J]. Food Research International, 2012,48(1): 140-147. DOI:10.1016/j.foodres.2012.03.007.
[28]TZOUMAKI M V, MOSCHAKIS T, SCHOLTEN E, et al. In vitro lipid digestion of chitin nanocrystal stabilized O/W emulsions[J]. Food &Function, 2013, 4(1): 121-129. DOI:10.1039/c2fo30129f.
[29]MCCLEMENTS D J, DECKER E A, PARK Y. Controlling lipid bioavailability through physicochemical and structural approaches[J].Critical Reviews in Food Science and Nutrition, 2009, 49(1): 48-67.DOI:10.1080/10408390701764245.
[30]SINGH H, YE A Q, HORNE D. Structuring food emulsions in the gastrointestinal tract to modify lipid digestion[J]. Progress in Lipid Research, 2009, 48(2): 92-100. DOI:10.1016/j.plipres.2008.12.001.
