不同加工处理方式对牛肉中Neu5Gc解离的影响
2018-05-23梁美莲朱秋劲刘春丽
梁美莲,朱秋劲*,刘春丽,王 坤
(贵州大学酿酒与食品工程学院,贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025)
红肉及其加工肉制品的安全性问题一度引发世界性热议,长期以来的流行病学资料显示,红肉及其加工肉制品的摄入与癌症、动脉粥样硬化、2型糖尿病等致命性疾病密切关联[1-3],除了人们熟知的亚硝酸盐、杂环胺、多环芳烃、助氧化剂亚铁血红素等不安全因素之外[4],越来越多的研究证明红肉中存在的一种酸性氨基糖——N-羟乙酰神经氨酸(N-glycolylneuraminic acid,Neu5Gc)与上述疾病息息相关[5-10]。
大约在2~3百万年前,人类编码单磷酸胞苷-神经氨酸羟化酶(cytidine monophos-phate-N-acetylneuraminic acid hydroxylase,CMAH)的基因外显子发生缺失突变,CMAH是将体内N-乙酰神经氨酸合成Neu5Gc的关键酶,因此,正常人体内不能合成Neu5Gc,但大多数哺乳动物、以及和人类相近的类人猿都能合成Neu5Gc[11-12]。然而,在人体的上皮及内皮细胞以及癌症组织中却可以检测到Neu5Gc,这是因为Neu5Gc可以随着红肉及其加工肉制品的摄入而被人体吸收和积累[13]。Neu5Gc被机体视为外来抗原,人体内会产生相应的Neu5Gc抗体,在Neu5Gc与Neu5Gc抗体发生反应的过程中能够刺激炎症的发生,而炎症恰恰可以促进和加剧癌症、动脉粥样硬化、2型糖尿病等重大疾病[14-15]。此外,红肉易被产志贺毒素型大肠杆菌污染,其产生的志贺毒素若与人体肠上皮细胞中的Neu5Gc结合将导致胃肠道不适,引起腹泻等症状,志贺毒素若与肾内皮细胞中聚集的Neu5Gc结合破坏内皮细胞从而导致溶血性尿毒症综合征,发生出血性腹泻并伴随肾衰竭等症状[16-18]。因此,红肉及其加工肉制品中存在的Neu5Gc严重威胁着消费者的身体健康。
近年来随着经济的发展,红肉的消费也逐渐增长,加工肉制品的种类也日渐丰富,包括传统的腊肠、宣威火腿、西式火腿以及培根等,这些产品不仅能够满足人们营养的需求,也能满足人们对肉制品口感的追求,然而Neu5Gc在不同加工肉制品中的含量尚不清楚,因此测定不同红肉及其加工肉制品中Neu5Gc的含量,对人们在饮食中对于不同种类的红肉以及肉制品的选择有着重要的指导意义。此外,目前国内外鲜有关于Neu5Gc解离方法的研究,若是能为减少Neu5Gc摸索一套行之有效的方法,这对解除红肉的安全忧患意义重大。本实验采用高效液相色谱-荧光检测器(high performance liquid chromatography-fluorescence detector,HPLC-FLD)法检测了不同红肉及加工肉制品中Neu5Gc的含量,探究油炸温度、蒸煮时间、酶制剂对牛肉中Neu5Gc含量的影响,以及对Neu5Gc的解离效果。
1 材料与方法
1.1 材料与试剂
冷鲜猪里脊、冷鲜牛里脊、猪火腿肠、猪培根、宣威火腿、广式香肠、贵州香肠 贵阳市花溪区星力超市。
Neu5Gc标准品、1,2-二氨基-4,5-亚甲基二氧苯盐酸盐(1,2-diamino-4,5-methylenedioxybenzene dihydrochloride,DMB)、β-巯基乙醇(色谱纯)、谷胱甘肽过氧化物酶(100 U/0.63 mg) 美国Sigma公司;乙腈、甲醇(均为色谱纯) 德国Applichem公司;溶菌酶(20 000 U/mg)、葡萄糖氧化酶(10 kU/30.5 mg)、α-半乳糖甘酶(9 U/mg)、β-半乳糖甘酶(1 kU/6.67 mg) 北京Solarbio科技有限公司;菊粉酶(500 000 U/g) 上海宝曼生物科技有限公司;α-乙酰乳酸脱羧酶(食品级) 湖北远成赛创科技有限公司;葡萄糖异构酶(食品级) 河南万邦实业有限公司。
1.2 仪器与设备
1260型HPLC(配有FLD和自动进样器) 美国安捷伦科技有限公司;LiChrosorb RP-18柱 德国默克集团;真空冷冻干燥机、电动玻璃匀浆机、超声清洗器 宁波新芝有限公司;电子分析天平 奥豪斯仪器有限公司;离心机 上海卢湘仪仪器有限公司;数显恒温油浴锅 上海和恒仪器设备有限公司;便携式色差仪深圳市三恩时科技有限公司。
1.3 方法
1.3.1 HPLC条件
色谱柱为LiChrosorb RP-18柱(250 mm×4.0 mm,5 μm),柱温30 ℃,FLD激发波长373 nm、发射波长448 nm,流动相为乙腈-甲醇-超纯水(8∶7∶85,V/V),流速为0.9 mL/min,进样体积10 μL。
1.3.2 衍生液的配制及衍生条件
DMB衍生液的配制:8 mmol/L DMB、1.5 mol/L冰醋酸、0.25 mol/L硫代硫酸钠、0.25 mol/L亚硫酸钠、0.8 mmol/L 2-巯基乙醇。
衍生条件:900 μL标准品中加入100 μL DMB衍生液,50 ℃避光衍生150 min,冷却至室温后分析。
1.3.3 不同红肉及加工肉制品中Neu5Gc含量的测定
分别准确称取1 g冷鲜猪里脊、冷鲜牛里脊、猪火腿肠、猪培根、宣威火腿、广式香肠以及贵州香肠(均取瘦肉部分)于匀浆瓶中,加入10 mL 30%的饱和硫酸铵溶液研磨成均匀的肉浆,室温下放置1 h后13 000 r/min离心15 min,将沉淀的蛋白质和上清液分开,沉淀和上清液分别进行冷冻干燥。冷冻干燥后的蛋白质沉淀和上清液粉末分别加入5 mL 2 mol/L醋酸溶解并合并,于80 ℃水浴3 h使Neu5Gc游离出来,水解后再进行冷冻干燥除去醋酸。冻干粉溶于0.8 mL水中,加入0.2 mL 0.1 mol/L NaOH溶液,37 ℃水浴30 min进行脱乙酰处理。精确吸取处理后的样液900 µL,加入100 µL衍生液,用0.22 µm膜过滤后衍生,待测。
1.3.4 解离Neu5Gc酶制剂的筛选
1.3.4.1 溶菌酶对Neu5Gc的解离效果
准确吸取400 µL 1 mmol/L的Neu5Gc标准液,加入500 µL超纯水,按质量分数添加3%的溶菌酶,37 ℃水浴30 min后加入100 µL衍生剂,0.22 µm膜过滤后,衍生,检测,并以未添加溶菌酶为空白对照。
1.3.4.2 葡萄糖异构酶对Neu5Gc的解离效果
准确吸取200 µL 1 mmol/L的Neu5Gc标准液,加入700 µL的超纯水,按质量分数添加3%的葡萄糖异构酶,于60 ℃水浴2 h后加入100 µL衍生剂,0.22 µm膜过滤后,衍生,检测,并以未添加葡萄糖异构酶为空白对照。
1.3.4.3 葡萄糖氧化酶对Neu5Gc的解离效果
准确称取0.01 g葡萄糖氧化酶溶于1 mL超纯水中,取250 µL加入200 µL 1 mmol/L的Neu5Gc标准液中,加入450 µL超纯水,37 ℃水浴30 min后加入100 µL衍生剂,0.22 µm膜过滤后,待测,并以未添加葡萄糖氧化酶为空白对照。
1.3.4.4 α-半乳糖甘酶对Neu5Gc的解离效果
准确称取0.01g α-半乳糖苷酶溶于1 mL超纯水中,取250 µL酶液加入200 µL 1 mmol/L的Neu5Gc标准液中,加入450 µL超纯水,37 ℃水浴30 min后,再加入100 µL衍生剂,0.22 µm过滤后,待测,并以未添加α-半乳糖甘酶为空白对照。
1.3.4.5 α-乙酰乳酸脱羧酶对Neu5Gc的解离效果
准确吸取α-乙酰乳酸脱羧酶50 µL于200 µL 1 mmol/L的Neu5Gc标准液中,加入650 µL超纯水,35 ℃水浴2 h后加入100 µL衍生剂,0.22 µm膜过滤后,衍生,检测,并以未添加α-乙酰乳酸脱羧酶为空白对照。
1.3.4.6 β-半乳糖甘酶对Neu5Gc的解离效果
将1 kU β-半乳糖甘酶溶于1 mL超纯水中,取300 µL酶液加入300 µL 1 mmol/L的Neu5Gc标准液中,加入300 µL超纯水,40 ℃水浴2 h后,加入100 µL衍生剂,0.22 µm膜过滤后,衍生,待测,并以未添加β-半乳糖甘酶为空白对照。
1.3.4.7 菊粉酶对Neu5Gc的解离效果
准确吸取200 µL 1 mmol/L的Neu5Gc标准液,加入700 µL超纯水,按质量分数添加0.6%菊粉酶,50 ℃水浴30 min后,加入100 µL衍生剂,0.22 µm膜过滤后,衍生,待测,并以未添加菊粉酶为空白对照。
1.3.4.8 谷胱甘肽过氧化物酶对Neu5Gc的解离效果
将0.63 mg谷胱甘肽过氧化物酶溶于1 mL水中,准确吸取500 µL于300 µL 1 mmol/L的Neu5Gc标准液中,加入100 µL超纯水,37 ℃水浴3 h后,加入100 µL衍生剂,0.22 µm膜过滤后,衍生,待测,并以未添加谷胱甘肽过氧化物酶为空白对照。
1.3.5 菊粉酶解离Neu5Gc条件的优化
1.3.5.1 水浴时间对菊粉酶解离Neu5Gc的影响
准确吸取200 µL 1 mmol/L的Neu5Gc标准液,加入700 µL超纯水,菊粉酶添加量为质量分数0.6%,于50 ℃分别水浴10、30、60、90、120、150 min后加入100 µL衍生剂,0.22 µm膜过滤后,衍生,待测。
1.3.5.2 水浴温度对菊粉酶解离Neu5Gc的影响
准确吸取200 µL 1 mmol/L的Neu5Gc标准液,加入700 µL超纯水,菊粉酶添加量为质量分数0.6%,分别于30、35、40、45、50、55 ℃水浴30 min后加入100 µL衍生剂,0.22 µm膜过滤后,衍生,待测。
1.3.5.3 菊粉酶添加量对菊粉酶解离Neu5Gc的影响
准确吸取200 µL 1 mmol/L的Neu5Gc标准液,加入700µL超纯水,菊粉酶添加量分别为质量分数0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%,50 ℃水浴30 min后加入100 µL衍生剂,0.22 µm膜过滤后,衍生,待测。
1.3.5.4 菊粉酶解离Neu5Gc条件的正交试验
在各单因素最适条件的基础上,采用正交试验优化菊粉酶解离Neu5Gc的最优作用条件。正交试验因素与水平见表1。

表1 正交试验设计因素与水平Table 1 Factors and their coded and actual levels used in orthogonal array design
1.3.6 不同处理方式对Neu5Gc解离效果的影响
1.3.6.1 油炸温度对牛肉中Neu5Gc含量的影响
将牛里脊切成3 mm厚度均匀的切片,分别于100、125、150、175、200 ℃油温中恒温油炸1 min,油炸后分别准确取1 g,按照1.3.3节方法对不同温度油炸后的牛肉进行处理,待测。为计算不同温度油炸后牛肉中水分的损失率,每片牛肉切片油炸前后都需称质量。
1.3.6.2 蒸煮时间对牛肉汤中Neu5Gc含量的影响
取5 g牛里脊放入25 mL小烧杯中,加入10 mL水,盖上保鲜膜,待水沸后放入锅中分别蒸煮10、30、60、120、180 min。冷却后取出肉,将肉汤进行冷冻干燥,干燥后加入10 mL的2 mol/L醋酸溶液,80 ℃水浴3 h,冷却后13 000 r/min离心15 min,取上清液,再次进行冷冻干燥,冻干后加入0.8 mL超纯水复溶,再加入0.2 mL 0.1 mol/L的NaOH溶液,37 ℃水浴30 min去乙酰化,吸取900 µL加入100 µL衍生剂,0.22 µm膜过滤后,衍生,待测。
1.3.7 标准曲线与工作曲线的绘制
1.3.7.1 标准曲线的绘制
精确称取0.032 5 g Neu5Gc标准品,溶解于100 mL超纯水中,配成1 mmol/L Neu5Gc标准品溶液。分别取浓度为1 mmol/L的标准溶液50、100、200、300、400 μL按照表2配成待衍生的混合液,衍生后采用HPLC检测,不同浓度标准品分别进样3 次,以3 次峰面积的平均值为横坐标,标准品浓度为纵坐标绘制标准曲线,得到标准曲线方程。

表2 不同浓度Neu5Gc标准溶液配制Table 2 Preparation of Neu5Gc standard solutions of different concentrations
1.3.7.2 工作曲线的绘制
分别取浓度为1 mmol/L的标准溶液10、50、100、200、400 μL加入10 mL 30%的饱和硫酸铵溶液后进行冷冻干燥。冷冻干燥后分别加入10 mL 2 mol/L醋酸溶液于80 ℃水浴3 h,再进行冷冻干燥除去醋酸。冷冻干燥完毕后溶于0.8 mL水中,加入0.2 mL 0.1 mol/L NaOH溶液于37 ℃水浴30 min。精确吸取处理后的样液900 µL,加入100 µL衍生液,用0.22 µm膜过滤后,衍生,待测。
1.3.8 解离率的计算
经不同方式处理后的样品中Neu5Gc的解离率按下式进行计算:

式中:C0为空白对照中Neu5Gc含量或者峰面积;C1为不同方式处理后样品中Neu5Gc的含量或者峰面积。
1.4 数据处理
绘图以及统计分析均采用Origin 9.6软件进行处理分析。
2 结果与分析
2.1 标准曲线与工作曲线方程
在已有的对肉样Neu5Gc含量的检测研究中,直接将肉用酸水解[19],肉中的蛋白质遇酸发生凝胶变性,对HPLC检测前的过滤工作带来极大的困难,样品损失严重造成结果偏小甚至过滤不出造成实验失败。本实验对肉样的预处理进行了优化,先使用30%饱和硫酸铵溶液沉淀蛋白质后再进行酸水解,解决了肉样遇酸凝胶变性的问题,避免了样品的损失,更好地保证所得数据的准确性。实验中所涉及到对标准品的处理方式不同以及对肉样处理方式不同,肉样的前处理又较繁琐和复杂,因此分别绘制了标准曲线和工作曲线,能更准确地反映出不同方式处理后的标准液以及肉样中的Neu5Gc含量。所得标准曲线方程为y=2.691 21x-14.386 27,R2=0.999 12,标准品在50~400 µmol/L浓度范围内,峰面积与浓度呈现良好的线性关系;工作曲线方程为y=4.155 38x-30.060 11,R2=0.999 23,标准品在10~400 µmol/L浓度范围内,峰面积与浓度呈现良好的线性关系。
2.2 不同红肉及加工肉制品中Neu5Gc的含量
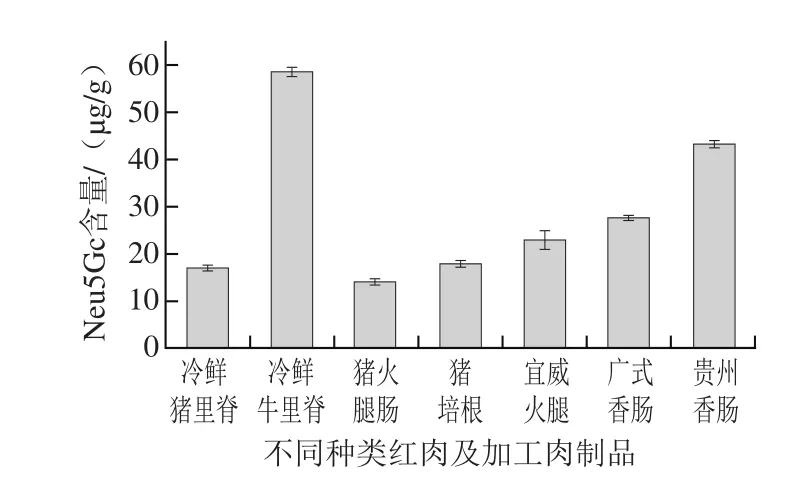
图1 不同种类红肉及加工肉制品中Neu5Gc的含量Fig. 1 Neu5Gc contents in different types of red meat and meat products
如图1所示,冷鲜牛里脊、冷鲜猪里脊、猪火腿肠、猪培根、宣威火腿、广式香肠、贵州香肠中Neu5Gc含量分别为(58.45±0.98)、(17.31±0.44)、(14.31±0.55)、(18.12±0.68)、(23.07±2.1)、(27.88±0.36)、(43.19±0.63)µg/g。其中牛里脊肉中Neu5Gc含量最高,猪里脊、猪火腿肠以及猪培根中Neu5Gc含量较低。
2.3 油炸温度对牛肉中Neu5Gc含量的影响
如图2所示,随着油炸温度的升高,牛里脊肉中Neu5Gc的含量出现先增高后减小的趋势,但相较于未经油炸的牛肉空白组,经油炸后Neu5Gc含量都有所增加,这是因为油炸过后,牛里脊肉中的水分被蒸发带走,油炸过后牛肉中的干物质含量增加,Neu5Gc在红肉组织中主要以结合态的形式存在于糖蛋白和糖脂的糖基化末端[20-21],因此,油炸过后牛肉中Neu5Gc含量有所增加。但是,由图3可知,当油炸温度达到150 ℃以后,随着牛肉中水分损失率的增加,牛肉中Neu5Gc含量的增加率反而减小,水分损失率与Neu5Gc之间的差值表现出增大的趋势,这可能是因为一方面随着油炸温度的升高,蛋白质等收缩变性加剧,由Neu5Gc与脂质结合的部分糖脂被油锅中的油溶出,从而导致含量减少;另一方面,Neu5Gc与组织中的蛋白质、脂质以糖苷键的形式结合[22-23],当油温升高到150 ℃以上,油的酸价升高,pH值降低,使得结合态的Neu5Gc游离出来,与此同时油脂的氧化速率增加,在氧化过程中油脂分解产生的自由基或产物对游离出的Neu5Gc分子产生破坏作用,从而导致Neu5Gc含量减少。有资料指出当油炸温度大于150 ℃时,油脂开始发生氧化产生有害产物[24]。如图4所示,随着油炸温度的升高,油炸后牛肉切片的L*、a*、b*值均呈现明显的下降趋势,当油炸温度达到175 ℃时,L*值下降至22.16±0.29,a*值下降至6.03±0.08,b*值下降至1.76±0.02,色泽差,水分含量低,感官品质不佳。因此,综上所述,从油炸红肉的安全和品质角度出发,建议对牛肉进行油炸时,加工温度控制在150 ℃左右。

图2 油炸温度对牛肉中Neu5Gc含量的影响Fig. 2 Effects of frying temperature on the content of Neu5Gc in beef
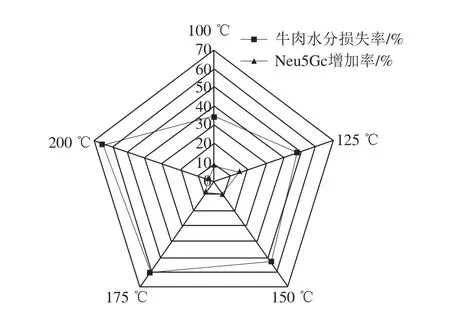
图3 油炸温度对牛肉中水分损失率及Neu5Gc增加率的影响Fig. 3 Effects of frying temperatures on water loss rate and Neu5Gc increase in beef

图4 油炸温度对牛肉色度的影响Fig. 4 Effects of frying temperature on the color of beef
2.4 蒸煮时间对牛肉汤中Neu5Gc含量的影响
如图5所示,随着蒸煮时间的延长,肉汤(牛里脊肉)中的Neu5Gc含量呈现递增的趋势,当蒸煮时间达10 min后,肉汤中Neu5Gc含量增加迅速,蒸煮时间达到60 min后增加速度有所减缓,到180 min时,牛肉汤中Neu5Gc含量达(32.7±0.77)µg/10 mL。另有研究证据表明当肉的蒸煮时间超过10 min后,肉汤中的嘌呤含量迅速增加[25],大量摄入高嘌呤的物质会导致痛风[26-28]。因此,长时间蒸煮的肉汤中不仅含有较多的嘌呤,还含有较高含量的Neu5Gc,不建议食用长时间蒸煮后的肉汤,然而经过高温蒸煮后的肉,肉中的嘌呤含量减少[25],部分Neu5Gc解离出来游离到肉汤中,肉中的Neu5Gc含量亦减少,建议食用蒸煮后的肉。
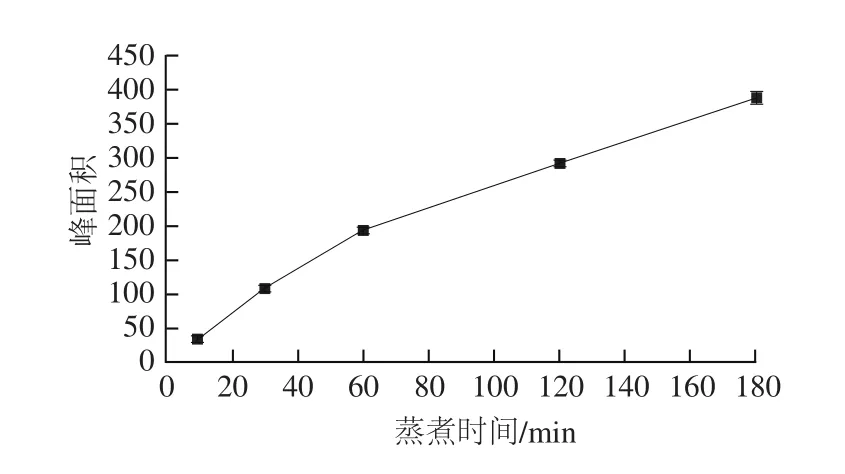
图5 蒸煮时间对牛肉汤中Neu5Gc含量的影响Fig. 5 Effects of cooking time on the content of Neu5Gc in beef soup
2.5 酶制剂对Neu5Gc的解离效果的影响

图6 酶制剂对Neu5Gc的解离效果Fig. 6 Dissociation effects of different enzymes on Neu5Gc
根据Neu5Gc是含有11 个碳原子并具有吡喃糖结构的酸性氨基糖的特性,拟从食品工业糖类酶制剂中筛选出能够解离Neu5Gc的水解酶,本实验通过预先添加足量的溶菌酶、葡萄糖异构酶、葡萄糖氧化酶、α-半乳糖甘酶、α-乙酰乳酸脱羧酶、β-半乳糖甘酶、谷胱甘肽过氧化物酶以及菊粉酶,考察这8 种酶制剂对Neu5Gc的解离效果。如图6所示,经过溶菌酶、葡萄糖氧化酶、葡萄糖异构酶、α-半乳糖甘酶、α-乙酰乳酸脱羧酶、β-半乳糖甘酶以及谷胱甘肽过氧化物酶作用后的Neu5Gc峰面积与未经处理的无显著差异(P>0.05),说明这些酶分子中不存在能够与Neu5Gc分子结合并起催化分解作用的活性部位。然而经过菊粉酶处理后的Neu5Gc峰面积与空白对照之间存在显著差异(P<0.05),说明菊粉酶中很可能存在某个活性中心能够结合Neu5Gc并将之解离。
2.6 菊粉酶解离Neu5Gc优化试验结果
2.6.1 单因素试验结果

图7 菊粉酶作用条件的单因素试验结果Fig. 7 Results of one-factor-at-a-time experiments for optimization of inulinase hydrolysis conditions
由图7A可知,当水浴时间达到30~60 min时酶解效果较好,随着水解时间的延长,解离效果反而下降,这很可能是因为随着菊粉酶的消耗,自身温度升高会减缓酶的解离作用。由图7B可知,随着水浴温度的升高,菊粉酶对Neu5Gc的解离效果也逐渐增加,当水浴温度在45~50 ℃之间时表现出较好的解离效果。由图7C可知,随着菊粉酶添加量的增加,其对Neu5Gc的解离效果越好,当添加量达到0.7%后,酶解效果较佳,且解离效果不再显著增加。
2.6.2 正交试验优化结果
在单因素试验结果基础上,采用L9(34)正交试验优化酶制剂的最适作用条件。由表3可知,影响Neu5Gc解离效果的主次因素顺序为C>A>B,菊粉酶的最适作用条件为A3B2C3,即水浴温度50 ℃、水浴时间30 min、菊粉酶添加量0.8%。

表3 L9(34)正交试验设计与结果Table 3 L9(34) Orthogonal array design and results
2.7 菊粉酶对Neu5Gc标准品及牛肉中Neu5Gc解离效果的比较
虽然上述研究表明,菊粉酶对Neu5Gc标准品有一定解离效果,但是肉基质成分复杂,解离的环境条件有所不同,因此,需探究菊粉酶作用于牛肉时,其对Neu5Gc的解离效果。选取正交试验中获得的最佳条件A3B2C3,并取A3B2C1以及A2B3C1两个条件作用后的结果作对比,结果如表4所示。所得结果一方面证实了A3B2C3组合,即水浴温度50 ℃、水浴时间30 min、菊粉酶添加量为质量分数0.8%时,对Neu5Gc标准品的解离效果最优,解离率达(50.52±0.88)%,另一方面,相同的菊粉酶作用条件处理牛肉,仅当水浴温度50 ℃、水浴时间30 min、菊粉酶添加量为质量分数0.8%时,对牛肉中Neu5Gc有较小的解离作用,解离率仅为(7.29±2.67)%,其余条件下对牛肉中Neu5Gc均无解离效果,这可能是由于牛肉中物质含量丰富,成分复杂,菊粉酶的活性可能受到肉中一些金属离子的抑制,或是其中某些成分与Neu5Gc竞争菊粉酶的同一活性中心,干扰了菊粉酶与Neu5Gc的结合,牛肉基质的pH值与Neu5Gc标准品溶液不同也一定程度上抑制了菊粉酶对牛肉中Neu5Gc的解离。此外,还有可能是菊粉酶处理牛肉时,由于产生空间位阻效应使其催化效果降低,导致解离率减小。
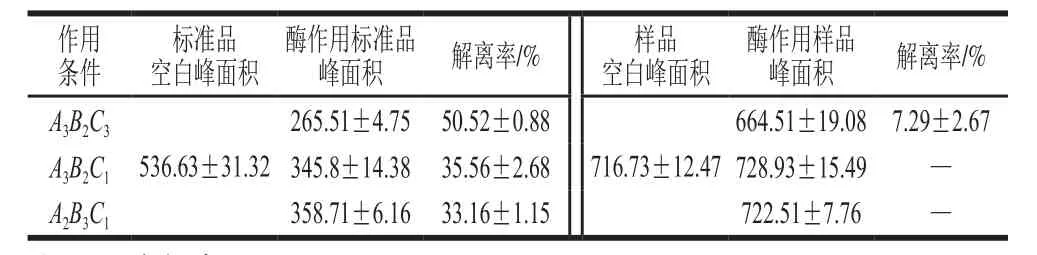
表4 不同菊粉酶作用条件对Neu5Gc标准品及牛肉中Neu5Gc的解离效果Table 4 Dissociation efficiency of Neu5Gc standard and Neu5Gc in beef under different hydrolysis conditions with inulinase
3 结 论
本实验对不同红肉及加工肉制品中Neu5Gc的含量进行了检测,研究结果显示冷鲜牛里脊、广式香肠以及贵州香肠中Neu5Gc含量较高。
结果表明当油炸温度大于150 ℃时,牛肉中的Neu5Gc损失开始增大,虽然油炸温度达到150 ℃后,随着油炸温度的升高,Neu5Gc的损失也随之增大,但是,从油炸红肉的安全和品质角度出发,建议对红肉进行油炸时,加工温度控制在150 ℃左右。
蒸煮时间的长短对肉汤中Neu5Gc的含量也有影响,随着蒸煮时间的延长,肉汤中的Neu5Gc含量呈现递增的趋势,当蒸煮时间达到180 min时,牛肉汤中Neu5Gc含量达(32.7±0.77)µg/10 mL。长时间蒸煮的肉汤中含有较高含量的Neu5Gc,不建议食用长时间蒸煮后的肉汤,然而经过高温蒸煮后的肉中的Neu5Gc含量减少,建议食用蒸煮后的肉。
本实验从多种酶制剂中筛选出对Neu5Gc标准品具有解离作用的菊粉酶,探究了菊粉酶对Neu5Gc标准品解离的最适作用条件,通过正交试验和验证实验表明当菊粉酶水浴温度50 ℃、水浴时间30 min、酶添加量为质量分数0.8%时,对Neu5Gc标准品的解离效果最优,解离率达到了(50.52±0.88)%,然而,由于牛肉成分复杂,筛选出的条件作用在牛肉基质中,却未有如此理想的解离效果。
本研究不仅为人们的日常饮食提供了科学指导,也为开展宰前宰后红肉中Neu5Gc安全稳妥的去除方法提供了依据。目前,关于菊粉酶解离Neu5Gc的机制尚不清楚,仍需深入探究获取其动力学变化信息,菊粉酶作用于红肉基质的最适条件也需进一步挖掘。
参考文献:
[1]KUROTANI K, NANRI A, GOTO A, et al. Red meat consumption is associated with the risk of type 2 diabetes in men but not in women:a Japan public health center-based prospective study[J]. British Journal of Nutrition, 2013, 110(10): 1910-1918. DOI:10.1017/S0007114513001128.
[2]PAN A, SUN Q, BERNSTEIN A M, et al. Red meat consumption and risk of type 2 diabetes: 3 cohorts of US adults and an updated meta-analysis[J]. BMC Medicine, 2014, 12(1): 215. DOI:10.3945/ajcn.111.018978.
[3]LARSSON S C, ORSINI N. Red meat and processed meat consumption and all-cause mortality: a meta-analysis[J]. American Journal of Epidemiology, 2014, 179(3): 282-289. DOI:10.1093/aje/kwt261.
[4]ALEXANDER D D, WEED D L, CUSHING C A, et al. Metaanalysis of prospective studies of red meat consumption and colorectal cancer[J]. European Journal of Cancer Prevention, 2011, 20(4): 293-307. DOI:10.1097/CEJ.0b013e328345f985.
[5]MALYKH Y N, SCHAUER R, SHAW L. N-Glycolylneuraminic acid in human tumours[J]. Biochimie, 2001, 83(7): 623-634. DOI:10.1016/S0300-9084(01)01303-7.
[6]范杏丹, 李红卫. 红肉、N-羟乙酰神经氨酸与癌症关系的研究进展[J].食品科学, 2014, 35(15): 326-329. DOI:10.7506/spkx1002-6630-201415064.
[7]ALISSON-SILVA F, KAWANISHI K, VARKI A. Human risk of diseases associated with red meat intake: analysis of current theories and proposed role for metabolic incorporation of a non-human sialic acid[J]. Molecular Aspects of Medicine, 2016, 51: 16-30.DOI:10.1016/j.mam.2016.07.002.
[8]ZAROGOULIDIS K, ELEFTHERIOU P, DOMVRI K, et al.Determination of antibodies against the red meat derived antigen Neu5Gc in patients with lung cancer. probable association with disease development and progress[J]. European Respiratory Journal, 2015,46(Suppl 59): 533. DOI:10.1183/13993003.congress-2015.PA533.
[9]SAMRAJ A N, LÄUBLI H, VARKI N, et al. Involvement of a nonhuman sialic acid in human cancer[J]. Frontiers in Oncology, 2014, 4:83. DOI:10.3389/fonc.2014.00033.
[10]TANIGUCHI N, ENDO T, HART G W, et al. Glycoscience: biology and medicine[M]. Tokyo: Springer, 2014: 1-8. DOI:10.1007/978-4-431-54836-2_169-1.
[11]CHOU H H, TAKEMATSU H, DIAZ S, et al. A mutation in human CMP-sialic acid hydroxylase occurred after the Homo-pan divergence[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(20): 11751-11756. DOI:10.1073/pnas.95.20.11751.
[12]HAYAKAWA T, AKI I, VARKI A, et al. Fixation of the humanspecific CMP-N-acetylneuraminic acid hydroxylase pseudogene and implications of haplotype diversity for human evolution[J]. Genetics,2006, 172(2): 1139-1146. DOI:10.1534/genetics.105.046995.
[13]LI H, FAN X. Quantitative analysis of sialic acids in Chinese conventional foods by HPLC-FLD[J]. Open Journal of Preventive Medicine, 2014, 4(2): 57-63. DOI:10.4236/ojpm.2014.42009.
[14]GLASS C K, OLEFSKY J M. Inflammation and lipid signaling in the etiology of insulin resistance[J]. Cell Metabolism, 2012, 15(5): 635-645. DOI:10.1016/j.cmet.2012.04.001.
[15]ROCHA V Z, LIBBY P. Obesity, inflammation, and atherosclerosis[J].Nature Reviews Cardiology, 2009, 6(6): 399-409. DOI:10.1038/nrcardio.2009.55.
[16]LÖFLING J C, PATON A W, VARKI N M, et al. A dietary non-human sialic acid may facilitate hemolytic-uremic syndrome[J]. Kidney International, 2009, 76(2): 140-144. DOI:10.1038/ki.2009.131.
[17]SERNA A, BOEDEKER E C. Pathogenesis and treatment of Shiga toxin-producing Escherichia coli infections[J]. Current Opinion in Gastroenterology, 2008, 24(1): 38-47. DOI:10.1097/MOG.0b013e3282f2dfb8.
[18]MELTONCELSA A, MOHAWK K, TEEL L, et al. Pathogenesis of Shiga-toxin producing Escherichia coli[J]. Current Topics in Microbiology & Immunology, 2012, 357: 67-103.DOI:10.1007/82_2011_176.
[19]蒋芸, 付浩, 冯昌雨, 等. 不同处理方式对红肉中N-羟乙酰神经氨酸解离的影响[J]. 肉类研究, 2015, 29(12): 52-57. DOI:10.15922/j.cnki.rlyj.2015.12.010.
[20]ANGATA T, VARKI A. ChemInformAbstract: chemical diversity in the sialic acids and related α-keto acids: an evolutionary perspective[J].Chemical Reviews, 2002, 102(2): 439-469. DOI:10.1021/cr000407m.
[21]VARKI A. Glycan-based interactions involving vertebrate sialic-acidrecognizing proteins[J]. Nature, 2007, 446: 1023-1029. DOI:10.1038/nature05816.
[22]陈鸿军, 丁铲. N-羟乙酰神经氨酸研究进展[J]. 动物医学进展, 2009,30(4): 64-68. DOI:10.3969/j.issn.1007-5038.2009.04.017.
[23]GHOSHAL A, MANDAL C. A perspective on the emergence of sialic acids as potent determinants affecting Leishmania biology[J]. Molecular Biology International, 2011(10): 532106.DOI:10.4061/2011/532106.
[24]迟玉杰, 赵国华, 王喜波, 等. 食品化学[M]. 北京: 化学工业出版社,2012: 104-105.
[25]王新宴, 凌云, 储晓刚, 等. 肉制品中四种嘌呤含量在水煮过程中的变化[J]. 食品科学, 2008, 29(7): 67-69. DOI:10.3321/j.issn:1002-6630.2008.07.009.
[26]PENNES D R, MARTEL W. Hyperuricemia and gout[J]. Seminars in Roentgenology, 2016, 57(7): 656-665. DOI:10.1016/0037-198X(86)90036-2.
[27]KIM P. Decision making in medicine[M]. 3rd. America: Mosby Elsevier, 2010: 542-545. DOI:10.1016/B978-0-323-04107-2.50196-4.
[28]杨雪芳, 王永昌, 王苗慧, 等. 痛风的发病机制与药物治疗研究进展[J]. 中医药导报, 2014(6): 89-92. DOI:10.13862/j.cnki.cn43-1446/r.2014.06.034.
