高血糖对胸椎黄韧带骨化过程中BMP-2和TGF-β表达的影响
2018-05-22张世峰金群华
陈 达,张世峰,陈 曦,金群华
胸椎黄韧带骨化(thoracic ossification of ligament flavum,OLF)最早在1912年被提出,可以导致椎管狭窄和脊髓功能障碍,临床上比较多见[1]。糖尿病是一种全身性疾病,研究[2]显示糖尿病小鼠胸椎OLF发生率高。骨形态发生蛋白2(bone morphogenetic proteins, BMP-2)和转化生长因子β(transforming growth factor-β,TGF-β)在黄韧带骨化的发病机制中相互协同[3-4]。糖尿病/高血糖是不是胸椎黄韧带骨化的危险因素、是否参与到胸椎黄韧带的骨化过程,目前尚不清楚。该研究原代培养胸椎黄韧带细胞,高糖培养模拟高血糖状态,采用免疫细胞化学及Western blot法探究高血糖状态下胸椎黄韧带骨化相关因子BMP-2和TGF-β表达,为临床上糖尿病合并胸椎黄韧带骨化的患者早期预防及治疗提供理论依据。
1 材料与方法
1.1主要试剂和仪器青霉素、链霉素、DMEM高糖培养基、0.25%胰蛋白酶(美国HyClone生物化学制品有限公司);细胞培养瓶(美国CORNING公司);胎牛血清(德国PAN生物技术公司);生物素标记的二抗、BCA蛋白提取试剂盒(北京中杉金桥生物技术有限公司);CCK8溶液(日本株式会所同仁化学研究所);BMP-2抗体、TGF-β抗体、β-actin抗体(英国Abcam公司);垂直电泳仪及转膜系统(北京市六一仪器厂);凝胶成像系统(美国BIO-RAD公司)。
1.2黄韧带细胞的原代培养及传代选取胸椎黄韧带骨化患者手术中切取骨化黄韧带标本作为实验组(骨化组),另外取胸椎骨折患者黄韧带标本作为对照组(骨折组)。用含青霉素100 U/ml、链霉素100 μg/μl的无菌PBS液冲洗3次,剥除纤维结缔组织;在DMEM高糖中迅速将黄韧带剪成1 mm3小块,接种于25 ml的细胞培养瓶内,小块间距离为0.5 cm左右。然后瓶底向上加入2 ml含10%胎牛血清、青霉素100 U/ml、链霉素100 μg/ml的DMEM高糖培养液,瓶底向上置于37 ℃、5% CO2培养箱2 h,使小块微干涸,然后轻轻翻转培养瓶,令瓶底向下,让培养液慢慢覆盖于瓶底上的组织小块,置培养箱中静置培养,3 d换1次培养液。待原代培养的细胞从组织块长出,数量增加至细胞长满瓶壁或占瓶壁80%~90%时进行传代培养。吸弃原培养液,用PBS液洗净残留培养液,加0.25%胰蛋白酶0.5 ml消化后,用10%胎牛血清的培养液终止消化,按1 ∶2分装接种入培养瓶。
1.3黄韧带细胞的鉴定倒置显微镜观察细胞形态变化及生长状况,相差显微镜下采图记录。黄韧带细胞波形蛋白染色,12孔板放置盖玻片接种对数生长期细胞,培养10 d后取出爬片,PBS冲洗3次,每次5 min;10%福尔马林浸泡10 min,PBS冲洗;3%BSA封闭40 min;滴加一抗(1:200稀释),置于湿盒4 ℃过夜;室温复温1 h,PBS冲洗;生物素标记的二抗(1 ∶200稀释)A液20 min,PBS冲洗;B液20 min,PBS冲洗;DAB显色2 min,蒸馏水终止;苏木精复染10 min,0.1%盐酸酒精分化2 s,蒸馏水冲洗,返蓝10 min;梯度酒精脱水,二甲苯透明,中性树胶封片。PBS代替一抗为阴性对照。
1.4细胞活性检测96孔板接种对数生长期的细胞悬液,5 000个/孔,100 μl/孔,设置对照组及高糖组,将培养板在培养箱中预培养10 d;加入不同浓度的葡萄糖始终浓度为30、40、50、60、70 mmol/L;干预24 h,每孔加入10 μl的CCK8溶液,置于37 ℃、5% CO2培养箱中孵育2~4 h;酶标仪测定450 nm处的吸光度值,计算细胞活力。
1.5免疫细胞化学12孔板放置盖玻片,接种对数生长期细胞,培养10 d后,给予药物干预24 h,此时细胞融合达90%左右,取出细胞爬片;PBS冲洗;10%福尔马林浸泡10 min,PBS冲洗;3%BSA封闭40 min;分别滴加一抗BMP-2(1 ∶300稀释)、TGF-β(1 ∶200稀释),置于湿盒4 ℃过夜;室温复温1 h,PBS冲洗;生物素标记的二抗(1 ∶200稀释)A液20 min,PBS冲洗;B液20 min,PBS冲洗;DAB显色2 min,蒸馏水终止;苏木精复染10 min,0.1%盐酸酒精分化2 s,蒸馏水冲洗,返蓝10 min;梯度酒精脱水,二甲苯透明,中性树胶封片。PBS代替一抗为阴性对照。每张爬片选取5个随机但不重复的视野进行分析,使用IPP6.0病理图像分析系统测定阳性颗粒的平均光密度值。
1.6Westernblot检测蛋白表达量收集对数生长期细胞弃去培养液,冷Hanks液清洗,BCA蛋白提取试剂盒提取蛋白,BCA法测定蛋白浓度,将蛋白样品与上样缓冲液混匀,沸水10 min使蛋白变性。蛋白样品用10%的聚丙烯酰胺凝胶进行SDS-PAGE电泳,后转膜至PVDF膜,5%脱脂奶粉室温封闭3 h,分别加入一抗β-actin(1 ∶5 000稀释) 、BMP-2(1 ∶2 000稀释) 、TGF-β (1 ∶2 000稀释),4 ℃冰箱孵育过夜,TBST冲洗后加入相应生物素标记的二抗(1 ∶5 000稀释),室温孵育2 h,TBST冲洗,滴加化学发光试剂,凝胶图像分析仪显影,保存图片,Image J 2X软件分析数据。

2 结果
2.1光镜下黄韧带细胞形态的鉴定光镜下胸椎黄韧带细胞均匀分布,呈长梭形、多角形,胞质丰富,细胞核居中,见图1A。波形蛋白阳性细胞可见棕黄色及淡黄色颗粒沉积在胞质,见图1B。
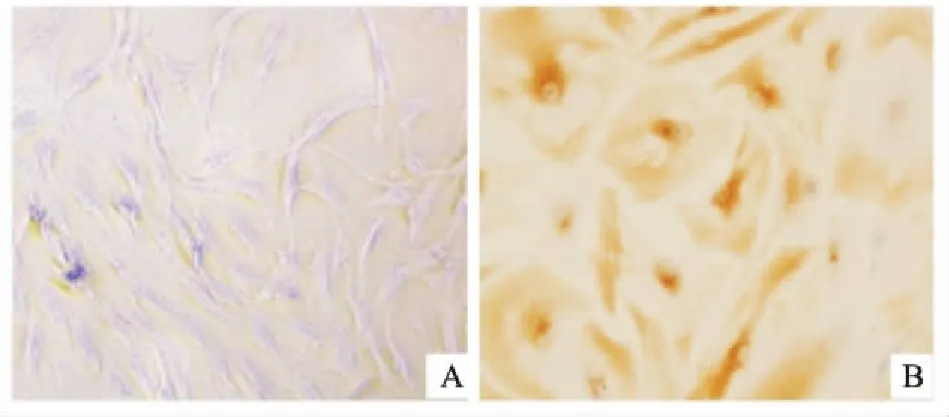
图1 黄韧带细胞光镜下观察(A)及波形蛋白染色结果(B) ×400
2.2高糖培养下黄韧带细胞的活性随着葡萄糖浓度的增加,细胞活性逐渐降低,见图2,其中50 mmol/L组细胞活性为(73.6±5.42)%,与对照组比较,差异有统计学意义(P<0.01),选用50 mmol/L进行后续实验。
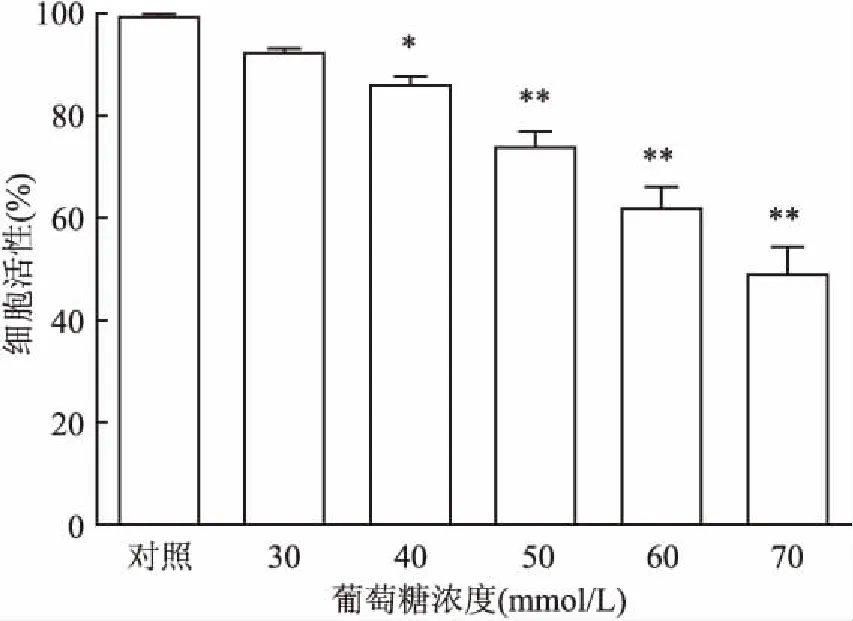
图2 黄韧带细胞活性检测结果
2.3免疫细胞化学法检测BMP-2和TGF-β的表达胸椎黄韧带细胞胞质内棕黄色或淡黄色颗粒沉积为BMP-2和TGF-β免疫细胞化学染色阳性,见图3、4。骨折对照组细胞BMP-2和TGF-β表达量均很少,骨化对照组BMP-2和TGF-β的表达量较骨折对照组明显增加(P<0.05),高糖培养后骨折高糖组及骨化高糖组BMP-2和TGF-β的表达均明显增加(P<0.01),而且骨化高糖组的表达量显著高于骨折高糖组(P<0.01)。
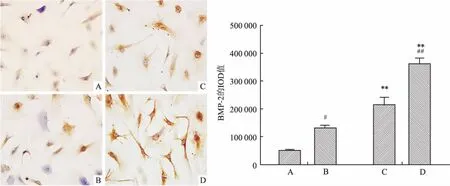
图3 黄韧带细胞BMP-2免疫细胞化学染色结果 ×400
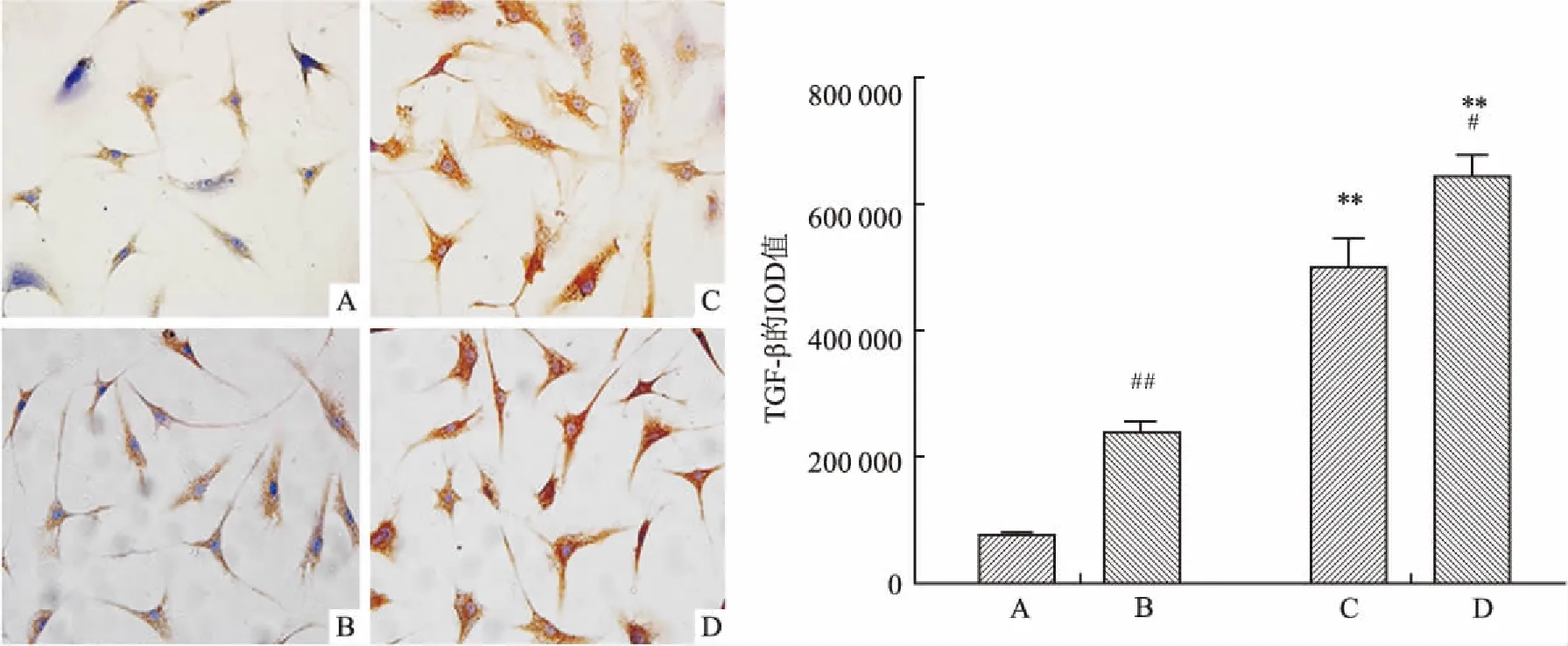
图4 黄韧带细胞TGF-β免疫细胞化学染色结果 ×400
2.4BMP-2和TGF-β蛋白表达水平BMP-2及TGF-β蛋白相对分子量为45、13 ku,胸椎黄韧带细胞经Western blot检测,骨化对照组BMP-2和TGF-β的表达量较骨折对照组明显增加(P<0.05,P<0.01),高糖培养后骨折高糖组及骨化高糖组BMP-2和TGF-β的表达均明显增加(P<0.01),而且骨化高糖组的表达量显著高于骨折高糖组(P<0.01),见图5。
3 讨论
胸椎黄韧带骨化(thoracic ossification of ligament flavum, TOLF)多发生于黄种人[5],在年龄超过65岁的亚洲人患病率可高达20%,以下胸椎和胸腰段脊椎多见,是一种特殊类型的异位骨化,其导致椎管狭窄、脊髓压迫受损,出现一系列神经功能障碍的多样化临床表现[6-8]。韧带的软骨内成骨是TOLF的基本病理过程,其发病机制目前仍然不清楚,且目前主要治疗方式骨化韧带切除减压效果并不理想,至今没有有效的药物阻止骨化的进展。因此通过对其病因学的研究,及早发现TOLF的高危人群,做到及时预防、诊断和治疗显得尤为重要。本研究原代培养骨化的胸椎黄韧带细胞,高糖培养模拟糖尿病高血糖状态,检测胸椎黄韧带骨化相关因子BMP-2和TGF-β表达,为临床上糖尿病合并胸椎黄韧带骨化的患者早期预防及治疗提供理论依据。
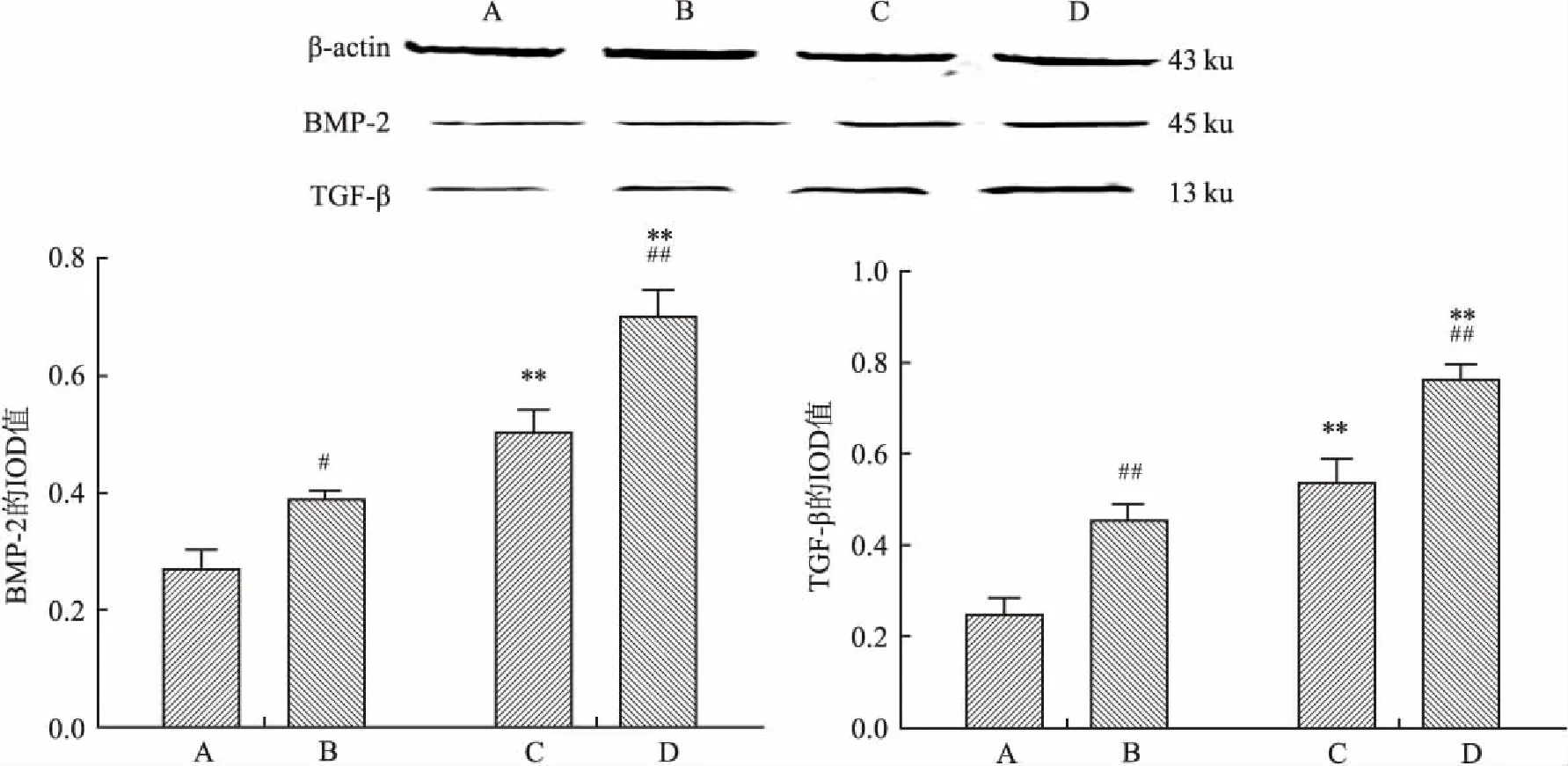
图5 Western blot法检测黄韧带细胞BMP-2和TGF-β表达
研究[9-10]显示年龄、饮食、内分泌和代谢异常、生长因子、力学、氟化物、脊柱退变、创伤、炎症、遗传及成骨细胞等多种因素与TOLF的发病有关。骨形态发生蛋白(bone morphogenetic proteins,BMP)是1965年在成人骨组织中提取的一种活性蛋白,其中BMP-2是骨诱导因子,在骨化过程中,BMP-2能够独立诱导异位骨化的蛋白因子,是韧带骨化的启动因子。Han et al[11]利用成骨样细胞 MC3T3-E1,给予BMP-2刺激培养,发现成骨细胞的增生和分化显著增加。转化生长因子(transforming growth factor, TGF)是生长因子家族的一员,是具有多种功能的蛋白多肽,可以调节细胞增殖、分化、促进细胞外基质合成等。TGF-β通过刺激黄韧带细胞分泌胶原协助BMP-2在骨化后期刺激骨形成[12]。本研究结果显示骨化黄韧带细胞BMP-2和TGF-β的表达量明显高于胸椎骨折患者的胸椎黄韧带细胞。
糖尿病时全身性代谢疾病,对骨和关节等全身器官均有影响[13]。正常的血糖对于椎间盘细胞、黄韧带细胞等的生存和细胞外基质的稳定都非常重要,但高血糖会影响椎间盘细胞的浓度梯度、椎间盘的内环境,诱导氧化应激、内质网应激,引发椎间盘细胞、黄韧带细胞等发生凋亡[14-15]。另一方面,糖尿病微血管病变影响椎间盘血供,内皮细胞坏死、凋亡等[16]。Braddock et al[2]利用小鼠糖尿病模型发现,血糖升高导致胰岛素样生长因子( insulinlike growth factor,IGF)升高,最终糖尿病小鼠TOLF发生率增加。利用链脲佐菌素诱导的糖尿病大鼠模型,结果显示肾小球TGF-β在肾病早期呈进行性增高。Gilbert et al[17]利用链脲佐菌素诱导的糖尿病大鼠模型,也发现在小管上皮细胞中TGF-β mRNA和Ⅳ型胶原mRNA弥漫升高,诱导后6个月中TGF-β及Ⅳ型胶原表达持续升高。同时也证实TGF-β在糖尿病增殖期视网膜病变形成过程中起关键作用。张亮 等[18]研究发现糖尿病患者腰椎黄韧带中BMP-2表达较非糖尿病患者增高。本研究结果显示,高糖状态下骨化的胸椎黄韧带细胞及胸椎骨折患者的黄韧带细胞BMP-2和TGF-β的表达量均明显增加,而且骨化组高于骨折组,提示高血糖促进BMP-2和TGF-β的表达。
综上所述,本研究原代培养胸椎黄韧带细胞,在模拟糖尿病高血糖状态下,骨化黄韧带细胞和胸椎骨折患者的黄韧带细胞骨化相关因子BMP-2和TGF-β表达明显增加,提示糖尿病/高糖不但是胸椎黄韧带骨化的危险因素。但是糖尿病是全身性疾病,涉及多代谢途径及多器官,对胸椎黄韧带骨化的作用应该是多方面而复杂的,其详细机制尚需进一步深入研究。
参考文献
[1] Lee K S, Shim J J, Doh J W, et al. Transient paraparesis after laminectomy in a patient with multilevel ossification of the spinal ligament[J].J Korean Med Sci, 2004, 19(4): 624-6.
[2] Braddock R, Siman C M, Hamilton K, et al. Gamma-linoleic acid and ascorbate improves skeletal ossification in offspring of diabetic rats[J]. Pediatr Res, 2002, 51(5): 647-52.
[3] Nakatani T, Marui T, Hitora T, et al. Mechanical stretching force promotes collagen synthesis by cultured cells from human ligamentum flavumviatransforming growth factor-beta1[J]. J Orthop Res,2002, 20(6):1380-6.
[4] Miura M, Chen X D, Allen M R, et al. A crucial role of caspase-3 in osteogenic differentiation of bone marrow stromal stem cells[J]. J Clin Invest, 2004, 114(12):1704-13.
[5] Vasudevan A, Knuckey N W. Ossification of the ligamentum flavum[J].J Clin Neurosci, 2002, 9(3):311-3.
[6] Abe M, Takahashi M, Horiuchi K, et al. The changes in crosslinkcontents in tissues after formalin fixation[J]. Anal Biochem, 2003, 318(1):118-23.
[7] Schulte T L, Heidenreich J O, Schilling A M, et al. Comparison of metric analysis of spinal structures, exemplarily of the ligamentum flavum, obtained with CT and MRI[J]. Eur J Radiol, 2004, 52(3):224-8.
[8] Fong S Y, Wong H K. Thoracic myelopathy secondary to ligamentumflavum ossification[J]. Ann Acad Med Singapore, 2004, 33(3): 340-6.
[9] Vasudevan A, Knuckey N W. Ossification of the ligamentum flavum[J].J Clin Neurosci, 2002, 9(3):311-3.
[10] 王 哲,王全平,张俊华.骨形成蛋白在黄韧带骨化中的表达定位[J].第四军医大学学报,2002,23(4):341-3.
[11] Han S H, Kim K H, Han J S, et al. Response of osteoblastlike cells cultured on zirconia to bone morphogenetic protein-2 [J].J Periodontal Implant Sci,2011,41(5):227-33.
[12] Nakatani T, Marui T, Hitora T, et al. Mechanical stretching force promotes collagen synthesis by cultured cells from human ligamentum flavumviatransforming growth factor-beta1[J]. J Orthop Res,2002, 20(6):1380-6.
[13] 陈 农,董 健.胸椎黄韧带骨化的基础与诊断治疗进展[J].中国矫形外科杂志,2010,18(5):389-92.
[14] Urban J P,Smith S,Fairbank J C.Nutrition of the intervertebral disc[J]. Spine, 2004, 29(23):2700-9.
[15] 鲍 恒,侯莜魁.糖尿病大鼠椎间盘细胞的凋亡[J].中华骨科杂志,2005,25(7): 434-7.
[16] 陈 森,徐振华,贾吉光,等.糖尿病大鼠终板微血管改变与髓核细胞凋亡的关系[J].武汉大学学报:医学版,2008,29(5):584-6.
[17] Gilbert R E, Gox A, Wu L L, et al. Expression of transforming growth factor-beta and type IV collagen in the renal tubulointerstitium in experimental diabetes: effects of ACE inhibition[J]. Diabetes,1998,47(3):414-22.
[18] 张 亮,倪东馗,李立军,等.糖尿病对腰椎管狭窄症黄韧带骨化的影响[J].天津医科大学学报,2013,5(19):196-8.
