大鼠脑缺血再灌注后GRP78、CHOP表达变化
2018-05-22王春梅
仇 健,武 菲,王春梅,万 磊,唐 斌,白 波
临床上缺血性脑卒中是神经系统常见病和多发病,现正趋向年轻化,脑缺血后相当一部分血管可以自身再通,如短暂性脑缺血发作,也有一部分通过溶栓后再通,但是缺血再灌注损伤时间的长短严重影响患者预后的生活质量。动物实验已经充分证实缺血再灌注后大量神经细胞会受损死亡,而缺血半暗带的细胞会发生凋亡,为检测缺血半暗带凋亡细胞,做了半暗带取材。内质网应激是细胞凋亡的重要途径之一,葡萄糖调节蛋白78(glucose-regulated protein 78, GRP78)是内质网应激的重要标志物[1],CHOP是CCAAT/强化结合蛋白同源蛋白(CCAAT/enhancer binding proteins homologous protein,CHOP),是细胞凋亡的重要标志物,检测标志物对细胞的功能做出客观的评价。GRP78是热休克蛋白70家族成员的一份子[2],生理作用下GRP78在内质网内参与蛋白质的正确折叠,协助蛋白质跨膜转运,并与蛋白激酶RNA样内质网激酶(RNA dependent protein kinase like ER kinase,PERK)、活化转录因子6 (activating transcription factor 6,ATF6)、肌醇需求酶-1 (inositol-requiring enzyme 1,IRE1)结合,使这些跨膜蛋白处于失活状态。当各种原因引起的组织细胞内外环境改变时:如缺血缺氧,氧化应激,病毒细菌感染,蛋白质修饰障碍,以及部分肿瘤[3]发生时,GRP78与这三种蛋白解离,促进蛋白质正确折叠,保护细胞。正常情况下,CHOP表达量很低,当细胞受到缺血缺氧刺激或感染持续存在时,CHOP表达上调,CHOP的表达增多会诱发细胞凋亡。该实验研究缺血2 h再灌注不同时间,GRP78及CHOP表达变化及意义。
1 材料与方法
1.1材料
1.1.1实验动物 健康成年雄性Wistar大鼠,体质量(240±10)g,SPF级,购自济南朋悦实验动物繁育有限公司。
1.1.2主要试剂 2,3,5—氯化三苯基四氮唑(TTC)、TEMED购自美国Sigma公司;RIPA裂解液、叠氮钠、牛血清白蛋白(BSA)购自北京索莱宝科技有限公司;增强型化学发光(ECL)工作液购自杭州联科生物技术有限公司;TUNEL试剂盒购自美国Promega公司;GRP78购自美国Cell Signaling公司;CHOP购自沈阳万类公司;β-actin、山羊抗鼠二抗、山羊抗兔二抗购自北京中杉金桥生物技术有限公司。
1.1.3主要仪器 荧光显微镜购自日本Olympus公司;电泳、电转仪器购自美国Bio-Rad公司;凝胶成像系统购自美国Syngene公司;脑立体定位仪购自美国Stoelting公司。
1.2方法
1.2.1模型制作 选取体质量(240±10)g的Wistar雄性大鼠100只,术前禁食禁水,改良线栓法阻塞大鼠右侧大脑中动脉模型,术后1.5~2 h大鼠清醒,观察空悬模型鼠,其前肢是否贴胸壁,贴壁的为成功模型。根据Zea Longa法对大鼠评分,评分标准:0分:无神经损伤;1分:对侧肢体不能完全伸展;2分:大鼠在地上旋转;3分:大鼠倾倒不能行走;4分:大鼠不能行走,意识丧失。0分、4分剔除,然后取合格模型分别再灌注2、12、24 h取材。
1.2.2TTC染色 选用成功大鼠模型取出完整的鼠脑放置-20 ℃冰箱冷冻30 min。用刀片5~6张平均2 mm的冠状脑片。把切好的脑片放在12孔板,加入2%的TTC溶液,轻微晃动12孔板,使脑片充分与溶液接触,37 ℃避光孵育5~10 min。用PBS清洗脑片3次,脑片置于4%多聚甲醛溶液中避光过夜固定。梗死区域脑片是白色,正常脑组织显示红色。数码相机拍照,用Image J处理图片并计算苍白区域体积占全脑正常组织的百分比。
1.2.3Western blot 将提前备份的各个时间点的脑组织进行分组处理,缺血2 h、缺血2 h再灌注2 h、缺血2 h再灌注12 h、缺血2 h再灌注24 h。用超声波细胞粉碎机粉碎加有蛋白酶抑制剂(PMSF)和裂解液(RIPA)的脑组织,粉碎后4 ℃、12 000 r/min离心30 min,取上清液,用BCA试剂盒测蛋白浓度,加4×上样缓冲液,混匀后放100 ℃金属浴10 min。在垂直电泳仪中配制12%的分离胶和5%的浓缩胶,每个泳道取30 μg蛋白上样量,电泳分离后转PVDF膜上,5%脱脂牛奶封闭2 h,4 ℃孵育GRP78(3 ∶5 000)、β-actin(2 ∶5 000)、CHOP(3 ∶5 000)过夜。TBST洗涤3次,每次10 min,室温孵育相应的二抗(1 ∶6 000)1 h,TBST洗3次,浸入化学发光液中,暗室曝光。
1.2.4TUNEL染色 选用冰冻脑组织切片厚度为5 μm,技术方法完全遵照说明书。倒置荧光显微镜在缺血周边区和对侧相应区域随机选取三个视野,计算阳性细胞数=(绿色荧光个数/蓝色细胞总数)×100%。

2 结果
2.1模型梗死面积的检测用TTC检测缺血性脑卒中模型缺血2 h分别再灌注2、6、12、24 h的梗死面积,结果显示:模型缺血2 h再灌注2、6 h没出现相应梗死灶,只是损伤侧有轻微炎性水肿,当再灌注12 h损伤侧脑梗死灶明显(P<0.001),炎性水肿明显,对侧没相应梗死灶到再灌注24 h梗死灶最为显著且不再变化,见图1,统计学分析脑梗死灶面积为(19.68±1.75)% (P<0.001),证明模型成功。
2.2GRP78和CHOP表达检测Western blot检测不同时间点GRP78及CHOP的表达,结果显示脑组织在缺血及缺血再灌注不同时间点较正常组均明显升高(P<0.05),GRP78自身对比损伤侧较对侧明显升高(P<0.05),其中缺血2 h再灌注24 h自身对比差异最明显(P<0.01),CHOP自身对比损伤侧较对侧明显升高(P<0.05),CHOP在缺血2 h表达升高,并持续至再灌注24 h,其中缺血2 h再灌注12 h时差异有统计学意义。见表1、图2。
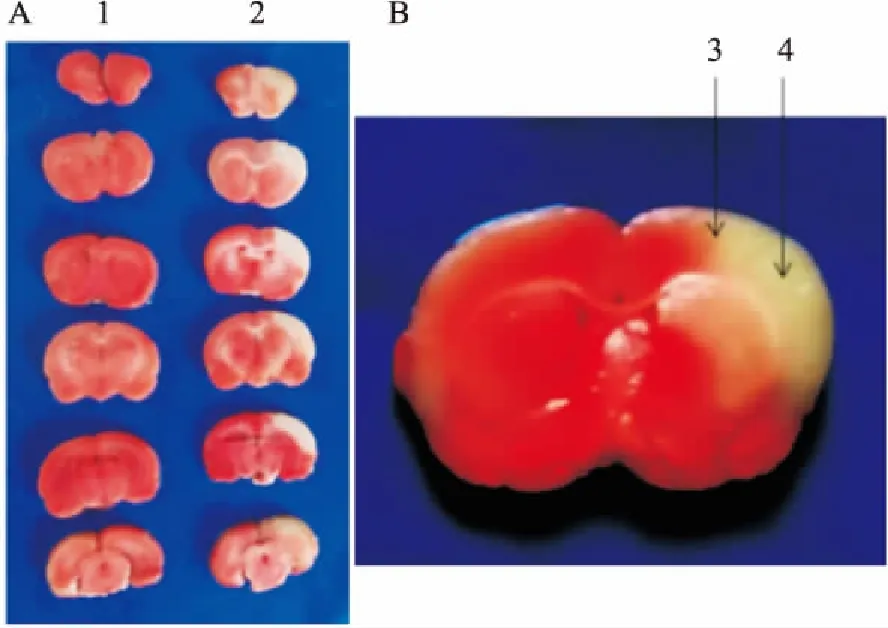
图1 缺血2 h再灌注24 h脑组织梗死面积
2.3TUNEL检测缺血模型患侧以及健侧凋亡细胞的数量结果显示缺血2 h再灌24 h患侧凋亡细胞在梗死区与正常区域交界处明显增多,统计学分析患侧凋亡细胞个数较健侧凋亡细胞个数明显增多,患侧凋亡细胞百分比为72.96%±9.16%(P<0.005)。见图3。
3 讨论
GRP78蛋白不仅是内质网应激的标志性产物,在没外界环境干扰情况下,正常细胞GRP78和CHOP都会微弱表达,当细胞受到感染[4]或理化因素影响时[5],细胞内GRP78蛋白的含量会相应升高,以维持自身生理功能正常。通常GRP78蛋白持续升高都会对细胞生理产生一定的影响,当理化因素引起GRP78蛋白升高时CHOP也会相应的升高,GRP78 与PERK、ATF6 、IRE1[6]蛋白分离,最常见例子葡萄糖的匮乏、氧量的供给减少,病毒感染,这使细胞GRP78蛋白升高,但CHOP的升高不一定导致细胞凋亡,即便它参与细胞的凋亡过程。细胞凋亡往往有三条途径:线粒体途径、内质网途径、死亡受体途径,然而线粒体途径[7]是最主要的途径,这可能是内质网途径标志物CHOP升高而不一定发生凋亡的原因之一。
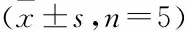
表1 缺血2 h再灌注不同时间缺血半暗带脑组织GRP78、CHOP表达
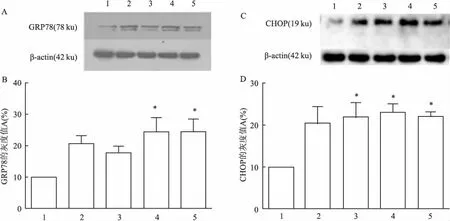
图2 缺血2 h再灌注不同时间缺血半暗带脑组织GRP78、CHOP表达
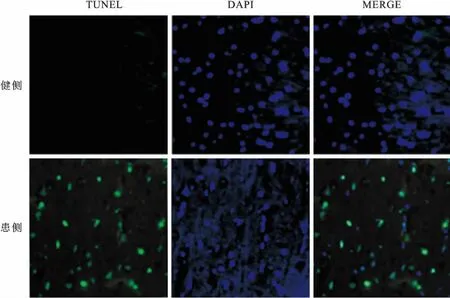
图3 TUNEL法检测模型缺血侧及健侧凋亡细胞结果
当Western blot检测CHOP表达时,个别大鼠脑组织的GRP78蛋白增高,而相应的CHOP蛋白没有增高,但对侧的CHOP相比患侧明显增高,对侧GRP78没有增高(结果未附)。同时TUNEL检测患侧缺血半暗带凋亡细胞增多,而对侧脑组织未见凋亡细胞。这和宋小燕 等[8]研究显示,缺血再灌注不同时间点的TUNEL结果一致。但所有模型大鼠对侧脑组织均未见凋亡细胞,说明脑缺血再灌注损伤对健侧细胞没有影响。这说明即使CHOP参与了细胞凋亡的途径,但凋亡细胞也不一定出现,细胞的凋亡可能是很多因素参与的结果,CHOP只能是一个参考。GRP78在短时间的内质网应激中具有保护细胞的作用,长时间的内质网应激即使GRP78持续表达,但不一定对细胞有利,可能促进细胞的凋亡[9]。CHOP的持续升高对细胞的凋亡也有促进作用,短时间的升高不一定能引起细胞的凋亡[10]。本研究显示缺血2 h GRP78以及CHOP开始升高,GRP78再灌注12、24 h缺血半暗带GRP78表达量都很高,CHOP在缺血2 h再灌注12 h达到了最高值,并再灌注24 h一直维持高表达状态。GRP78的峰值和刘楠 等[11]的研究基本一致。个别模型患侧Western blot结果CHOP降低但对侧CHOP升高,相应的GRP78不高,或许CHOP的升高与患侧血流阻断,对侧脑组织血供丰富,代偿性代谢旺盛[12],神经细胞活动增强,细胞器工作加重导致CHOP上调。有报道CHOP不仅参与了细胞的凋亡,也参与巨噬细胞合成细胞因子的炎症反应[13],但在缺血再灌注正常侧CHOP升高的具体原因目前还不明。
总之,本实验是探讨缺血再灌注不同时间点GRP78与CHOP表达量的关系,短时间的GRP78升高能对细胞有保护作用[14],CHOP是细胞凋亡的诱导标志物,目前本研究显示,在脑缺血再灌注损伤模型中,当GRP78和CHOP共同高表达时,细胞的凋亡数目会增多,短时间GRP78或CHOP单一升高则不会引起细胞凋亡。也有文献[15-16]指出在一些肿瘤细胞内GRP78、CHOP表达也会升高,说明GRP78与CHOP可能参与肿瘤的发生与发展。因此,在不同环境状态下,GRP78、CHOP的表达高低意义不一定相同。GRP78、CHOP不同时间点表达量的变化也能为后续实验提供理论支持。
参考文献
[1] 卓德祥, 唐朝枢, 李载权. 内质网应激反应基因表达调控的多样性[J]. 医学分子生物学杂志, 2006, 3(1): 32-5.
[2] Boulangé-Lecomte C, Forget-Leray J, Xuereb B. Sexual dimorphism in Grp78 and Hsp90A heat shock protein expression in the estuarine copepod eurytemora affinis[J]. Cell Stress Chaperones, 2014, 19(4): 591-7.
[3] Huang L W, Lin C Y, Lee C C, et al. Overexpression of GRP78 is associated with malignant transformation in epithelial ovarian tumors[J]. Appl Immunohistoch Mol Morphol, 2012, 20(4): 381-5.
[4] Zhang X Q, Xu C F, Yu C H, et al. Role of endoplasmic reticulum stress in the pathogenesis of nonalcoholic fatty liver disease[J]. World J Gastroenterology, 2014, 20(7): 1768-76.
[5] 李建勋, 李 艳, 何 阳, 等. GRP78、GRP94及CHOP在亚砷酸钠致肝损伤过程中的表达变化[J]. 贵州医药, 2016, 40(1): 3-5, 113.
[6] Hotamisligil G S. Endoplasmic reticulum stress and the inflammatory basis of metabolic disease[J]. Cell, 2010, 140(6): 900-17.
[7] 杨绍杰, 孟金萍, 屈 祎, 等. 细胞凋亡信号传导通路的研究进展[J]. 中国比较医学杂志, 2007, 17(5): 297-301.
[8] 宋小燕, 赵永波, 周晓琳, 等. 大鼠脑缺血再灌注后GRP78和GADD153的表达变化研究[J]. 中风与神经疾病杂志, 2008, 25(2): 139-41.
[9] Louessard M, Bardou I, Lemarchand E, et al. Activation of cell surface GRP78 decreases endoplasmic reticulum stress and neuronal death[J]. Cell Death Differ, 2017,24(9): 1518-29.
[10] Benavides A, Pastor D, Santos P, et al. CHOP plays a pivotal role in the astrocyte death induced by oxygen and glucose deprivation[J]. Glia, 2005, 52(4): 261-75.
[11] 刘 楠, 于雪凡, 李 岩, 等. 缺血后处理对大鼠脑缺血/再灌注损伤内质网应激通路相关分子的影响[J]. 中风与神经疾病, 2014, 31(3): 203-6.
[12] 罗黎力, 熊 英, 王慧卿. 新生大鼠脑白质损伤时GRP78和CHOP基因表达变化[J]. 中国新生儿科杂志, 2009, 24(3): 3-1.
[13] Nishitoh H. CHOP is a multifunctional transcription factor in the ER stress response[J]. J Biochem, 2012,151(3): 217-9.
[14] 李平法, 詹合琴. 不同缺血时间对大鼠脑组织葡萄糖调节蛋白78表达的影响[J]. 中华脑科疾病与康复杂志:电子版, 2013, 3(3): 31-3.
[15] 李伊倩, 陈俊榕, 李初俊, 等. 相同遗传背景结直肠腺瘤-癌组织序列CHOP表达与细胞增殖/凋亡比率的研究[J]. 中国病理生理杂志, 2014, 30(6): 1004-9.
[16] 王明珠, 卢德赵. 葡萄糖调节蛋白78在肿瘤中作用的研究进展[J]. 科技展望, 2016, 26(35): 220-2.
