血管紧张素Ⅱ通过ERK1/2通路促进血管内皮细胞钙化
2018-05-22程治源凌秋洋宗刚军
程治源,叶 挺,凌秋洋,吴 婷,马 涛,王 倩,宗刚军,
血管钙化和动脉粥样硬化具有高度相关性,是预测心血管疾病发病率和死亡率的重要预测标志[1-3]。骨形态发生蛋白-2(bone morphogenetic protein 2 ,BMP2)和骨形态发生蛋白-4 (bone morphogenetic protein 4,BMP4)是转化因子β超家族成员细胞因子,在形成血管钙化的病理生理学过程中起到了重要作用[4]。BMP2和BMP4蛋白在血管及瓣膜中上调与氧化应激、炎症、高血糖、高血脂有关[5]。通过在血管损伤招募炎性细胞,血管紧张素Ⅱ在血管炎症反应调控中扮演了重要作用。同时,血管紧张素Ⅱ也能通过刺激转录因子的作用促进炎症介质的表达[6]。然而,血管紧张素促进人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)的BMP2、BMP4蛋白的表达具体机制尚不完全清楚。在动物模型中,血管紧张素Ⅱ型受体阻断剂(氯沙坦)可以减少冠状动脉粥样硬化斑块的负荷[7]。因此,对于血管紧张素Ⅱ诱导内皮细胞钙化因子BMP2、BMP4的表达,氯沙坦可能有一些潜在的保护作用。在动物模型中,在多种促钙化因素刺激下,HUVECs的细胞表型可由收缩型转化为成骨样细胞表型。血管紧张素Ⅱ在血管钙化的发生和进展中起到了重要作用[8]。本研究探讨血管紧张素Ⅱ在血管钙化中的作用及其机制。
1 材料与方法
1.1材料HUVECs从上海江林生物科技有限公司进口。以HUVECs为研究对象,通过伦理委员会批准和国家有关生物制品进口审批手续,为合法进口生物材料。内皮细胞培养基(endothelial cell medium,ECM)从上海江林生物公司进口。血管紧张素Ⅱ购自美国Sigma公司。BMP-2、BMP-4抗体及U0126从艾博抗(Abcam, Cambridge, UK)公司进口, T-ERK、P-ERK抗体从CST (Cell signal technology, Shanghai, China)公司购买。ELISA试剂盒从杭州联科生物公司购买,氯沙坦从默沙东医药公司购买,其他试剂从赛德生物公司(苏州)购买。
1.2HUVECs的培养HUVECs从上海江林生物科技有限公司购买,HUVECs生长在ECM中,这种培养基含有5%胎牛血清、1%内皮生长因子。将细胞加入ECM培养液后,在37 ℃空气和5%二氧化碳混合气体中培养。待细胞长满培养瓶底80%左右进行传代,取3~5代呈融合的生长状态良好的细胞用于细胞实验,每2 d 换1次液。实验采用5~8代HUVECs。取HUVECs,按1×105/ml接种于12孔培养板中培养,连续培养5 d 。
1.3实验分组
1.3.1按筛选不同浓度血管紧张素Ⅱ对血管钙化的影响分组 将培养5天的HUVECs分为5组:对照组、10 nmol/L血管紧张素Ⅱ、 100 nmol/L血管紧张素Ⅱ、1 μmol/L血管紧张素Ⅱ、10 μmol/L血管紧张素Ⅱ。
1.3.2按研究ERK1/2通路在其中的作用分组 ① 用血管紧张素Ⅱ刺激HUVECs 0、15、30、45、60 min不同时间点,检测ERK1/2 通路的磷酸化水平。② 将连续培养5 d的HUVECs分为4组:对照组(用5%胎牛血清的ECM培养液)、血管紧张素Ⅱ组(100 nmol/L Ang Ⅱ)、氯沙坦组(100 nmol/L Ang Ⅱ+1 μmol/L Losartan)、U0126组(100 nmol/L Ang Ⅱ+ U0126 1 μmol/L)。培养5 d的HUVECs,用Western blot和ELISA方法检测BMP2、BMP4的蛋白表达。
1.4Westernblot检测BMP2、BMP4、β-actin、ERK1/2、P-ERK1/2蛋白的表达水平收集培养5天的HUVECs,提取总蛋白,在预处理的细胞中加入100 μl细胞裂解液,振荡器震荡至细胞裂解,加入25 μl 5×上样缓冲液混匀。将蛋白标本置于100 ℃水浴加热8 min后进行14 000 r/min离心5 min。用移液枪取10 μl制备好的蛋白标本加到样品孔中进行电泳,结束后通过转膜将蛋白质从SDS-PAGE凝胶转移到PVDF膜上,用5% BSA封闭PVDF膜免疫球蛋白结合位点,然后孵一抗过夜,第2天洗膜后再加入辣根过氧化物酶标记的二抗孵育,孵育结束后洗膜,最后加入曝光液,对PVDF膜进行曝光,用Image J软件(Wayne Rasband, National Institutes of Health, Bethesda, Md)对条带进行分析。
1.5ELISA法测定BMP2、BMP4分泌量收集培养细胞上清标本,根据ELISA试剂盒的说明对细胞培养上清液中BMP2、BMP4的水平进行测定。使用全自动酶标仪(BIORAD680,Hercules,CA)在450 nm波长下进行读数并分析,根据标准曲线,计算分泌蛋白BMP2、BMP4的浓度。

2 结果
2.1血管紧张素Ⅱ诱导HUVECs表达BMP2、BMP4最适浓度的筛选培养5 d的HUVECs,分别给予不同浓度梯度血管紧张素Ⅱ(10 nmol/L 、 100 nmol/L、1 μmol/L、10 μmol/L)刺激HUVECs,发现100 nmol/L组与其他各组比较,100 nmol/L血管紧张素Ⅱ诱导HUVECs上调BMP2、BMP4蛋白最显著,差异有统计学意义(F=7.840、1.539,P<0.05),见图1A。
2.2血管紧张素Ⅱ通过ERK1/2通路调控钙化因子表达① Western blot检测ERK1/2通路磷酸化水平,发现100 nmol/L血管紧张素Ⅱ刺激HUVECs,15 min时磷酸化水平开始升高,在45 min时达到最高值,60 min时降低,在45 min时与0 min时比较,差异有统计学意义(F=1.778,P<0.05),见图2。② Western blot及ELISA检测BMP2、BMP4蛋白,发现血管紧张素Ⅱ(100 nmol/L)刺激组BMP2、 BMP4蛋白明显高于对照组(用5%胎牛血清的ECM培养液),差异有统计学意义(F=36.00、1.440,P<0.05);而且血管紧张素Ⅱ(100 nmol/L)刺激组上清蛋白BMP2、 BMP4明显高于未特殊处理的对照组,差异有统计学意义(F=1.033、4.503,P<0.05),见图1B、1C。氯沙坦组(100 nmol/L Ang Ⅱ+1 μmol/L Losartan)和U0126组(100 nmol/L Ang Ⅱ+U0126 1 μmol/L)BMP2、 BMP4蛋白较单纯血管紧张素Ⅱ(100 nmol/L)刺激组下降,差异有统计学意义(F=4.000、4.000、25.00、6.250,P<0.05),见图3A,而且上清蛋白BMP2、 BMP4蛋白较单纯血管紧张素Ⅱ(100 nmol/L)刺激组下降,差异有统计学意义(F=6.857、2.228、3.123、23.160,P<0.05),见图3B、3C。
3 讨论
在动脉粥样硬化、慢性肾脏病、高血压、糖尿病中血管钙化是很常见的血管病变。血管钙化与心血管疾病的高发病率和死亡率直接相关。目前仍然缺少有效的可行的治疗方法去治疗或者阻断血管钙化的发展。
血管钙化是一个促进钙沉积在血管壁复杂的动态过程涉及很多机制。血管钙化增加动脉僵硬降低弹性,这又会对血流动力学和心血管功能有影响。许多因素触发和促进钙化包括矿物质代谢异常,尤其是高磷血症和高钙血症,它可以刺激血管平滑肌细胞分化为成骨细胞表型[9-10]。这是通过上调核心结合因子1α(cbfα1)/x MSX-2和BMP2并且参与正常骨骼的发育,控制成骨蛋白的表达,这些蛋白包括骨钙素、骨粘连蛋白、碱性磷酸酶、胶原蛋白和骨唾液酸蛋白。另外一种导致血管钙化的机制是失去了钙化的抑制剂,比如胎球蛋白、MGP、焦磷酸和骨桥蛋白[11]。血管紧张素Ⅱ通过信号通路上调这些成骨蛋白。血管紧张素Ⅱ刺激骨形态蛋白2(BMP2)和骨形态蛋白4(BMP4)的表达[12],同时刺激阳离子转运,比如Ca2+和Mg[2,13-14]。这些证据表明,血管紧张素Ⅱ的升高与血管钙化的风险增加密切相关。为了进一步了解血管紧张素Ⅱ促进钙化的机制,本研究探讨了血管紧张素Ⅱ在内皮细胞钙化中的作用。
临床上具有高踝肱指数(ankle-brachial index,ABI)的患者其血浆血管紧张素Ⅱ的水平明显升高。此外,在体外血管紧张素Ⅱ加剧血管钙化[15]。本研究显示,血管紧张素Ⅱ诱导HUVECs的BMP2、BMP4表达增加,氯沙坦减轻了由血管紧张素Ⅱ刺激的BMP2、BMP4表达增加,而且随时间的延长,血管紧张素Ⅱ刺激HUVECs在45 min左右其ERK1/2磷酸化达到最大,随后开始下降,此外U0126可以抑制ERK1/2的磷酸化,以上结果表明可能是通过抑制ERK1/2通路的激活减轻血管钙化。
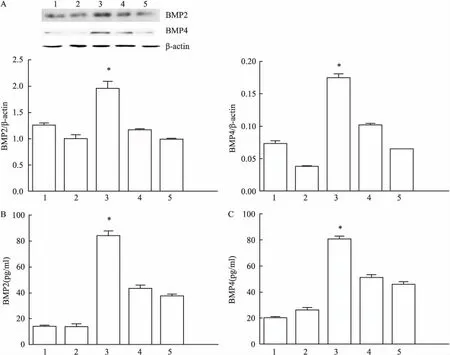
图1 Western blot检测不同浓度梯度血管紧张素Ⅱ对内皮细胞BMP2和BMP4蛋白表达的影响
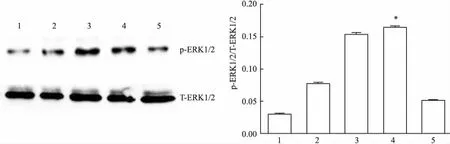
图2 Western blot检测ERK1/2通路磷酸化水平
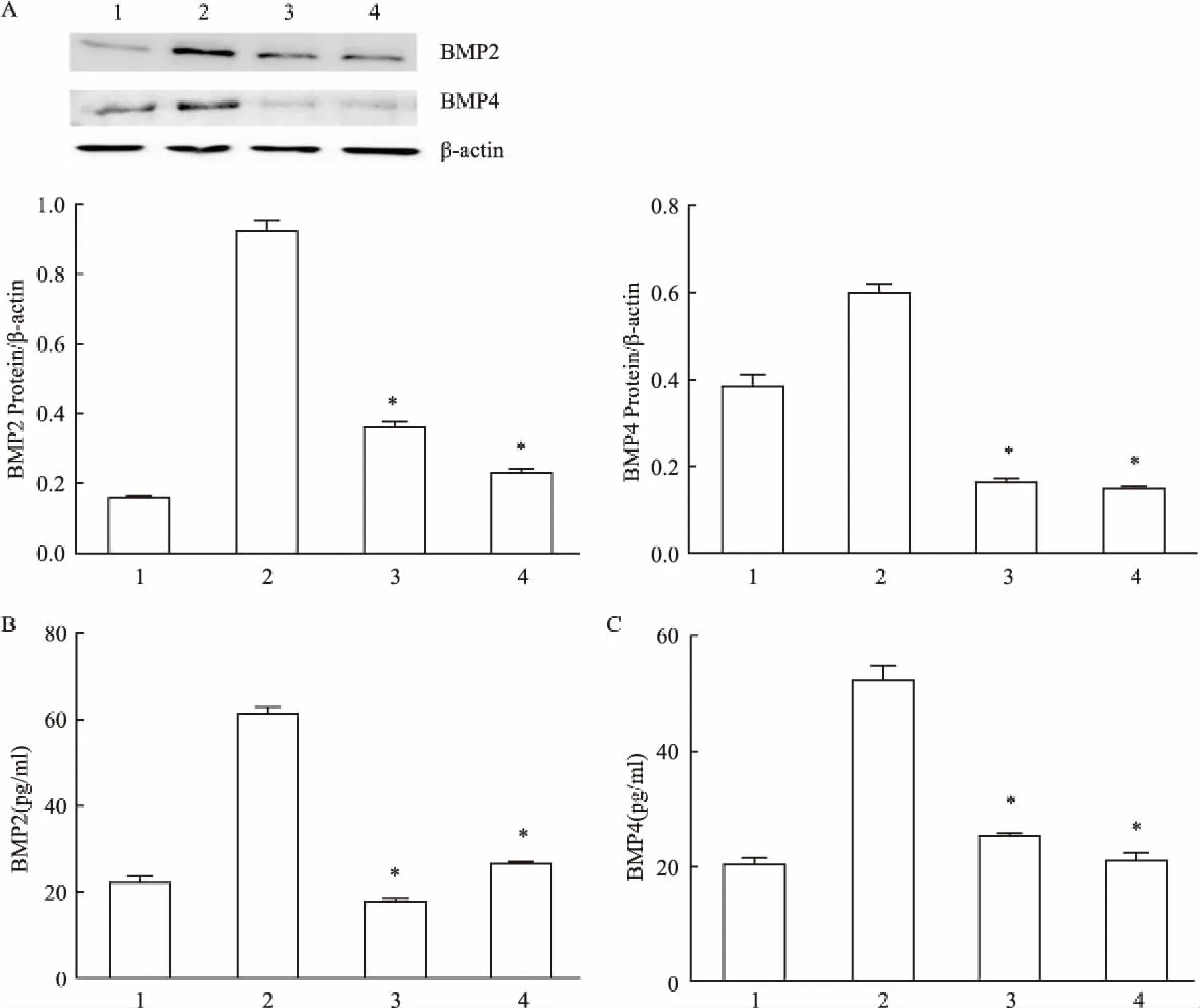
图3 Western blot检测血管紧张素Ⅱ对钙化因子BMP2、BMP4的表达水平影响
血管紧张素Ⅱ通过各种途径引起动脉粥样硬化,比如内皮功能障碍、细胞增殖和炎症[16]。而氯沙坦通过降压、抗炎的影响中和了血管紧张素Ⅱ的作用。氯沙坦通过抑制内皮细胞的钙化可以减轻血管钙化。有研究[17-18]表明血管紧张素Ⅱ显著提高了ERK的磷酸化水平,且血管钙化的进展可能涉及ERK1/2通路的激活[19],所以该研究选择探索ERK1/2通路可能参与了血管紧张素Ⅱ促进内皮细胞钙化的过程。氯沙坦通过下调ERK1/2的磷酸化水平降低血管紧张素诱导的内皮细胞钙化。本研究进一步发现U0126抑制ERK1/2可以下调成骨细胞标志物,下调BMP2、BMP4成骨型标志蛋白。这些证据表明ERK1/2通路可能参与血管紧张素Ⅱ促进钙化的过程。本研究还有一些不足,在体外血管紧张素Ⅱ诱导内皮细胞钙化模型不能完全模仿体内钙化的条件。
本研究表明,在体外实验中血管紧张素Ⅱ可以加剧血管钙化。氯沙坦可以减轻血管紧张素Ⅱ促进钙化的进程,U0126可以下调ERK1/2通路的磷酸化,并且减轻内皮细胞的钙化。这些研究结果提示氯沙坦可以作为血管钙化治疗的一个新靶点。
参考文献
[1] Sage A P, Tintut Y, Demer L L. Regulatory mechanisms in vascular calcification[J]. Nat Rev Cardiol,2010,7,9,528-36.
[2] Rennenberg R J, Kessels A G, Schurgers L J, et al. Vascular calcifications as a marker of increased cardiovascular risk: a meta-analysis[J]. Vasc Health Risk Manag, 2009,5(1):185-97.
[3] Anand D V, Lim E, Darko D, et al. Determinants of progression of coronary artery calcification in type 2 diabetes role of glycemic control and inflammatory/vascular calcification markers[J]. J Am Coll Cardiol,2007,50(23):2218-25.
[4] Johnson R C, Leopold J A, Loscalzo J. Vascular calcification: pathobiological mechanisms and clinical implications[J]. Circ Res, 2006,99(10):1044-59.
[5] Hruska K A, Mathew S, Saab G. Bone morphogenetic proteins in vascular calcification[J]. Circ Res,2005, 97,(2):105-14.
[6] Kranzhofer R, Schmidt J, Pfeiffer C A, et al. Angiotensin induces inflammatory activation of human vascular smooth muscle cells[J]. Arterioscler Thromb Vasc Biol, 1999,19(7):1623-9.
[7] Morawietz H, Erbs S, Holtz J, et al. Endothelial protection, AT1 blockade and cholesterol-dependent oxidative stress: the EPAS trial[J]. Circulation ,2006, 114(1 Suppl):I296-301.
[8] Savoia C, Burger D, Nishigaki N, et al. Angiotensin Ⅱ and the vascular phenotype in hypertension[J]. Expert Rev Mol Med, 2011,13:e11.
[9] Li X, Giachelli C M. Sodium-dependent phosphate cotransporters and vascular calcification[J]. Curr Opin Nephrol Hypertens,2007,16(4):325-8.
[10] Li X, Yang H Y, Giachelli C M. BMP-2 promotes phosphate uptake, phenotypic modulation, and calcification of human vascular smooth muscle cells[J]. Atherosclerosis ,2008,199(2):271-7.
[11] Scatena M, Liaw L, Giachelli C M. Osteopontin: a multifunctional molecule regulating chronic inflammation and vascular disease[J]. Arterioscler Thromb Vasc Biol,2007,27 (11):2302-9.
[12] Osako M K, Nakagami H, Shimamura M, et al. Cross-talk of receptor activator of nuclear factor-kappaB ligand signaling with renin-angiotensin system in vascular calcification[J]. Arterioscler Thromb Vasc Biol,2013,33(6):1287-96.
[13] Shammas R M, Ranganath V K, Paulus H E. Remission in rheumatoid arthritis[J]. Curr Rheumatol Rep, 2010,12(5):355-62.
[14] He Y, Yao G, Savoia C, et al. Transient receptor potential melastatin 7 ion channels regulate magnesium homeostasis in vascular smooth muscle cells: role of angiotensin Ⅱ[J]. Circ Res, 2005,96(2):207-15.
[15] Montezano A C, Nguyen Dinh Cat A, Rios F J, et al. Angiotensin Ⅱ and vascular injury[J]. Curr Hypertens Rep,2014,16(6):431.
[16] Ferrario C M, Strawn W B. Role of the renin-angiotensin-aldosterone system and proinflammatory mediators in cardiovascular disease[J]. Am J Cardiol, 2006,98(1):121-8.
[17] Zhang Y, Naggar J C, Welzig C M, et al. Simvastatin inhibits angiotensin Ⅱ-induced abdominal aortic aneurysm formation in apolipoprotein E-knockout mice: possible role of ERK[J]. Arterioscler Thromb Vasc Biol,2009,29(11):1764-71.
[18] Bruder-Nascimento T, Chinnasamy P, Riascos-Bernal D F, et al. Angiotensin Ⅱ induces Fat1 expression/activation and vascular smooth muscle cell migration via Nox1-dependent reactive oxygen species generation[J]. J Mol Cell Cardiol,2014,66:18-26.
[19] Huang J, Huang H, Wu M, et al. Connective tissue growth factor induces osteogenic differentiation of vascular smooth muscle cells through ERK signaling[J]. Int J Mol Med, 2013,32(2):423-9.
