术后早期肠内营养对腹腔镜直肠癌根治术围术期免疫功能的影响
2018-05-19黄贞强曾剑锋林海鹏周志平
黄贞强,曾剑锋,林海鹏,周志平
直肠癌是消化系统最常见的恶性肿瘤之一,其具有发病率高,患者年龄轻等特点。目前主要治疗手段为手术切除[1]。大量研究表明[2-3],直肠癌手术治疗可明显抑制患者的细胞免疫功能。随着微创技术的发展,腹腔镜直肠癌根治术由于其具有创伤小,术后恢复快等特点逐步取代传统开腹技术成为直肠癌手术治疗的首选方法。但大量研究表明[4-5],腹腔镜下直肠癌手术患者的免疫功能仍然受到较强的抑制。其主要原因为患者术前存在营养不良,术后负氮平衡状态,常导致免疫功能受损。术后积极的营养支持已成为直肠癌治疗方案中相的重要环节。本文旨在探讨早期肠内营养对腹腔镜直肠癌患者围术期免疫功能的影响,现报道如下。
1 资料与方法
1.1 临床资料 收集2015年12月~2017年12月在本院行腹腔镜直肠癌根治术的直肠癌患者60例,按照随机数字表发将其分为肠内营养组(EN组)和肠外营养组(PN组),每组各30例。病例入选标准:①40岁≤年龄≤75岁;②肝肾功能正常;③肿瘤无远端脏器转移;④术前未经过放化疗。病例排除标准:①存在明显肠梗阻症状;②心肺等脏器功能严重不全者;③合并严重疾病如糖尿病、心脏病等;④有严重精神疾患者;⑤术中肿瘤侵犯其他器官无法根治切除;⑥远处转移或侵犯周围器官;所有患者术前均行肠镜检查并取病理明确诊断。所有患者术前均签署研究相关的知情同意书。两组患者临床资料比较差异无统计学意义,见表1。

表1 2组患者一般情况比较(x±s)Table 1 Comparison of generalcondition of two groups(x±s)
1.2 研究方法
1.2.1 手术过程 两组患者术前均口服复方聚乙二醇电解质溶液行肠道准备,并禁食8 h,禁饮4 h,术前在病房放置鼻肠营养管:患者取卧位,于胃管前段用石蜡油涂抹润滑约20 cm左右,置入距门齿55~60 cm并固定。所有患者均行腹腔镜下结肠癌根治术并行一期吻合术。术前30 min和术后48 h内给予静脉滴注抗生素。
1.2.2 营养支持方法 两组患者均给予营养支持7 d。
EN组:术后8 h注入等渗温盐水250 ml,并于第1天通过输液泵以50 ml/h泵入短肽型肠内营养液;若患者无不适可提速至100~120 ml/h。术后第2天输注500 ml/d,术后第3天根据患者胃肠道的耐受状况输注1 000 ml,术后4~7 d增加至2 000 ml。待患者可自由进食逐渐减少输注量,以保证热量不低于25 kJ/(kg·d)为准。如有不足,行静脉补充。
PN组:经深静脉置管或PICC给予肠外营养支持,总液体量为 50 ml/(kg·d),总热量按非蛋白质以 25 KJ/(kg·d)供给。氮由复方氨基酸提供。非蛋白质热量30%~40%由结构脂肪乳剂提供,60%~70%由葡萄糖供给。
1.3 观察指标 术后T1~T4早晨抽空腹静脉血检测:①体液免疫:采用速率散射比浊法测定血清免疫球蛋白IgG、IgA、IgM。②T细胞亚群(CD4+/CD8+):采用流式细胞仪测定CD4+/CD8+的变化。
1.4 统计学方法 采用SPSS 19.0统计软件行统计分析,计数资料以例数表示,采用χ2检验;计量资料采用“x±s”表示,采用t检验;P<0.05为差异有统计学意义。
2 结果
2.1 与T1相比,T2时两组患者IgG、IgA、IgM及CD4+/CD8+明显降低(P<0.05),T3时IgG、IgA及CD4+/CD8+明显降低(P<0.05)。与PN组相比,EN组T3~T4时IgG、IgA及CD4+/CD8+明显升高(P<0.05),见表2。
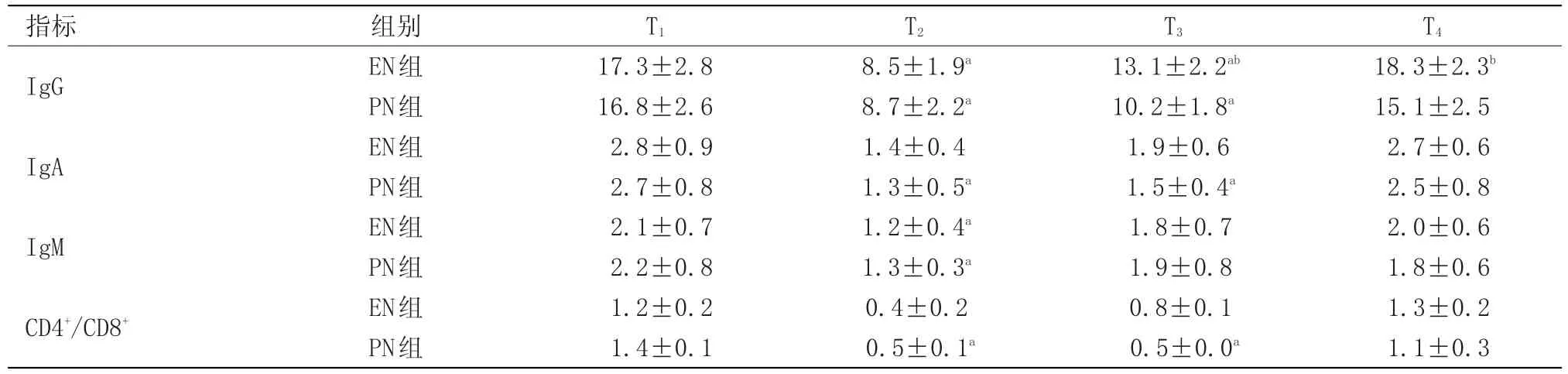
表2 两组患者不同时点T细胞亚群及NK细胞水平的比较(x±s)Table 2 Comparison of the level of T and NK cellin differentpointin two groups(x±s)
3 讨论
结肠癌是消化系统最常见的肿瘤之一,目前治疗主要以手术切除为主[6]。而细胞免疫在机体抗肿瘤免疫中起关键作用,肿瘤患者免疫功能较正常人为低,极易造成术后感染及远期的肿瘤的转移,严重的可导致多器官功能衰竭[7]。虽然腹腔镜结肠癌根治术逐渐成为结肠肿瘤根治术的首选手术方式,其减少了患者的手术时间,减少了术中的出血量。本研究中,腹腔镜结肠癌根治术后第1天IgG、IgA、IgM、CD4+/CD8+均明显降低,表明腹腔镜手术并不能完全消除手术对患者免疫功能的影响。究其原因,主要为结肠癌患者一般都存在消化功能异常其本身就存在不同程度的代谢紊乱和能量消耗,往往继发营养不良和免疫功能低下[8]。除此之外,术前禁食、手术创伤导致的高代谢分解,肠道手术患者营养不良的发生率较高,影响患者预后。大量研究表明[9],围术期营养治疗可为机体提供充分的营养底物,降低机体的分解代谢,预防营养不良;降低机体的炎症反应,保护肠黏膜的屏障功能,从而起到预防肠源性感染的作用[10]。因而,营养支持在肠道患者恢复过程中其重要作用。
肠外营养属传统的营养支持方法,但长期肠外营养使肠道缺乏食物的刺激,导致蠕动减少,肠黏膜萎缩,肠道菌群失调,肠屏障功能退化,肠源性感染的风险增加[11];加之其供给需要行深静脉置管,在穿刺及输注的整个过程中都存在感染的风险[11]。而肠内营养不仅提供了代谢所需能量,同时也可调节机体的免疫器官,减轻炎性反应,保护肠道黏膜的结构与功能,从而起到保护其他组织器官的功能的作用,最终促进患者康复[11-12]。本研究结果显示,肠内营养组术后第3天,IgG、IgA、CD4+/CD8+明显高于场外营养组,表明术后早期肠内营养可促进患者免疫功能早期恢复。而两组患者IgM术后第3天并没有明显区别,可能与IgM在患者体内浓度较稳定,对刺激变化较迟缓有关。
综上所述,腹腔镜结肠癌根治术早期肠内营养可促进患者术后的早期免疫功能的恢复,有利于患者的早期康复,值得在临床工作中推广使用。
参考文献
[1] Blatner NR,Mulcahy MF,Dennis KL,et al.Expression of RORγt marks a pathogenic regulatory T cell subset in human colon cancer[J].Sci Transl Med,2012,4(164):164ra159.
[2] Stec M,Baran J,Szatanek R,et al.Properties of monocytes generated from haematopoietic CD34(+)stem cells from bone marrow of colon cancer patients[J].Cancer Immunol Immunother,2013,62(4):705-713.
[3] Berry J,Vreeland T,Trappey A,et al.Cancer vaccines in colon and rectal cancer over the last decade:lessons learned and future directions[J].Expert Rev Clin Immunol,2017,13(3):235-245.
[4] Nizri E,Greenman-Maaravi N,Bar-David S,et al.Analysis of histological and immunological parameters of metastatic lymph nodes from colon cancer patients reveals that T-helper 1 type immune response is associated with improved overall survival[J].Medicine(Baltimore),2016,95(45):e5340.
[5] Sanz-Pamplona R,Gil-Hoyos R,López-Doriga A,et al. Mutanome and expression of immune response genes in microsatellite stable colon cancer[J].Oncotarget,2016,7(14):17711-17725.
[6] Shebzukhov YV,Lavrik IN,Karbach J,et al.Human tankyrases are aberrantly expressed in colon tumors and contain multiple epitopes that induce humoral and cellular immune responses in cancer patients[J].Cancer Immunol Immunother,2008,57(6):871-881.
[7] Waldner M,Schimanski CC,Neurath MF.Colon cancer and the immune system:the role of tumor invading T cells[J].World J Gastroenterol,2006,12(45):7233-7238.
[8] Bae SU,Jeong WK,Baek SK.Robotic Anterior Resection for Sigmoid Colon Cancer Using Reduced Port Access[J].Dis Colon Rectum,2016,59(3):245-246.
[9] Maccalli C,Di CV,Fodale V,et al.Induction of both CD8+and CD4+T-cell-mediated responses in colorectal cancer patients by colon antigen-1[J].Clin Cancer Res,2008,14(22):7292-303.
[10]Qiao G,Qin J,Kunda N,et al.LIGHT Elevation Enhances Immune Eradication of Colon Cancer Metastases[J].Cancer Res,2017,77(8):1880-1891.
[11]Okamoto K,Fukatsu K,Hashiguchi Y,et al.Lack of preoperative enteral nutrition reduces gut-associated lymphoid cell numbers in colon cancer patients:a possible mechanism underlying increased postoperative infectious complications during parenteral nutrition[J].Ann Surg,2013,258(6):1059-1064.
[12]Kawamura YJ,Kuwahara Y,Mizokami K,et al.Patient's appetite is a good indicator for postoperative feeding:a proposal for individualized postoperative feeding after surgery for colon cancer[J].Int J Colorectal Dis,2010,25(2):239-243.
