溃疡性结肠炎患者肠道菌群的变化及其与IL-23/IL-17轴的关系*
2018-05-17马旭园代志峰王慧超杨静楠唐向阳康玉华丁春生李玉霞杨瑞林林旭红
马旭园, 代志峰, 王慧超, 杨静楠, 唐向阳, 康玉华, 丁春生, 李玉霞, 杨瑞林, 林旭红△
(河南大学 1淮河医院消化内科, 2淮河医院检验科, 转化医学中心, 3第一附属医院肾内科, 河南 开封 475000)
溃疡性结肠炎(ulcerate colitis,UC)的病因及发病机制至今仍未完全阐明,目前普遍认为主要由环境因素、遗传易感因素、肠道屏障功能障碍和免疫功能异常等多种因素相互作用所致,其中,慢性炎症反应和免疫应答紊乱是造成UC的关键病理环节,而肠道内菌群紊乱又是造成炎症反应和免疫应答改变的重要因素,成为影响UC病变的重要因素。
生理情况下,肠道菌群保持相对稳态,与宿主相互作用,在吸收营养、抵抗病原体入侵及促进维持正常免疫功能中发挥重要作用。细菌在宿主早期免疫-炎症反应系统成熟中发挥重要作用,与宿主建立有效的“交互对话”,因此细菌是早期最主要的导致慢性炎性紊乱如UC的环境因素。近年来,越来越多的研究认识到,肠道菌群失调与UC的发生密切相关[1-2],总体来讲,炎症性肠病(inflammatory bowel disease,IBD)患者肠道菌群特征性组成变化包括黏膜总菌变化,多样性降低,伴随疾病进展早期菌群组成改变[3],如具有争议的侵袭性细菌(变形菌、梭杆菌和活泼瘤胃球菌)种类的增加,伴随保护性菌(毛螺旋菌、双歧杆菌、罗斯氏菌和萨特氏菌属)数量下降[4]。且多数研究者都支持活动期UC患者与健康对照者的肠道菌群存在差异,而缓解期UC患者与健康者的肠道菌群无差异这一观点。因此,肠道菌群是控制UC进一步发展的一个靶点。
目前,关于UC患者肠道菌群的研究因选择的疾病病程不同、分期不同、治疗与否而分析方法各异,再加上肠道菌群具有的复杂性,其完整的结构与功能未能被完全了解,导致关于UC患者肠道需氧菌和常见厌氧菌的变化尚无统一认识,其在宿主疾病发生中所起到的具体作用也尚未能完全阐明,且这些菌群的变化与患者肠黏膜病理改变的关系还不明确。目前国内外相关文献报道主要侧重于某一类肠道菌群与UC的关系,并没有全面进行肠道内常见菌群与UC相关性对比,因此,肠道菌群与UC的相关性研究仍面临巨大挑战。
本研究在前期工作的基础上,采用涂片镜检、细菌培养、real-time PCR和免疫组化等方法分别对活动期UC患者及正常健康人群粪便菌群进行差异分析,并将白细胞介素23 (interleukin-23,IL-23)/IL-17与组织病理学和目标菌群进行相关性分析,旨在研究UC进展过程中肠道主要菌群变化及其与IL-23/IL-17的关系,以期寻找UC相关的特异微生物种类或持续变化模式,对精确诊断提供指导意义,为临床应用抗生素及益生菌治疗 UC 提供理论依据。
材 料 和 方 法
1 UC患者收集及临床信息采集
根据2012年中华医学会消化病学分会炎症性肠病学组制定的《炎症性肠病诊断与治疗的共识意见》修订的标准,收集我院2016年8月~2017年6月UC患者(同时行肠镜检查及病理活检,病历资料完整)20例进行研究,其中,男13例,女7例,均为活动性复发UC患者(曾接受氨基水杨酸类药物治疗),留取标本前4周内均未应用抗生素和微生态制剂等可能影响肠道菌群的药物。核心临床标准:入围患者入院后行血液学检测及结肠镜检查。排除标准为临床资料不完整;伴有严重心、肝、肺、肾疾病患者;合并严重感染、糖尿病患者;合并UC并发症患者;妊娠及哺乳期患者;合并肠外表现的患者;患有其他自身免疫性疾病患者。有以上任意一条均不纳入本研究。同时收集20例本院体检中心体检健康者作为对照,男15例,女5例,无消化道慢性疾病史,常规体检和粪常规检查均未见异常。
2 实验方法
2.1直接涂片镜检和菌群分析 取新鲜粪便标本,2 h内直接常规涂片(面积约1.5 cm±2.0 cm,厚度如血膜的菌膜),干燥固定后革兰染色,油镜下观察10个视野,根据每个油镜视野细菌总数和各类细菌比例,判断是否存在菌群失调及菌群失调程度,判断和分级标准参照《肠道菌群粪便涂片检查图谱》[5]。
2.2细菌培养鉴定 用10 μL接种环挑取新鲜粪便标本,采用4区划线法进行接种。(1)需氧培养:接种血平板和中国蓝平板,在5% CO2、37 ℃有氧环境中孵育24 h,使用全自动细菌鉴定仪对平板上生长的优势菌进行菌种鉴定;(2)厌氧培养:接种厌氧血平板,在37 ℃无氧环境中(厌氧气体发生袋,日本三菱 MGC AnaeroPack-3.5L)孵育48 h,挑取优势菌做耐氧实验,专性厌氧菌用API20A厌氧菌鉴定卡鉴定;(3)选择性培养基:同时接种大肠杆菌(Escherichiacoli,E.coli)、肠球菌(Enterococcus)、拟杆菌(Bacteroidetes)、乳酸杆菌(Lactobacilli)和双歧杆菌(Bifidobacteriumbifidum,B.bifidum)选择性培养基培养。
2.3细菌real-time PCR荧光定量分析 将涂片及培
养剩余的粪便标本置于-80 ℃保存,采用粪便DNA组提取试剂盒(TIANGEN,DP328-02)抽提粪便总DNA,具体方法按试剂盒说明书操作。提取的DNA测定浓度后保存于-20 ℃。应用Real-Time PCR试剂盒(TaKaRa,RR820A),将粪便DNA进行扩增,扩增的细菌包括大肠杆菌、肠球菌、拟杆菌、双歧杆菌和乳酸杆菌,每个标本做复孔检测。引物设计用Primer Premier 5.0软件。各细菌引物具体见表1。

表1 Real-time PCR所用特异性引物
F: forward; R: reverse.
2.4血红蛋白(hemoglobin)、白蛋白(albumin)、血沉(erythrocyte sedimentation rate,ESR)和C反应蛋白(C-reactive protein,CRP)的测定 取患者空腹血标本,常规测定血红蛋白、白蛋白、血沉和C反应蛋白水平。
2.5疾病临床Mayo评分、Baron分级及结肠组织病理学分析 记录患者一般情况、体重、大便量和性状及精神状态等,经结肠镜活检取UC患者和健康体检者肠黏膜组织。按照Mayo评分方法[6],对疾病活动度评分,具体评分标准见表2,其中,总分<2分为症状缓解,3~5分为轻度活动期,6~10分为中度活动期,11~12分为重度活动期。内镜下活动度分级参照改良的Baron分级[7],见表3。肠黏膜组织常规石蜡切片进行HE染色,光镜下观察肠黏膜组织溃疡形成、炎细胞浸润、充血和水肿等情况,并参照Siegmund等[8]评分方法进行组织病理学评分,见表4。每个组织标本选5张切片,每个切片随机选择4个视野。

表2 Mayo评分系统

表3 Baron分级评分标准

表4 组织学评分标准
2.6免疫组织化学法检测结肠组织中IL-17和IL-23的表达 切片脱蜡至水化,3% H2O2阻断内源性过氧化物酶,微波修复抗原后,分别与IL-17和IL-23的 I 抗(Abcam,ab79056,ab45420)4 ℃孵育过夜,滴加 II 抗及辣根过氧化物酶标记链霉卵白素工作液,DAB(博士德,AR1022)显色,棕褐色反应产物代表抗原定位。各蛋白表达的半定量用Image-Pro Plus软件分析。
2.7Western blot法检测结肠组织中IL-17和IL-23的表达 制备结肠组织样品,用BCA蛋白定量试剂盒(碧云天,P0011-2)测定蛋白质浓度;配制合适浓度的分离胶和5%的浓缩胶进行SDS-PAGE,恒流150 mA转膜55 min,5%牛奶(TBST配制)室温封闭1.5 h,加 I 抗(Abcam,ab79056,ab45420)杂交,4 ℃ 孵育过夜,TBST洗膜,加入酶标 II 抗(Thermo,31460),室温孵育1 h,TBST洗膜,ECL发光液(康为世纪,CW0049M)曝片,Bio-Rad凝胶成像系统拍照,并根据Marker位置及蛋白分子量比对结果。内参照用β-actin。使用软件ImageJ分析蛋白条带灰度值,目的蛋白的相对表达量用目的条带灰度值与β-actin条带灰度值的比值表示。
3 统计学处理
应用SPSS 11.5软件对资料进行统计分析。计量资料以均数±标准误(mean±SEM)表示,组间比较采用t检验;计数资料采用2检验;肠黏膜组织IL-17和IL-23表达的平均吸光度与Baron分级相关性采用Spearman相关分析,平均吸光度与病理组织学评分相关性采用Pearson相关分析,平均吸光度与肠球菌、拟杆菌、双歧杆菌和乳酸杆菌荧光定量的相关性分析采用Pearson相关分析。以P<0.05 为差异有统计学意义。
结 果
1 直接涂片镜检和菌群分析
如图1A所示,与对照组相比,活动期UC患者球菌数量明显增多,杆菌数量明显减少,且菌群失调程度明显升高;II度和III度失调的比例分别从对照组的10%和0%,升高至UC组的30%和25%,2组间差异均具有统计学意义(P<0.05),见图1B。
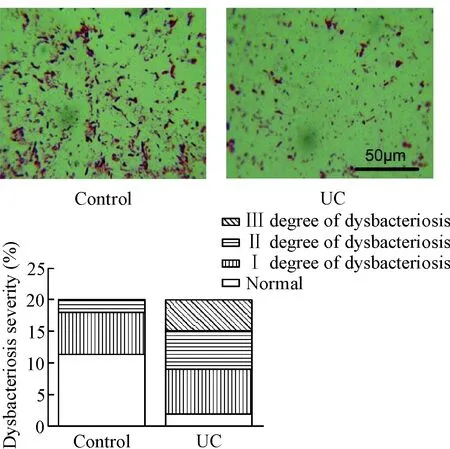
Figure 1. Results of direct smear and flora analysis for stool. A: the original image of the fecal smears (×1 000); B: comparison of flora analysis.
图1粪便直接涂片镜检和菌群分析结果
2 细菌培养鉴定
需氧培养结果表明,活动期UC患者的需氧菌总数和单菌量均有明显改变,其中大肠杆菌菌数较正常人显著降低,肠球菌菌数明显增加(P<0.01),见图2A;厌氧培养鉴定结果发现,厌氧菌总数减少,其中拟杆菌、双歧杆菌和乳酸杆菌菌数较正常人显著减少(P<0.01),见图2B。以上结果经选择性培养基进行确认,发现大肠杆菌在选择性显色培养基呈圆形、微凸、光滑、边缘整齐,呈绿色光泽,UC患者的数量明显降低;在PFIZER选择性肠球菌琼脂培养基上孵育48 h后,肠球菌形成圆形、扁平、表面凹陷、边缘整齐的灰色菌落;拟杆菌在BDS培养基上孵育后,形成圆形、微凸、光滑、边缘整齐、半透明、灰白色,不溶血的菌落;双歧杆菌在专用琼脂培养基孵育后,形成圆形、光滑、边缘整齐、不透明、大部分显白色的大小两种菌落;乳酸杆菌在选择性培养基孵育后,形成圆形、光滑、边缘整齐,半透明、灰白色的菌落。UC患者的肠球菌、双歧杆菌和乳酸杆菌数量明显降低。
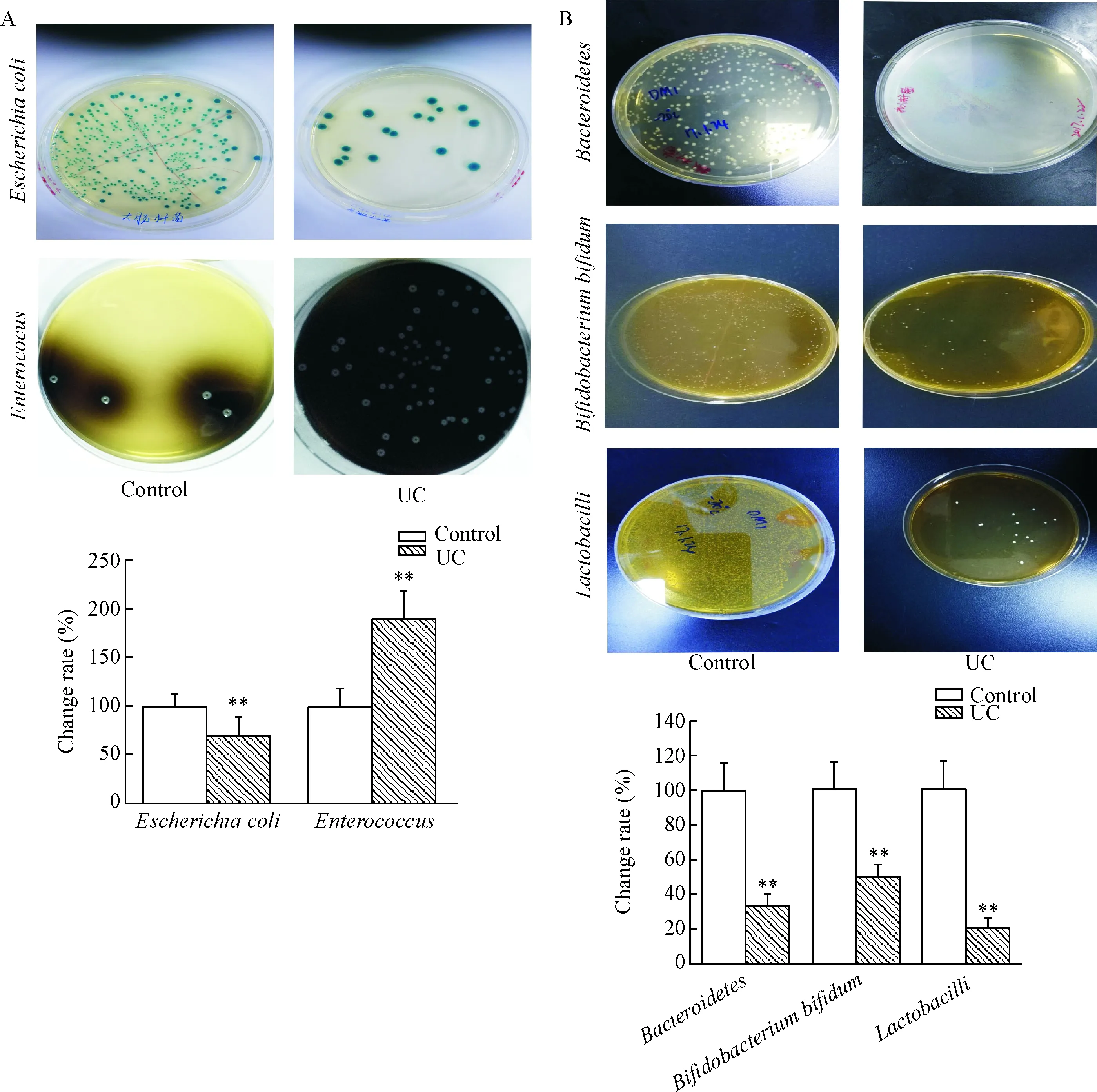
Figure 2. The analytic results of fecal bacterial cultures. A: selective cultures and the change rates ofEscherichiacoliandEnterococcus; B: selective cultures and the change rates ofBacteroidetes,BifidobacteriumbifidumandLactobacilli. Mean±SEM.n=20.**P<0.01vscontrol group.
图2粪便细菌培养结果分析
3 细菌real-time PCR荧光定量分析
目标菌属定量分析表明,UC患者粪便中大肠杆菌相对定量较正常人显著降低,肠球菌菌数明显升高,拟杆菌、双歧杆菌和乳酸杆菌菌数较正常人显著减少(P<0.01),见图3。
4 血红蛋白、白蛋白、血沉和C反应蛋白水平
UC患者血红蛋白较对照组无明显改变,白蛋白较正常人明显降低(P<0.05),血沉和C反应蛋白明显增高(P<0.01),见表5。

Figure 3. Quantitative analysis of fecal bacteria by real-time PCR. Mean±SEM.n=20.**P<0.01vscontrol group.
图3细菌real-timePCR荧光定量分析
5 疾病临床活动度及组织病理积分
与正常组相比,UC患者Mayo评分明显增高(P<0.01),Baron分级明显增加(P<0.01),见图4A、B。HE染色结果表明,正常组结肠黏膜上皮细胞完整,腺体排列整齐紧密,富含杯状细胞,固有层仅见少量散在的中性粒细胞及淋巴细胞,毛细血管无充血、扩张;UC组结肠黏膜糜烂,肠黏膜受损,上皮细胞大量破坏,腺体破坏,排列紊乱,陷窝结构破坏,杯状细胞大量消失,固有层、肌层均可见大量中性粒细胞及淋巴细胞浸润,毛细血管充血、扩张,隐窝脓肿形成,并见多发溃疡,甚者表面有脓苔,组织学评分明显高于正常组(P<0.01),见图4C。

表5 各组常规指标的比较
ESR: erythrocyte sedimentation rate;*P<0.05,**P<0.01vscontrol group

Figure 4. Mayo scoring (A), Baron grading (B) and HE staining (C) results. Mean±SEM.n=20.**P<0.01vscontrol group.
图4Mayo评分、Baron分级及组织病理学结果
6 结肠组织中IL-17和IL-23的表达
免疫组化结果显示,正常结肠黏膜组织IL-17和IL-23表达微弱,而病变结肠组织表达丰富的IL-17和IL-23,阳性表达主要位于黏膜上皮细胞和固有层单个核细胞,为胞浆染色,颗粒呈棕黄色,且固有层内可见强阳性棕褐色颗粒聚集,平均吸光度均明显升高(P<0.01),见图5。Western Blot结果表明,IL-17和IL-23蛋白表达水平较对照组均有明显升高(P<0.01),见图6。
7 IL-17和IL-23表达与Baron分级及病理组织学积分的相关性
如表6所示,将IL-7和IL-23平均吸光度与Baron分级进行Spearman相关分析,结果显示,UC患者结肠黏膜组织中IL-17和IL-23表达的平均吸光度与Baron分级的相关系数分别为0.717(P=0.02)和0.849(P=0.016),表明二者与内镜下活动度分级呈正相关。另外,Pearson相关分析表明,UC患者结肠黏膜组织中IL-17和IL-23表达的平均吸光度与病理组织学评分的相关系数分别为0.660(P=0.030)和0.675(P=0.032),提示二者与病理组织学评分亦呈正相关。
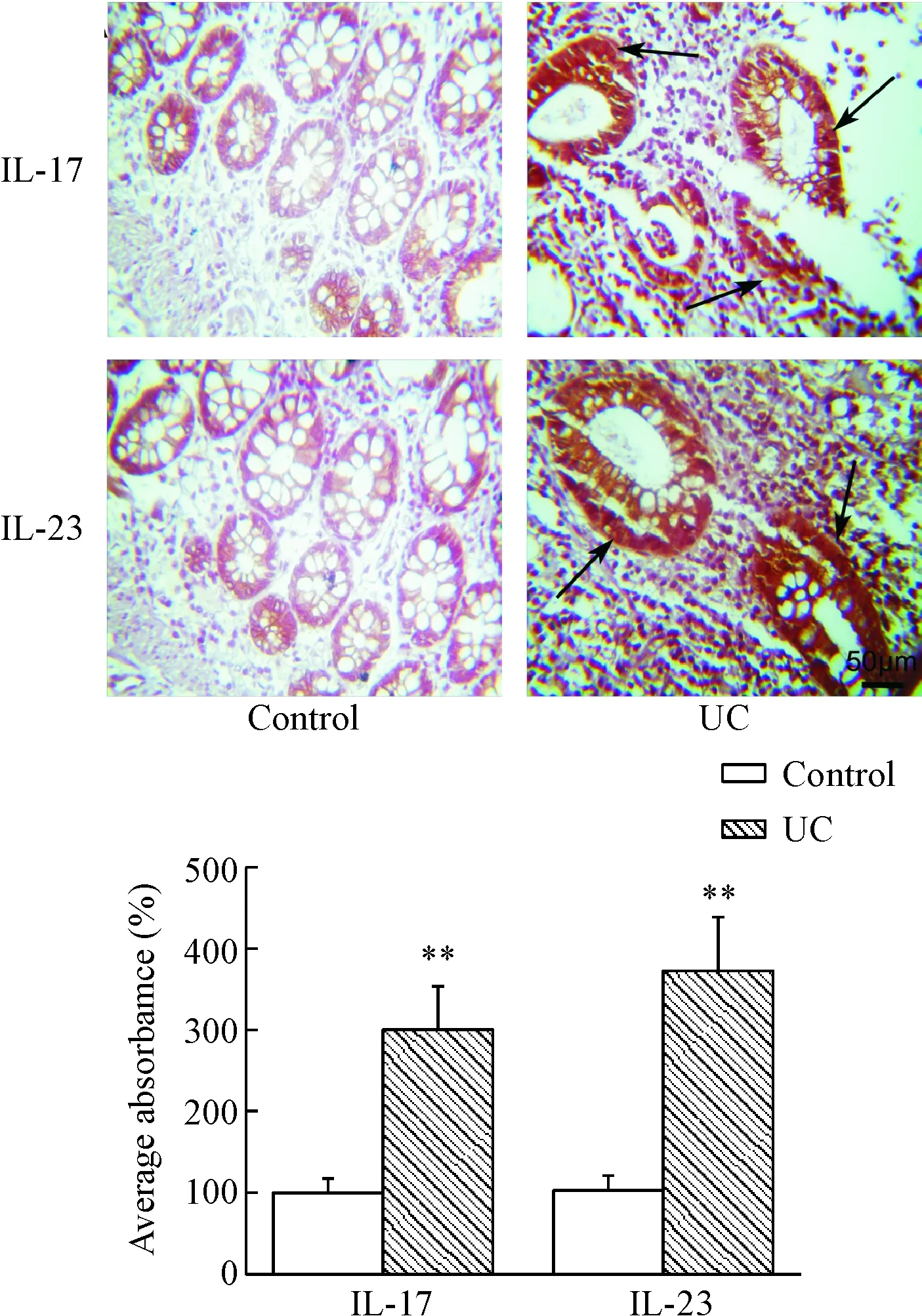
Figure 5. The protein levels of IL-17 and IL-23 in the colon detected by immunohistochemical staining(×400). Mean±SEM.n=20.**P<0.01vscontrol group.
图5免疫组化检测结肠组织IL-17和IL-23蛋白的表达水平及定位
8 IL-17和IL-23表达与大肠杆菌、肠球菌、拟杆菌、双歧杆菌和乳酸杆菌荧光定量的相关性分析
Pearson相关分析表明,IL-23表达的平均吸光度与大肠杆菌数量呈负相关(r=-0.699,P=0.025),与肠球菌数量呈正相关(r=0.872,P=0.010),IL-17表达的平均吸光度与肠球菌数量呈正相关(r=0.764,P=0.046),但二者与其他目标菌属的数量无明显相关性,见表7。
讨 论
体内的肠道菌群构成了一个极其复杂的肠道内微生态系统,在宿主的肠道免疫系统、营养物质的合成与吸收、抑制致病菌等众多方面均发挥着重要作用[9-10]。
有研究认为,肠黏膜屏障功能障碍可能是UC发病的触发扳机[11],肠道菌群紊乱与异常免疫反应介导之间的相互作用可能是导致肠粘膜功能障碍,参与 UC 发病的始动因素[12]。将一些基因敲除或基因缺陷小鼠置于无菌环境中不会发生UC,置于正常肠道菌群中或予某些肠道菌群(如肠球菌)灌肠后可诱发UC[13],证明了“无菌无炎症”的观点,提示肠道菌群成分是肠炎发病不可或缺的因素之一。现已发现,多种细菌和病毒等病原体参与炎症性肠病发病。Gradel 等[14]发现感染弯曲杆菌或沙门氏菌的患者易患IBD;Li等[1]观察了16例健康人和41例UC患者粪菌,发现正常人粪便微生物多样性明显高于UC患者,与正常人、静止期和轻度活动期相比,中、重度活动期患者粪菌中的主要类型明显改变,且主要细菌的比例与疾病活动呈负相关,UC患者产气荚膜梭菌数量增加,屎肠杆菌、直肠杆菌数量减少;Rajili-Stojanovi等[15]应用高重复率系统发育微阵列技术检测15例UC患者和15例健康对照者粪菌,认为UC患者粪菌组成明显不同于健康对照,UC缓解期相关微生物相对稳定,且在所有患者相似,在活动期,菌群失调的主要标志物有:梭菌属IV簇细菌多样性明显降低,参与丁酸和丙酸代谢的细菌包括瘤胃球菌属、直肠真杆菌、罗氏菌属、阿克曼氏菌丰度降低,而条件致病菌梭菌属、消化链球菌属、螺杆菌、弯曲杆菌、艰难梭菌丰度升高。另有研究发现,幽门螺杆菌感染与IBD发病呈负相关,幽门螺杆菌通过多种机制使宿主受益,从而起到保护宿主免受IBD袭击[16]。因此,基于不同的分析方法,对于活动期UC患者肠道菌群组成,历来的研究结果千差万别。
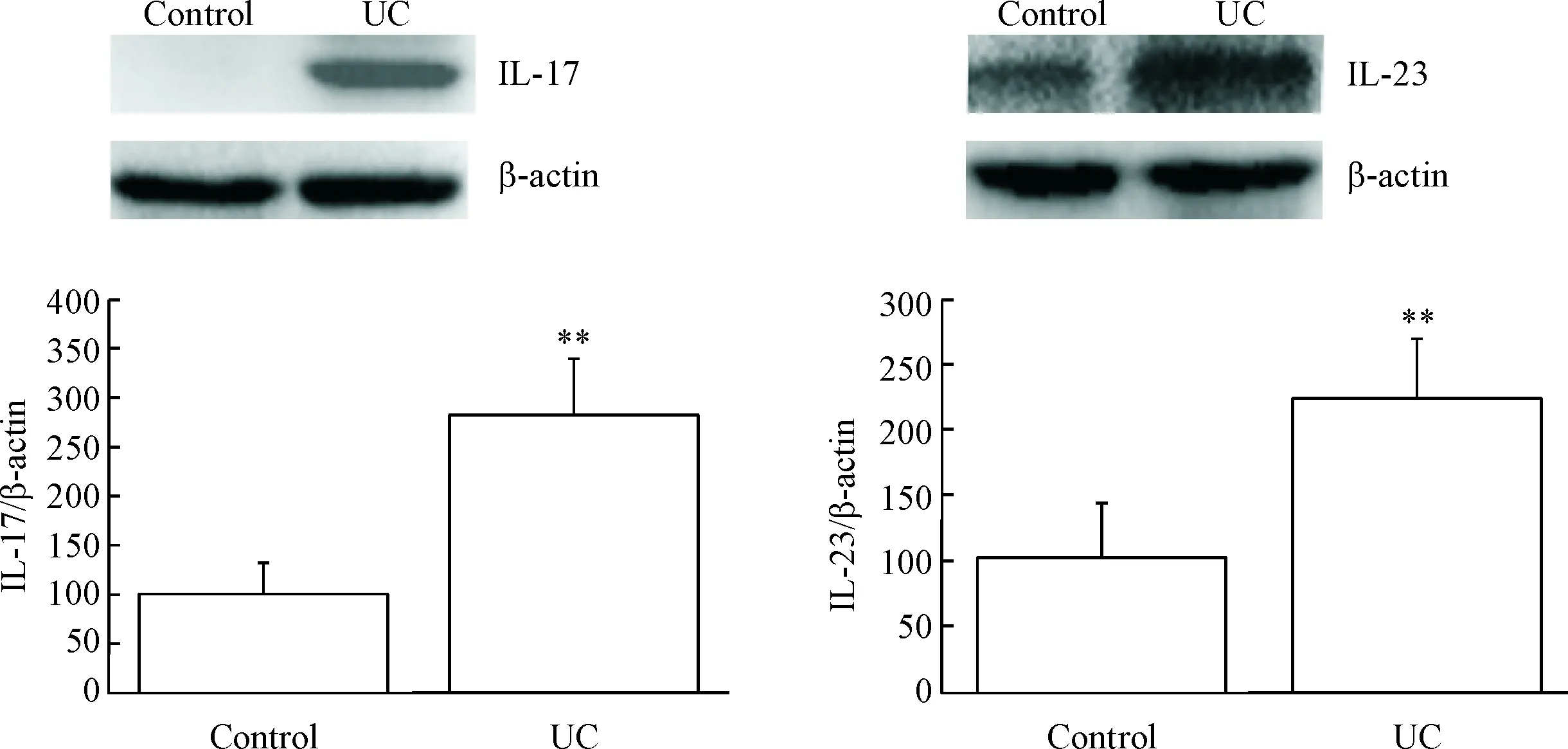
Figure 6. The protein levels of IL-17 and IL-23 in the colon detected by Western blot. Mean±SEM.n=20.**P<0.01vscontrol group.
图6Westernblot检测结肠组织IL-17和IL-23蛋白的表达水平
表6IL-17和IL-23表达与Baron分级及组织病理学评分的相关性
Table 6. Correlations between IL-17/IL-23 expression and Baron grade as well as histopathological score

ProteinBarongradeHistopathologicalscorerPrPIL-170.7170.020.6600.030IL-230.8490.0160.6750.032

表7 IL-17和IL-23表达与目标菌群的相关性
肠道菌群分析可反映肠道细菌的状态,因此我们首先对各组标本进行粪便涂片、需氧及厌氧培养,发现2类菌均有不同程度的改变,其中,需氧菌总数增加,以大肠杆菌降低和肠球菌升高变化最为明显;厌氧菌总数减少,主要表现为拟杆菌、双歧杆菌和乳酸杆菌减少,这与国内外文献报道部分相似,从而大体水平上揭示UC患者肠道细菌的变化。为了验证以上结果,我们用以上需氧及厌氧菌的选择性培养基进行培养,发现与鉴定结果一致。同时,为全面反映肠道状态,本研究选取消化道内几种目标菌属,对UC患者目标菌属进行定量研究,结果显示,大肠杆菌、拟杆菌、双歧杆菌和乳酸杆菌在UC组粪便标本中较正常组含量有所减少,而肠球菌在UC组粪便标本中较正常组含量有所增高。这些结果与活菌培养的结果一致。正常情况下,双歧杆菌和乳酸杆菌可与肠黏膜细胞密切结合,在肠黏膜表面形成生物学屏障,阻止致病菌、条件致病菌的定植和入侵,因此二者的减少将明显削弱肠黏膜对各种致病因素的防御作用。另外,由于肠球菌释放外毒素,势必加重UC患者已存在的肠道局部炎症反应和免疫紊乱。但是这些细菌在UC中的具体作用机制还有待进一步研究。
虽然肠黏膜固有层免疫细胞平衡着肠道微生物的免疫耐受和对肠道微生物致病菌的防御作用,但UC仍然被认为可能是肠黏膜免疫细胞对肠道菌群抗原的过度应答导致肠道屏障功能受损过度的炎症反应状态[17-18]。新近研究表明,以分泌IL-17为特征的CD4+T细胞是一种新的辅助性T细胞亚群,被认为具有介导炎性反应、自身免疫性疾病等重要免疫调节作用[19]。我们发现IL-23/IL-17的表达在正常的结肠上皮细胞较低,而在UC患者结肠上皮细胞的表达明显升高,通过相关性分析,发现IL-23与IL-17平均吸光度与Baron分级和组织病理学评分均呈正相关,表明二者在UC的发生发展中起关键作用,但二者表达水平与UC患者肠道菌群的关系尚不明确。通过将IL-23/IL-17的平均吸光度与常见菌荧光定量进行相关性分析,发现IL-23平均吸光度与大肠杆菌数量呈负相关,IL-23/IL-17与肠球菌数量呈正相关,而二者表达水平与拟杆菌、双歧杆菌、乳酸杆菌数量无关,提示IL-23/IL-17作为UC发生发展的关键因子,其与肠道菌群含量的变化可能存在一定关联,因其相互之间的影响最终在UC的发生中起到重要作用。关于IL-23/IL-17与肠道细菌的因果关系在UC中的作用,已有研究认为,肠道内致病菌产物与各自的Toll样受体结合,诱导抗原递呈细胞分泌IL-23,IL-23再与相应受体结合,诱导IL-17表达,促发炎症级联放大,最终介导肠道炎症发生和肠黏膜损伤[20]。多种动物模型研究表明,IBD的病理是宿主对正常细菌的异常免疫反应和宿主对异常细菌的正常反应的交叉[21],但菌群失调到底是IBD的原因,还是IBD的结果,目前并不明确[4]。
本研究也存在局限性,如培养只能检测肠道中的活菌,而不能代表死菌,由于肠道菌群种类较多,不能完全反映所有菌群,且分析过程中只能涉及那些能在现有条件较易培养出来的细菌,而能培养的细菌由于种类太多,也只能选择有代表性的数种。
综上所述,活动期UC患者存在明显的菌群失调,改变的细菌与患者炎症程度密切相关,IL-23/IL-17作为UC发生发展的关键因子,与肠道菌群含量的变化可能存在一定关联,其相互作用在UC的发生中起到重要作用。
[参 考 文 献]
[1] Li KY, Wang JL, Wei JP, et al. Fecal microbiota in pouchitis and ulcerative colitis[J]. World J Gastroenterol, 2016, 22(40):8929-8939.
[2] Kumagai H, Yokoyama K, Imagawa T, et al. Failure of fecal microbiota transplantation in a three-year-old child with severe refractory ulcerative colitis[J]. Pediatr Gastroenterol Hepatol Nutr, 2016, 19(3):214-220.
[3] Kostic AD, Xavier RJ, Gevers D. The microbiome in inflammatory bowel disease: current status and the future ahead[J]. Gastroenterology, 2014, 146(6):1489-1499.
[4] Sartor RB, Wu GD. Roles for intestinal bacteria, viruses, and fungi in pathogenesis of inflammatory bowel diseases and therapeutic approaches[J]. Gastroenterology, 2017, 152(2):327-339.
[5] 张秀荣. 肠道菌群粪便涂片检查图谱[M]. 第1版.北京: 人民军医出版社, 2000:27-61.
[6] Bewtra M, Brensinger CM, Tomov VT, et al. An optimized patient-reported ulcerative colitis disease activity measure derived from the Mayo score and the simple clinical colitis activity index[J]. Inflamm Bowel Dis, 2014, 20(6):1070-1078.
[7] Karagoz H, Erden A, Karaman H, et al. Revision of the demographic and clinical data of patients with ulcerative colitis in Turkey[J]. Med Glas (Zenica), 2017, 14(2):224-228.
[8] Siegmund B, Lehr HA, Fantuzzi G, et al. IL-1β-converting enzyme (caspase-1) in intestinal inflammation[J]. Proc Natl Acad Sci U S A, 2001, 98(23):13249-13254.
[9] Tomasello G, Bellavia M, Palumbo VD, et al. From gut microflora imbalance to mycobacteria infection: is there a relationship with chronic intestinal inflammatory diseases?[J]. Ann Ital Chir, 2011, 82(5):361-368.
[10] Shen J, Zuo ZX, Mao AP. Effect of probiotics on inducing remission and maintai ning therapy in ulcerative colitis, Crohn’s disease, and pouchitis: meta-analysis of rando-mized controlled trials[J]. Inflamm Bowel Dis, 2014, 20(1):21-35.
[11] Martini E, Krug SM, Siegmund B, et al. Mend your fences: the epithelial barrier and its relationship with mucosal immunity in inflammatory bowel disease[J]. Cell Mol Gastroenterol Hepatol, 2017, 4(1):33-46.
[12] Kaser A, Zeissig S, Blumberg RS. Inflammatory bowel di-sease[J]. Annu Rev Immunol, 2010, 28:573-621.
[13] Balish E, Warnter T. Enterococcus faecalis induces inflammatory bowel disease in interleukin-10 knockout mice[J]. Am J Pathol, 2002, 160(6):2253-2257.
[14] Gradel KO, Nielsen HL, Schønheyder HC, et al. Increased short- and long-term risk of inflammatory bowel disease after salmonella or campylobacter gastroenteritis[J]. Gastroenterology, 2009, 137(2):495-501.
[16] Papamichael K, Konstantopoulos P, Mantzaris GJ.Helicobacterpyloriinfection and inflammatory bowel disease: is there a link?[J]. World J Gastroenterol, 2014, 20(21):6374-6385.
[17] Neuman MG. Immune dysfunction in inflammatory bowel disease[J]. Transl Res, 2007, 149(4):173-186.
[18] Danese S, Fiocchi C. Etiopathogenesis of inflammatory bowel diseases[J]. World J Gastroenterol, 2006, 12(30):4807-4812.
[20] Krajina T, Leithäuser F, Möller P, et al. Colonic lamina propria dendritic cells in mice with CD4+T cell-induced colitis[J]. Eur J Immunol,2003, 33(4):1073-1083.
[21] Buttó LF, Haller D. Dysbiosis in intestinal inflammation: cause or consequence[J]. Int J Med Microbiol, 2016, 306(5):302-309.
