白细胞介素22抗体抑制Snail1高表达对糖尿病肾病的影响*
2018-05-17赵林双
刘 意, 赵林双
(中国人民解放军武汉总医院内分泌科, 湖北 武汉 430070)
糖尿病肾病(diabetic nephropathy,DN)是高发且缩短患者生存年限、严重影响患者生存质量的糖尿病并发症之一。流行病学研究发现几乎1/3的糖尿病患者受DN影响,最终50%发展为终末期肾病[1]。2016年美国糖尿病协会科学年会指出,慢性低度炎症参与糖尿病病程,而干预慢性低度炎症利于糖尿病好转[2]。可见慢性低度炎症在DN并发症发生发展中起着不可忽视的作用[3]。
白细胞介素22(interlukin-22,IL-22)属IL-10细胞因子家族,参与宿主屏障组织防御。IL-22受体(IL-22 receptor,IL-22R)由IL-22R1和IL-10R2异二聚体亚基组成,IL-22与IL-22R1有高度亲和性和专一性。与其它大多数作用于造血细胞的细胞因子不同,IL-22R1在免疫细胞缺如,而只表达于肺脏、肝脏、肾脏和胰腺等组织非造血上皮细胞和成纤维细胞[4-5]。
最近研究发现, IL-22在2型糖尿病患者高表达[6-7]。还有研究表明,IL-22可以促进组织器官纤维化[8-9]。肾小管上皮细胞是表达IL-22R1的主要细胞[4],IL-22可能在DN发病机制中起重要作用。IL-22/IL-22R1系统近期已被认为在代谢性疾病中有重要的药物发展前景[10-11]。但关于IL-22在DN发生发展中的作用尚无文献报道。本研究通过构建糖尿病小鼠模型,探讨IL-22在DN发生发展中的作用及具体机制,为治疗DN提供新的思路和理论依据。
材 料 和 方 法
1 动物
24只SPF级5~6周龄C57BL/6小鼠购自北京维通利华实验动物技术有限公司(动物合格证编号:11400700167238),体重16~18 g。饲养环境:室温20~24 ℃,相对湿度40%~60%,自由摄食饮水,12 h交替照明。
2 主要试剂
链脲佐菌素(streptozotocin,STZ; Sigma);牛血清白蛋白(bovine serum albumin,BSA; Biosharp);重组IL-22(recombinant IL-22, rIL-22; PeproTech);IL-22中和抗体(IL-22 antibody,anti-IL-22; PeproTech);抗纤维连接蛋白(fibronectin,FN) 抗体和抗E-钙黏素(E-cadherin)抗体(武汉三鹰生物技术有限公司);TRIzol(Aidlab);cDNA第一链合成试剂盒(Vazyme);PCR引物由武汉擎科生物有限公司合成。
3 主要方法
3.1糖尿病小鼠模型的建立 18只小鼠适应性喂养1周后,予以高脂饲料(普通饲料中加入2%胆固醇、0.15%胆酸钠、10%蔗糖和10%猪油)喂养4周,禁食10 h后按50 mg/kg剂量腹腔注射STZ溶液,连续5 d,另取6只普通饲料喂养小鼠腹腔注射等量柠檬酸缓冲液作为正常对照(normal control,NC)组。1周后剪尾法测随机血糖≥13.9 mmol/L为造模成功。
3.2实验动物干预及分组 造模成功后,糖尿病模型小鼠继续高脂喂养8周,随机分为DN组(n=6)、rIL-22干预组(DN+rIL-22组,n=6)和anti-IL-22干预组(DN+anti-IL-22组,n=6)。分组干预如下:(1)DN+rIL-22组:rIL-22 200 μg/kg,每周2次,连续4周,腹腔注射;(2)DN+anti-IL-22组:anti-IL-22 200 μg/kg,每周2次,连续4周,腹腔注射;(3)DN组:等量0.1% BSA腹腔注射,每周2次,连续4周;(4)NC组:等量0.1% BSA腹腔注射,每周2次,连续4周。
3.3血糖、肾功能、24 h尿微量白蛋白(microalbumin,m-Alb)和24 h尿肌酐(urine creatinine,UCr)的检测 用血糖仪以剪尾法测定各组小鼠干预前和干预后的空腹血糖(fasting plasma glucose, FPG),全自动生化仪检测血清肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen,BUN)、24 h m-Alb和24 h UCr,并计算m-Alb/UCr比值。
3.4肾脏指数(kidney index,KI)的计算 实验结束后,小鼠称重,腹腔注射1%水合氯醛50 mg/kg麻醉。留取肾脏标本,称重,计算KI。KI (%)=双侧肾脏重量(g)/体重(g)×100%。
3.5光镜下观察肾脏组织的病理结构改变 取4%多聚甲醛常温固定的小鼠肾脏组织,常规的梯度脱水、石蜡包埋、切片(5 μm),做常规HE染色,光镜下观察肾脏组织病理形态学改变。
3.6肾小管间质损伤的评分标准 肾小管间质各项病理指标包括肾小管萎缩、肾间质纤维化和炎性细胞浸润3项半定量评分。采用Katafuchi计分标准,肾间质积分0~9分,间质炎性细胞浸润0~3分,间质纤维化0~3分,肾小管萎缩0~3分。综合积分作为标本肾小管间质损伤评分标准,记为肾小管损伤分数(score of tubular injury STI)。
3.7qPCR法检测肾脏组织Snail1的mRNA表达 取出-80 ℃冻存的新鲜肾脏组织,以TRIzol试剂盒提取肾脏组织总RNA,分光光度计进行RNA浓度测定。Snail1的上游引物为5’-CACCCTCATCTGGGACTCTC-3’,下游引物为5’-TTGCCACTGTCCTCATCGG-3’;β-actin的上游引物为5’-CACGATGGAGGGGCCGGACTCATC-3’,下游引物为5’-TAAAGACCTCTATGCCAACACAGT-3’。使用ABI 7900实时荧光PCR仪,qPCR反应严格依试剂盒操作说明进行。扩增条件为:94 ℃ 4 min;94 ℃变性30 s、56 ℃退火30 s、72 ℃延伸25 s,30次循环;继续72 ℃延伸4 min,4 ℃ 4 min。扩增完成后,50 ℃开始升温做熔解曲线,基因相对表达量以2-ΔΔCt值计算分析。
3.8Western blot法检测肾脏组织FN和E-cadherin的蛋白表达 提取肾脏总蛋白,BCA法测定总蛋白浓度。经过10%的SDS-PAGE分离,PVDF膜印迹,5%脱脂奶粉室温封闭。加入抗FN(1 ∶1 000)抗体和抗E-cadherin抗体(1 ∶5 000),4 ℃孵育过夜后,加辣根过氧化物酶标记的 II 抗(1 ∶50 000)孵育2 h。洗涤后经增强化学发光显影,曝光成像。以β-actin作为内参照,计算蛋白条带的灰度比值进行半定量分析,结果由计算机凝胶图像分析系统检测。
4 统计学处理
应用SPSS 22.0软件进行数据分析,计量资料以均数±标准差(mean±SD)表示。多组间比较选用单因素方差分析(ANOVA),组间多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 各组小鼠血糖、肾功能和肾脏指数的比较
NC组小鼠体型正常,毛柔顺且色泽乌黑,反应灵敏;各糖尿病模型组小鼠体型肥胖,毛粗糙且色泽暗淡,反应稍迟钝。干预前和干预4周后,与NC组小鼠比较,各糖尿病模型组小鼠FPG均显著升高(P<0.01),但各组间KI和肾功能的差异无统计学显著性,见表1。

表1 各组小鼠血糖、肾功能和肾脏指数的比较
**P<0.01vsNC group.
2 各组小鼠干预后微量白蛋白尿的比较
干预4周后,与NC组小鼠比较,各模型组24 h尿微量白蛋白/肌酐比值均显著升高(P<0.05或P<0.01),出现微量白蛋白尿,提示进展为糖尿病肾脏病变。另外,rIL-22干预4周后,相较于DN组,24 h m-Alb和24 h UCr均显著升高(P<0.05),而anti-IL-22阻断4周后,24 h m-Alb、24 h UCr和24 h尿微量白蛋白/肌酐比值较DN组和DN+rIL-22组均显著降低(P<0.05),说明anti-IL-22可减轻糖尿病肾病白蛋白尿,见表2。
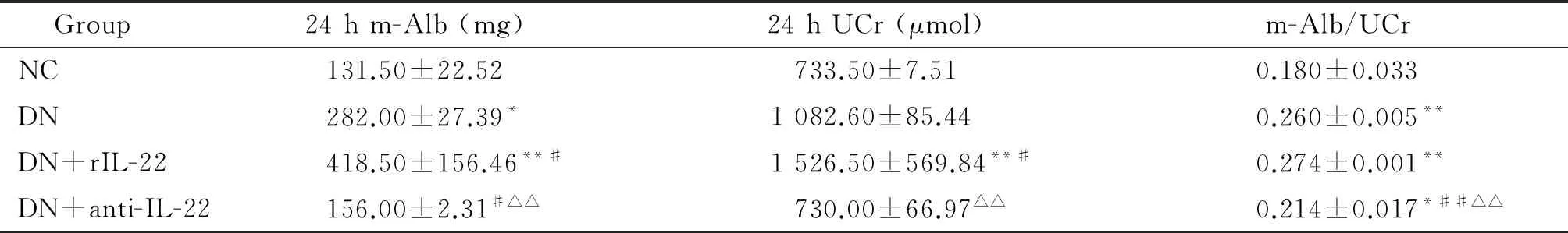
表2 各组小鼠干预后微量白蛋白尿的比较
*P<0.05,**P<0.01vsNC group;#P<0.05,##P<0.01vsDN group;△△P<0.01vsDN+rIL-22 group.
3 肾脏病理学改变的比较
NC组小鼠肾脏体积正常,质地柔软;各糖尿病模型小鼠肾脏体积增大,质地变硬。HE染色后光镜下可见,NC组小鼠肾小球体积正常,肾小管上皮细胞形态规则、边界清晰,管腔规则,未见明显扩张;而DN组肾小管上皮细胞空泡变性、细胞核溶解、细胞边界不清,肾小管管腔不规则,部分管内有蛋白管型;肾小球体积增大,系膜细胞增多、系膜增宽;DN+rIL-22组较DN组上述病变更为广泛,而DN+anti-IL-22组上述病变明显减轻,见图1。
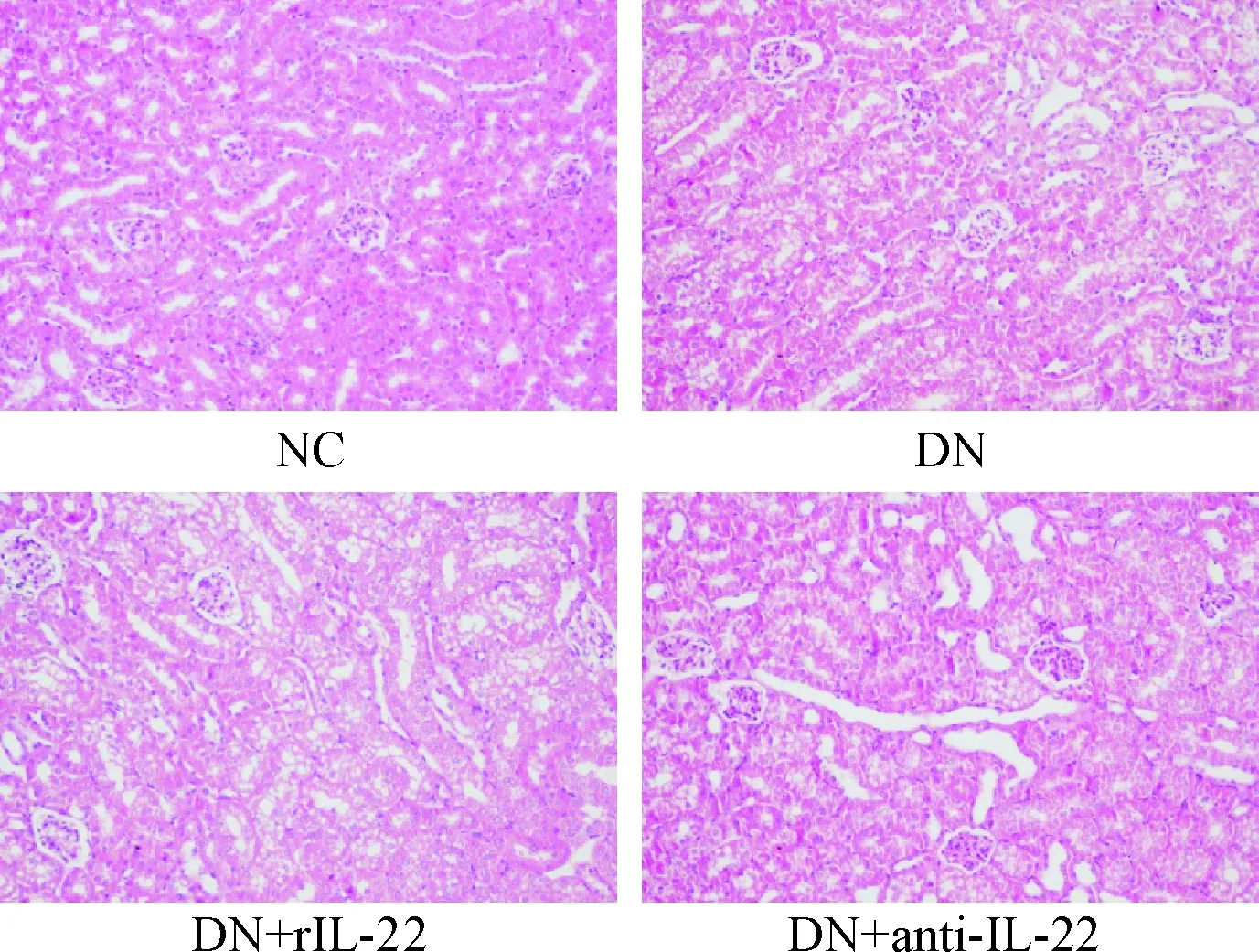
Figure 1. The pathological changes of renal tissues under light microscope (HE staining, ×400).
图1光镜下肾脏组织病理学改变
4 肾小管间质损伤的半定量分析
rIL-22干预4周后,DN+rIL-22组STI为7.17±0.75,较NC组(1.60±0.27)和DN组(4.63±0.58)均显著升高(P<0.01);而anti-IL-22阻断4周后,STI为3.01±0.52,较DN组显著下降(P<0.05)。
5 各组小鼠干预后肾脏Snail1 mRNA表达水平比较
qPCR结果显示,干预4周后,与NC组小鼠比较,DN组和DN+rIL-22组Snail1的mRNA表达均显著升高(P<0.05);而anti-IL-22阻断4周后,Snail1的mRNA表达较DN组显著降低(P<0.05),见图2。这说明anti-IL-22可以抑制糖尿病小鼠肾脏组织Snail1信号分子高表达。
6 各组小鼠干预后肾脏FN蛋白表达水平的比较
Western blot实验结果显示,rIL-22干预4周后,FN蛋白表达水平较NC组和DN组均显著升高(P<0.05或P<0.01);而anti-IL-22阻断4周后,FN蛋白表达水平较NC组显著升高(P<0.05),但与DN组比较差异无统计学显著性,见图3。这说明IL-22可诱导FN蛋白表达,加速细胞外基质积聚引起的糖尿病肾纤维化。

Figure 2. The relative mRNA expression level of Snail1 in the kidney among different groups. Mean±SD.n=6.*P<0.05vsNC group;#P<0.05vsDN group.
图2各组小鼠肾脏组织Snail1的mRNA相对表达水平

Figure 3. The relative protein expression level of FN in the kidney among different groups. Mean±SD.n=6.*P<0.05,**P<0.01vsNC group;#P<0.05vsDN group.
图3各组小鼠肾脏组织FN蛋白的表达水平
7 各组小鼠干预后肾脏E-cadherin蛋白表达水平比较
Western blot实验结果显示,rIL-22干预4周后,DN+rIL-22组E-cadherin蛋白表达水平较NC组和DN组均显著下降(P<0.05),见图4。这说明IL-22抑制间质细胞标志物E-cadherin蛋白表达,加速上皮-间充质转化(epithelial-mesenchymal transition,EMT)进程,从而促进糖尿病肾纤维化。
讨 论
炎症的标志是炎症细胞渗透、黏附分子表达和趋化因子、促炎细胞因子、血清C反应蛋白升高。慢性低度炎症发生于慢性、低级别水平,和传统炎症性疾病相比相当轻微[3]。目前认为,“2型糖尿病是一种慢性低度炎症性疾病”[2]。而炎症因子可能参与了2型糖尿病和DN并发症发生发展[3]。最近研究发现[6-7],IL-22在2型糖尿病患者升高。IL-22可以促进组织器官纤维化[8-9],而肾小管上皮细胞是表达IL-22R1的主要细胞[4],因此有必要探讨IL-22在糖尿病肾病发生发展中的作用。
Figure 4. The relative protein expression levels of E-cadherin in the kidney among different groups. Mean±SD.n=6.*P<0.05vsNC group;#P<0.05vsDN group.
图4各组小鼠肾脏组织E-cadherin蛋白相对表达水平
本研究发现,anti-IL-22可以减轻糖尿病肾病白蛋白尿,延缓DN进程。研究结果显示,糖尿病模型小鼠24 h尿微量白蛋白/肌酐比值均显著升高,出现白蛋白尿,提示进展为糖尿病肾脏病变。而anti-IL-22阻断4周后,24 h尿微量白蛋白/肌酐比值显著下降,表明白蛋白尿得到改善,为今后以IL-22为靶点治疗DN提供理论依据。白蛋白尿是糖尿病肾病早期阶段和特征性表现,通常作为评估药物疗效的终点事件[12]。
我们通过光镜观察进一步证实,rIL-22促进DN发生发展,而anti-IL-22可改善DN。我们发现,糖尿病小鼠肾小管上皮细胞空泡变性、蛋白管型形成和肾小球系膜扩张,rIL-22干预4周后上述病变更为广泛,反之anti-IL-22阻断4周后病变程度得以减轻。可见,IL-22在DN发病机制中起着不可忽视的作用。
Snai1基因编码Snail家族锌指蛋白1,以Snail1蛋白著称[13]。“上皮可塑性”指在肾脏,一些肾小管上皮细胞变为更接近间充质细胞,而另一些则回到上皮表型或保留去分化状态。“部分EMT”指极少甚至没有肾小管上皮细胞,可以真正穿越基底膜彻底转化为纤维母细胞[14]。而糖尿病肾纤维化主要由EMT[15]、细胞外基质积聚和肾小管上皮细胞凋亡引起[16]。FN是一种细胞外基质蛋白,为细胞外基质积聚标志物[16]。E-cadherin主要表达于上皮细胞,为EMT发生标志物[15]。有研究表明,Snail1可以阻止肾小管上皮细胞的最终分化,诱导部分EMT促进肾纤维化发展[13-14,17]。
本研究还发现,糖尿病肾病小鼠Snail1转录因子高表达,anti-IL-22可能通过抑制肾小管上皮细胞Snail1信号分子表达改善DN。qPCR结果显示,糖尿病肾病小鼠肾脏组织Snail1的mRNA表达水平显著升高,而anti-IL-22能够抑制Snail1的mRNA表达。
本研究结果表明,rIL-22可以促进ECM积聚和诱导EMT进程,加速糖尿病肾病发生发展。Western blot结果显示,rIL-22可以增加糖尿病小鼠肾脏组织FN表达,而抑制肾脏组织E-cadherin蛋白表达。
不同剂量和时长药物干预可能发挥不同药效,本研究结果未显示rIL-22对Snail1产生显著影响。因此,最佳的剂量和时长有待进一步探索,其它可能参与信号通路机制也有待深入发掘。
IL-22R1除与IL-22结合外,还可与IL-20和IL-24结合,以IL-22R1依赖性方式产生IL-22样效应。因此,中和IL-22后并不能完全阻断IL-22发挥生物效应[4,10]。本研究结果未显示给予anti-IL-22后对FN和E-cadherin产生显著影响,可能与代偿机制有关。反之,阻断IL-22R1也许比中和IL-22能发挥更完全的阻断效应[10]。后续研究,还须深入探讨应用IL-22R1抗体(IL-22 receptor-1 antibody,IL-22RA1)阻断IL-22R1后对糖尿病肾病保护机制。
从上述研究结果我们得知,IL-22抗体可能通过抑制肾小管上皮细胞Snail1信号分子高表达而减轻糖尿病肾病白蛋白尿,延缓DN进程。本研究尚存在一些不足之处,课题组未检测IL-22在模型动物和干预动物中的表达水平。在下一步的工作中,课题组将进一步证明实验干预对糖尿病肾病产生的影响。
[参 考 文 献]
[1] Lv M, Chen Z, Hu G, et al. Therapeutic strategies of diabetic nephropathy: recent progress and future perspectives[J]. Drug Discov Today, 2015, 20(3):332-346.
[2] Zhou J, Xu H, Huang K. Organoselenium small molecules and chromium(III) complexes for intervention in chronic low-grade inflammation and type 2 diabetes[J]. Curr Top Med Chem, 2016, 16(8):823-834.
[3] Shikata K, Makino H. Microinflammation in the pathoge-nesis of diabetic nephropathy[J]. J Diabetes Investig, 2013,4(2):142-149.
[4] Dudakov JA, Hanash AM, van den Brink MR. Interleukin-22: immunobiology and pathology[J]. Annu Rev Immunol, 2015, 33:747-785.
[5] Perusina LM, Lin Y, Fang J, et al. Biological and pathological activities of interleukin-22[J]. J Mol Med (Berl), 2016, 94(5):523-534.
[6] Zhao R, Tang D, Yi S, et al. Elevated peripheral frequencies of Th22 cells: a novel potent participant in obesity and type 2 diabetes[J]. PLoS One, 2014, 9(1):e85770.
[7] Guo H, Xu BC, Yang XG, et al. A high frequency of peripheral blood IL-22+CD4+T cells in patients with new onset type 2 diabetes mellitus[J]. J Clin Lab Anal, 2016, 30(2):95-102.
[8] Wu LY, Liu S, Liu Y, et al. Up-regulation of interleukin-22 mediates liver fibrosis via activating hepatic stellate cells in patients with hepatitis C[J]. Clin Immunol, 2015, 158(1):77-87.
[9] Zhao J, Zhang Z, Luan Y, et al. Pathological functions of interleukin-22 in chronic liver inflammation and fibrosis with hepatitis B virus infection by promoting T helper 17 cell recruitment[J]. Hepatology, 2014, 59(4):1331-1342.
[10] Sabat R, Ouyang W, Wolk K. Therapeutic opportunities of the IL-22-IL-22R1 system[J]. Nat Rev Drug Discov, 2014, 13(1):21-38.
[11] Sabat R, Wolk K. Deciphering the role of interleukin-22 in metabolic alterations[J]. Cell Biosci, 2015, 5:68.
[12] Kröpelin TF, de Zeeuw D, Andress DL, et al. Number and frequency of albuminuria measurements in clinical trials in diabetic nephropathy[J]. Clin J Am Soc Nephrol, 2015,10(3): 410-416.
[13] Grande MT, Sanchez-Laorden B, Lopez-Blau C, et al. Snail1-induced partial epithelial-to-mesenchymal transition drives renal fibrosis in mice and can be targeted to reverse established disease[J]. Nat Med, 2015, 21(9):989-997.
[14] Huang S, Susztak K. Epithelial plasticity versus EMT in kidney fibrosis[J]. Trends Mol Med, 2016, 22(1):4-6.
[15] Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nat Rev Mol Cell Biol, 2014, 15(3):178-196.
[16] Chuang PY, Menon MC, He JC. Molecular targets for treatment of kidney fibrosis[J]. J Mol Med (Berl), 2013, 91(5):549-559.
[17] Lovisa S, LeBleu VS, Tampe B, et al. Epithelial-to-mesenchymal transition induces cell cycle arrest and parenchymal damage in renal fibrosis[J]. Nat Med, 2015, 21(9):998-1009.
