可乐定对慢性脑缺血大鼠学习记忆及ERK信号通路相关蛋白的影响*
2018-05-17王奎鹏余海滨
王奎鹏, 余海滨
(河南中医药大学第一附属医院, 河南 郑州 450000)
脑缺血(ischemia)是因脑内血氧供应不足而导致的一种神经系统疾病,在发展中国家已经成为继心脏病和肿瘤的第3大致死病因[1]。有数据表明,脑缺血引起的致残率高达20%~30%,在幸存的患者中,1/3的患者在1周之内有所改善,40%患者确没有任何改善,20%病患病情在第1周的时候甚至会加剧[2],这提示脑缺血具有高治残率及致死率。脑缺血超过1 h,即可出现不可逆性脑损伤,表现为不同程度的感觉、运动及认知功能障碍,该疾病一旦发生将会给家庭和社会带来沉重的负担。鉴于我国老龄化社会的到来,寻找有效的治疗脑缺血的药物以及治疗途径已刻不容缓。在寻找治疗脑缺血的药物中,α2肾上腺素受体激动剂进入人们的视野。有研究表明可乐定(clonidine)能显著提高正常和高血糖全脑缺血的大鼠模型中神经细胞的存活率以及谷氨酸的释放[3]。但是对脑缺血的认知功能后遗症是否具有改善作用仍然不清楚。此外,α2肾上腺素通路能介导丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族中的细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路[4]。综上所述,本文旨在探讨可乐定是否通过调节ERK信号通路来改善脑缺血的后遗症—学习记忆障碍,为慢性脑缺血提供新的治疗策略。
材 料 和 方 法
1 实验动物及分组
45只雄性SPF级Sprague-Dawley(SD)大鼠,体重(300±50) g,购自北京华阜康生物科技股份有限公司,许可证号SCXK(京)2014-0005。利用随机数字表法分为假手术(sham)组、脑缺血(ischemia)组和可乐定(clonidine)组,每组15只,术前连续给药1周,其中可乐定组每日100 μg/kg可乐定灌胃,正常组和模型组每日灌胃等体积蒸馏水。手术后连续喂养30 d,均自由饮食与摄水。
2 实验试剂及仪器
可乐定购于江苏恒瑞医药股份有限公司,批号为09081232;抗ERK1/2、p-ERK1/2、环磷腺苷效应元件结合蛋白(c-AMP-response element binding protein)CREB和p-CREB抗体购自Cell Signaling Technology;兔抗及鼠抗β-actin抗体购自Santa Cruz Biotechnology。DYC2-24DN型电泳仪(北京市六一仪器厂);MT-200 Morris水迷宫视频跟踪分析系统(成都泰盟科技有限公司);FA1104电子天平(上海方瑞仪器有限公司)。
3 方法
3.1大脑中动脉栓塞(middle cerebral artery occlusion,MACO)模型的制备 各组大鼠手术前禁食12 h,自由饮水。手术当天,对大鼠称重后,用10%水合氯醛(3.5 mL/kg)腹腔注射麻醉大鼠,仰卧位固定于大鼠解剖板上,剪去颈部手术区毛,碘伏、医用乙醇依次消毒手术区,于颈部行合适的切口,分离胸锁乳突肌,切断二腹肌前腹,暴露右侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA),靠近近心端结扎CCA,在分岔处结扎ECA,并预留一根线于CCA处,用微型动脉夹在远心端进行夹闭,于CCA与ICA分岔处0.5 cm剪一小口,从开口处往颈内动脉慢慢插入直径0.235 mm或0.265 mm的尼龙栓,将栓线插入2.5cm左右可达到1.8~2.0 cm的插入深度,并用预留的手术线结扎切口处,全层缝合伤口,消毒,最后将大鼠放于鼠笼中并用白炽灯加热维持大鼠体温。持续栓塞2 h后将栓线拔出再灌注30 d,待动物苏醒后血管栓塞的同侧出现Hornor征和对侧肢体运动障碍即为模型成功。假手术组操作过程同手术组,但大鼠右侧颈总和颈外动脉不结扎也不插入栓线。
3.2Morris水迷宫(Morris water maze,MWM)检测大鼠学习记忆能力 术后4周对各组大鼠进行MWM实验。(1) 定位航行实验:将站台置于水迷宫第3象限中央,每天相同时段让大鼠面向池壁从第1象限中入水,电脑记录其在90 s内找到并爬上站台的时间,若在90 s内没有找到站台,则将其放至站台停留20 s,逃避潜伏期记为90 s,每天游泳训练2次,连续5 d;(2) 空间探索实验:MWM实验第6天,将第3象限中站台撤去,在相同时段,让大鼠自由游泳1次,每次时间为90 s。电脑记录大鼠在第3象限的停留时间(residence time in the third quadrant,RTQ)、跨越隐匿站台的次数及入水朝向角。
3.3脑组织实验样本的制备 MWM实验完成后,对大鼠腹腔注射10% 水合氯醛(3.5 mL/kg)进行麻醉,麻醉成功后,迅速打开其胸腹腔,充分暴露心脏和肝脏,将灌注针从心尖插入左心室至主动脉,同时剪开右心耳,用0.01 mol/L PBS快速灌注至肝脏透明[4]。灌注成功后,将大鼠在冰上断头处死,快速分离海马组织,一半脑组织迅速放入-80 ℃冰箱中,一半脑组织迅速放于4%多聚甲醛溶液中固定24 h备用。
3.4免疫组织化学检测 将脑组织制成海马相关区域冠状切片并在梯度乙醇下常规脱蜡至水;室温下用3% H2O2孵育25 min;在微波沸腾条件下用柠檬酸修复液行抗原修复;5% BSA 30 ℃条件下封闭30 min;滴加 I 抗稀释液 (1∶300),湿盒4 ℃孵育过夜。选择合适的生物素化 II 抗工作液滴加于切片组织上,30 ℃避光孵育30 min;将适量的辣根酶标记物工作液滴加于切片组织上,30 ℃避光孵育30 min;DAB显色剂显色5 min,苏木素复染30 s,冲洗干净;梯度乙醇脱水,二甲苯透明,中性树胶封片观察。用0.01 mol/L PBS代替 I 抗进行免疫组化染色设为阴性对照组,其余步骤同上。在倒置显微成像系统下观察并拍照,用IPP 6.0软件对染色结果进行累积吸光度(IA)值定量分析。
3.5Western blot检测 将海马组织从-80 ℃冰箱中取出,根据蛋白提取试剂盒说明书提取总蛋白,BCA法测定并将各组蛋白调至等浓度,加适量上样缓冲液并混匀,煮沸5 min;采用湿转法将目标蛋白转到PVDF膜上;5%脱脂奶粉室温封闭膜2 h,加入稀释的I抗(1∶1 000),4 ℃摇床孵育过夜;加入稀释的 II 抗(1∶4 000),室温孵育2 h,化学发光法进行曝光;蛋白表达量以其与内参照蛋白条带灰度的比值表示。
4 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 17.0软件处理数据,组间数据比较用单因素方差分析(one-way ANOVA)或非参数检验,以P<0.05为差异有统计学意义。
结 果
1 可乐定对SD大鼠逃避潜伏期的影响
与假手术组比较,在5 d定位航行的实验中,脑缺血组大鼠的逃避潜伏期显著延长(P<0.05或P<0.01);与脑缺血组相比,可乐定组大鼠的逃避潜伏期显著缩短(P<0.05或P<0.01),见表1。

表1 3组SD大鼠逃避潜伏期的比较
*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vsischemia group.
2 3组SD大鼠在第3象限停留时间、跨越隐匿站台次数及入水朝向角的比较
与假手术组比较,脑缺血组大鼠的RTQ及跨越隐匿站台次数显著减少(P<0.01),入水朝向角明显增加(P<0.01);与脑缺血组比较,可乐定组大鼠的RTQ及跨越隐匿站台次数显著增加(P<0.01),入水朝向角明显减小(P<0.05),见表2。
表23组SD大鼠间RTQ、跨越隐匿平台的次数及入水朝向角的比较
Table 2. Comparison of RTQ, number of cross-hidden platform and the orientation angle between 3 groups of SD rats (Mean±SD.n=15)

GroupRTQ(s)NumberOrientationangle(°)Sham30.78±6.565.68±1.7236.52±18.78Ischemia15.32±4.97**1.35±0.86**65.69±34.33**Clonidine28.19±5.87##4.49±1.31##38.17±22.17#
**P<0.01vssham group;#P<0.05,##P<0.01vsischemia group.
3 免疫组织化学法检测可乐定对海马CA1区p-ERK1/2和p-CREB蛋白的表达
海马CA1区中p-ERK1/2蛋白主要存在于细胞膜及胞浆中,p-CREB蛋白主要存在于细胞核中。与假手术组相比,脑缺血组大鼠海马中各蛋白阳性水平均明显增加(P<0.01);与脑缺血组相比,可乐定组海马中各蛋白阳性水平均明显降低(P<0.01),见图1、表3。
4 Western blot 检法可乐定对海马组织中p-ERK1/2、ERK1/2、p-CREB和CREB蛋白水平的影响
与假手术组相比,脑缺血组大鼠海马组织中p-ERK1/2和p-CREB的蛋白水平显著增加(P<0.01);与脑缺血组相比,可乐定组大鼠海马组织中p-ERK1/2和p-CREB的蛋白水平显著减少(P<0.01),见图2。
讨 论
本次实验的目的是探讨α2肾上腺素受体激动剂可乐定对脑缺血导致的学习记忆障碍是否具有改善作用。基于此我们首先采用行为学研究方法——Morris水迷宫检测可乐定对慢性脑缺血大鼠是否具有改善学习记忆的作用,结果表明可乐定能提高脑缺血大鼠的学习记忆能力,发现这个现象后我们进一步通过免疫组织化学和Western blot法检测ERK信号通路相关蛋白的表达,结果表明ERK信号通路相关蛋白表达发生了改变,提示可乐定改善脑缺血后的学习记忆障碍可能是通过调节ERK信号通路实现的。
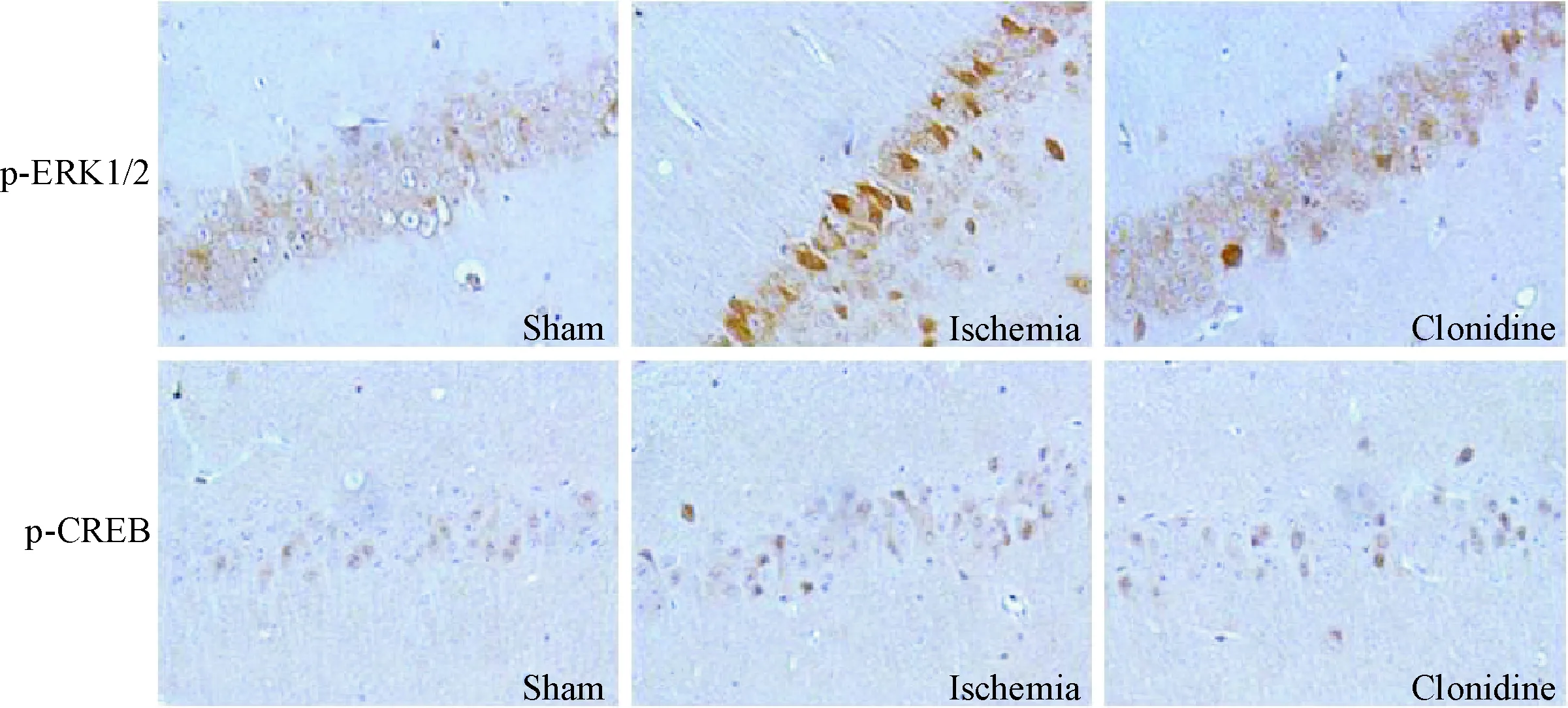
Figure 1. The relative protein levels of p-ERK1/2 and p-CREB in hippocampal of 3 groups of SD rats (×400).
图1可乐定对海马CA1区p-ERK1/2和p-CREB蛋白水平的影响
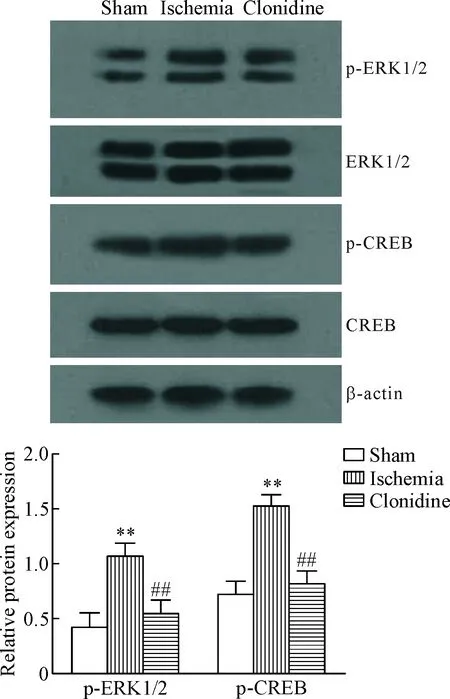
Figure 2. The effects of clonidine on the relative protein levels of p-ERK1/2 and p-CREB in the hippocampal between 3 groups of SD rats. Mean±SD.n=15.**P<0.01vssham group;##P<0.01vsischemia group.
图23组SD大鼠海马组织中p-ERK1/2和p-CREB相对蛋白表达量的比较
表33组SD大鼠海马组织CA1区p-ERK1/2和p-CREB蛋白水平(IA)的比较
Table 3. Comparison of the protein levels of p-ERK1/2 and p-CREB (expressed asIA) in the hippocampal CA1 between 3 groups of SD rats (×103. Mean±SD.n=15)

Groupp-ERK1/2p-CREBSham2.09±0.619.83±2.15Ischemia5.76±0.77**20.52±4.81**Clonidine2.69±0.68##11.08±3.57##
**P<0.01vssham operation group;##P<0.01vsischemia group.
脑缺血能够引起乙酰胆碱酯酶(acetylcholines-terase,AChE)活性增加,导致胆碱能系统功能降低,从而引起学习记忆能力的下降,甚至痴呆[5]。从上世纪70年代起α2肾上腺素受体激动剂已经成功应用于高血压的治疗,并能够降低充血性心力衰竭的心脏后负荷,此外,α2肾上腺素受体激动剂对脑缺血后导致的神经损伤无论是从行为学还是功能上[6]都具有很好的改善作用。叶春玲等[7]发现可乐定作为α2肾上腺素受体激动剂能显著延长脑缺血小鼠以及急性脑缺血猫的的存活时间。并且越来越多的研究表明可乐定可以对抗神经元兴奋性毒性从而具有神经元保护作用。Zhang等[6]研究指出可乐定预处理可明显提高大鼠脑缺血后的神经功能评分及降低脑梗死体积,从而对抗脑缺血产生神经保护作用。但可乐定对脑缺血的后遗症是否具有改善作用目前报道甚少。我们的实验旨在探讨可乐定是否可以改善脑缺血后学习记忆障碍。
α2肾上腺素能通路介导的信号途径多且复杂,除了经典的Gi蛋白介导的 PKA-cAMP 通路以外,还可以激活丝裂原活化蛋白激酶家族中的ERK1/2通路[8]。ERK1/2是维持中枢神经系统正常发育及生物学功能发挥的必需物质,参与细胞的生长、分化和增殖,并介导凋亡信号传递等,然而一些新近研究报道指出,ERK信号通路可能参与神经毒性作用[4],脑缺血发生后,通过各种胞膜受体介导,激活蛋白激酶C途径、腺苷酸环化酶途径、肌醇三磷酸激酶途径和酪氨酸受体途径等,再激活MAPK级联反应,引发脑缺血损伤[9]。此外,ERK1/2通路在神经可塑性以及学习记忆中起着重要的作用[10],与学习密切相关的形式就是长时程增强效应(long-term potentiation,LTP),即突触活动的易化现象,目前被公认为是研究学习记忆的最理想模型。大量的研究发现,LTP的形成伴随着ERK2活性的升高,而采用特异性ERK2阻断剂则可以抑制LTP的形成,起到长时程抑制的效果,因此表明ERK1/2与学习记忆密切相关。而我们的实验表明脑缺血后ERK1/2活性增加,学习记忆下降,而可乐定则能逆转这种现象,因此我们推测缺血状态下,ERK1/2信号可能参与了学习记忆机制的调节或者修复过程。CREB作为ERK1/2下游信号因子也是cAMP反应原件应答蛋白,其主要在脑内神经元细胞核中表达,是被最早证实的具有调节转录作用的细胞因子,其可以调节cAMP的基因转录主要是作用于cAMP的起始子以及由各种信号分子产生的cAMP大量下游信号靶点,从而影响很多神经元的基因和蛋白表达,最终调节整个神经网络。大量的实验研究已经证实CREB与学习记忆密切相关。有研究表明在海马切片中后期LTP的维持伴随着磷酸化CREB蛋白表达增加,这种情况可以持续4 h,证实了磷酸化CREB在LTP后期中起着非常重要的作用。另有研究发现[11-12],PKA抑制剂可以阻断CERB的磷酸化以及长期LTP的形成,但是并不影响早期LTP阶段。在早期压力所致的学习记忆下降的中年ApoE4-TR大鼠中检测到磷酸化CREB的降低[13]。据此表明磷酸化CREB与学习记忆密切相连。我们的实验表明可乐定能够使大鼠在原来象限所逗留的时间增加,表明可乐定确有提高学习记忆的作用,进一步观察到与学习记忆密切相关的蛋白磷酸化ERK1/2以及CREB表达均减少,表明ERK1/2改善脑缺血后的学习记忆可能是通过降低磷酸化ERK1/2以及CREB表达来实现的。
总之,我们的实验表明在MACO模型中所致的慢性脑缺血模型中可乐定具有改善脑缺血的学习记忆的作用,其可能是通过升高磷酸化ERK1/2以及CREB表达来实现的。
[参 考 文 献]
[1] Doyle KP, Simon RP, Stenzel-Poore MP. Mechanisms of ischemic brain damage[J]. Neuropharmacology, 2008, 55(3):310-318.
[2] Sandu RE, Uzoni A, Coman C, et al. Cerebral ischemia in the aged. Limited anti-inflammatory efficacy of the indomethacin treatment[J]. Rom J Morphol Embryol, 2015, 56(3):1111-1117.
[3] Jellish WS, Murdoch J, Kindel G, et al. The effect of clonidine on cell survival, glutamate, and aspartate release in normo-and hyperglycemic rats after near complete forebrain ischemia[J]. Exp Brain Res, 2005, 167(4):526-534.
[4] Schaak S, Cussac D, Cayla C, et al. Alpha(2) adrenoceptors regulate proliferation of human intestinal epithelial cells[J]. Gut, 2000, 47(2):242-250.
[5] Schetinger MR, Bonan CD, Frassetto SS, et al. Pre-conditioning to global cerebral ischemia changes hippocampal acetylcholinesterase in the rat[J]. Biochem Mol Biol Int, 1999, 47(3):473-478.
[6] Zhang Y. Clonidine preconditioning decreases infarct size and improves neurological outcome from transient forebrain ischemia in the rat[J]. Neuroscience, 2004,125(3):625-631.
[7] 叶春玲, 李宝华. 可乐定对小鼠和猫实验性脑缺血的保护作用[J]. 中国药理学和毒理学杂志, 1993, 7(1):42-44.
[8] Chu CT, Levinthal DJ, Kulich SM, et al. Oxidative neuronal injury. The dark side of ERK1/2[J].Eur J Biochem, 2004, 271(11):2060-2066.
[9] Borsello T, Clarke PG, Hirt L, et al. A peptide inhibitor of c-Jun N-terminal kinase protects against excitotoxicity and cerebral ischemia[J]. Nat Med, 2003, 9 (9):1180-1186.
[10] Impey S, Obrietan K, Storm DR. Making new connections: role of ERK/MAP kinase signaling in neuronal plasticity[J]. Neuron, 1999, 23(1):11-14.
[11] Leutge JK, Frey JU, Behnisch T. Single cell analysis of activity-dependent cyclic AMP-responsive element-binding protein phosphorylation during long-lasting long-term potentiation in area CA1 of mature rat hippocampal-organo-typic cultures[J]. Neuroscience, 2005, 131(3):601-610.
[12] Matsushita M, Tomizawa K, Moriwaki A, et al. A high-efficiency protein transduction system demonstrating the role of PKA in long-lasting long-term potentiation[J]. J Neurosci, 2001, 21(16):6000-6007.
[13] Lin LY, Zhang J, Dai XM, et al. Early-life stress leads to impaired spatial learning and memory in middle-aged ApoE4-TR mice[J].Mol Neurodegener, 2016, 11(1):51.
