PCA通过NF-κB和AP-1信号通路影响HUVECs表达TF*
2018-05-17张根葆高恬媛桑金凤
靳 文, 张根葆,2△, 高恬媛, 桑金凤
(皖南医学院 1病理生理学教研室, 2蛇毒研究所, 安徽 芜湖 241002)
尖吻蝮蛇毒蛋白C 激活剂(Agkistrodonacutusvenom protein C activator,PCA)是从皖南蝮蛇和尖吻蝮蛇蛇毒中分离、纯化得到的一种蛋白C激活剂,用于抗凝实验的研究[1]。血栓性疾病是临床上的常见病,严重威胁人类的生命健康[2]。血栓的形成是多因素的(如手术、外伤、败血症、肿瘤及充血性心力衰竭等),研究表明,各因素导致血管内皮细胞(vascular endothelial cells,VECs)损伤后,大量组织因子(tissue factor,TF)合成与释放,以致凝血途径被激活是血栓性疾病发生发展的重要因素[3]。细菌脂多糖(lipopolysaccharide,LPS)作为一种炎症致病因子诱导血管内皮细胞表达TF[4]。有报道认为,LPS引起血管内皮细胞损伤过度分泌TF,主要是通过细胞内的肿瘤坏死因子受体相关因子6(tumor necrosis factor-associated factor 6,TRAF6)泛素化激活转录途径来实现的[5-7]。而人类内皮细胞TF的表达主要是由于核因子κB(nuclear factor-κB,NF-κB)家族p65和活化蛋白1(activator protein-1,AP-1)家族Fos-Jun异二聚体的激活所致[8]。本实验室已证实PCA可抑制LPS损伤的VECs合成分泌TF,保护VECs,发挥抗凝作用[9]。因此,推测PCA减少TF的合成分泌,可能是通过抑制核因子的活化和TF基因的表达有关。根据前期实验的结果[10],本实验选取1.25 mg/L PCA作用于人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs),通过观察PCA对HUVECs活性、TRAF6活化、NF-κB p65、c-Fos、c-Jun蛋白及TF基因表达的影响,进一步探讨PCA减少TF分泌的机制。
材 料 和 方 法
1 材料与仪器
皖南五步蛇蛇毒PCA组份由皖南医学院蛇毒研究所提供;DMEM完全培养基和PBS缓冲液(Thermo);0.25%胰蛋白酶-0.02% EDTA、青霉素-链霉素双抗、BCA蛋白浓度测定试剂盒、RIPA裂解液、彩色预染蛋白质分子量标准、SDS-PAGE凝胶试剂盒、Western blot半干转膜液、超敏ECL发光液和PMSF试剂(江苏碧云天);胎牛血清(杭州四季青公司);SDS-PAGE蛋白上样缓冲液(5×)和DAB显色试剂盒(博士德);LPS、MTT和DMSO(Sigma); 本实验所用I抗(Abcam);引物(上海生工生物工程公司);PCR逆转录试剂盒和扩增试剂盒(TIANGEN);人TF因子ELISA试剂盒(上海源叶生物有限公司);其它试剂均为国产生化分析纯。超净工作台(上海三发科学仪器有限公司);5% CO2培养箱(Thermo);荧光倒置显微镜(Olympus);细胞计数仪(上海睿钰公司);恒温水浴箱(上海医用设备厂);酶标仪(Sunrise);电泳仪、半干转膜仪、qPCR仪和ChemiDoc XRS+凝胶成像系统(Bio-Rad)。
2 方法
2.1细胞培养与实验分组 HUVECs购自上海酶研生物科技有限公司,用含10%胎牛血清的高糖DMEM培养,取长满80%左右的HUVECs换液并进行传代,选取生长状态良好、形态正常的细胞用于实验。
实验分为空白对照(control)组、LPS组、PCA组和PCA+LPS组。空白对照组加入DMEM完全培养基,LPS组加入0.1 mg/L LPS,PCA组加入1.25 mg/L的PCA 溶液,PCA+LPS组加入1.25 mg/L PCA与0.1 mg/L LPS的混合液。各组均于药物作用12 h后进行后续实验。
2.2MTT法检测细胞活力 HUVECs接种于一次性96孔板中。待细胞贴壁生长状态良好时,各组加药。继续培养细胞12 h,于结束前4 h加入浓度为5 g/L的MTT溶液20 μL,放培养箱培养4 h后吸净细胞上清,每孔加入150 μL DMSO,水平摇床振荡摇匀10 min,在酶标仪上于490 nm处测定吸光度(A)值,计算细胞生长抑制率(inhibition ratio,IR)。生长抑制率(%)=(1-实验组平均A值/对照组平均A值)×100%。
2.3免疫组化法检测TRAF6蛋白在细胞中的分布 HUVECs接种于一次性6孔板中培养,各组加药。弃去培养液,依次加入4%多聚甲醛、0.5% TritonX-100及3%过氧化氢处理;吸去3%过氧化氢,加入试剂A液(封闭用正常山羊血清工作液),室温封闭;加入用PBS缓冲液稀释的 I 抗,4 ℃冰箱过夜。第2天从冰箱中取出6孔板,再依次加试剂B液(生物素化 II 抗工作液)和试剂C液(辣根酶标记链霉卵白素工作液)处理;去掉试剂C液,加入已配好的DAB工作液显色。加入苏木素溶液复染,充分水洗,加入1%盐酸乙醇脱色,水洗。梯度乙醇脱水,甩干,显微镜下观察,拍照。用Image-Pro Plus 6.0软件分析平均吸光度。
2.4Western blot检测细胞内NF-κB p65、c-Jun、c-Fos及TF蛋白的表达 选取生长状态良好的细胞,加药处理,冰上提取细胞蛋白并测蛋白浓度,按照比例加入蛋白上样缓冲液(5×),混匀煮沸以使蛋白变性,冷却至室温后放入-20 ℃冰箱保存备用。配胶、上样、电泳,电泳结束后切胶转膜。结束后,牛奶封闭,加 I 抗孵育,抗体孵育盒放入4 ℃冰箱过夜。第2天取出膜,加入稀释好的 II 抗,水平摇床上室温孵育2 h。洗膜后滴加ECL发光液,放置于凝胶成像显影仪中成像。最后用ImageJ软件分析条带灰度值。
2.5qPCR检测HUVECs的TF的mRNA表达 选取生长状态良好的细胞,加药处理,TRIzol试剂提取总RNA;打开NANO DROP2000分光光度计,测总RNA浓度及A260/A280比值。按试剂盒说明书操作,逆转录合成cDNA,再进行qPCR反应,配制20 μL qPCR反应体系,混匀,离心,将反应体系置于qPCR仪,设置反应条件: 50.0 ℃,2 min循环1次; 95.0 ℃ 5 min循环1次; 95.0 ℃ 15 s及60 ℃ 1 min,循环40次。β-actin的上游引物序列为5’-AGCGAGCATCCCCCAAAGTT-3’,下游引物序列为 5’-GGGCACGAAGGCTCATCATT-3’;TF的上游引物序列为5’-TGAAGGATGTGAAGCAGACG,下游引物序列为5’-GCCAGGATGATGACAAGGAT-3’。用2-ΔΔCt法分析mRNA的相对表达水平。
2.6ELISA法检测HUVECs培养上清液中TF的表达 选取合适的细胞,接种于一次性6孔板中培养,各组加药。收集各组细胞培养上清液。按ELISA试剂盒上的步骤进行操作,加样,孵育洗涤,显色,终止显色,在酶标仪上于450 nm处测定A值,制作标曲计算TF浓度。
3 统计学处理
用SPSS 18.0软件进行数据处理和统计分析。各组实验数据均采用均数±标准差(mean±SD)表示,组间差异用单因素方差分析,两两间比较采用SNK-q检验,以P<0.05表示差异有统计学意义。
结 果
1 PCA明显抑制LPS所致的HUVECs活力的变化
MTT法检测细胞活力,结果可见,LPS组细胞的A值与对照组比较显著下降,细胞活力降低(P<0.01);PCA组的A值与对照组比较差异无统计学意义;PCA+LPS组与LPS组比较,细胞A值大于LPS组,细胞活力上升(P<0.05),见表1。
2 HUVECs中TRAF6蛋白的分布
免疫组化实验结果显示,对照组HUVECs呈梭形,边界清晰,胞质内黄染颗粒不明显;LPS组细胞胞质内出现明显的黄染颗粒,胞质染色加深,TRAF6 平均吸光度值升高,与对照组比较差异有统计学意义(P<0.01);而LPS+PCA组与LPS组比较,细胞形态正常,胞质黄染颗粒不明显,TRAF6平均吸光度明显小于LPS组(P<0.01),见图1、表1。
表1PCA逆转LPS所致的HUVECs活力的变化和TRAF6蛋白的表达
Table 1. PCA reversed LPS-induced changes of HUVECs viability and protein expression of TRAF6 (Mean±SD.n=8)

GroupMTTAIR(%)TRAF6expressionControl0.554±0.051—0.014±0.002LPS0.401±0.047**31.200.057±0.000**PCA0.516±0.04411.740.017±0.002PCA+LPS0.476±0.049△14.000.024±0.004△△
**P<0.01vscontrol;△P<0.05,△△P<0.01vsLPS.
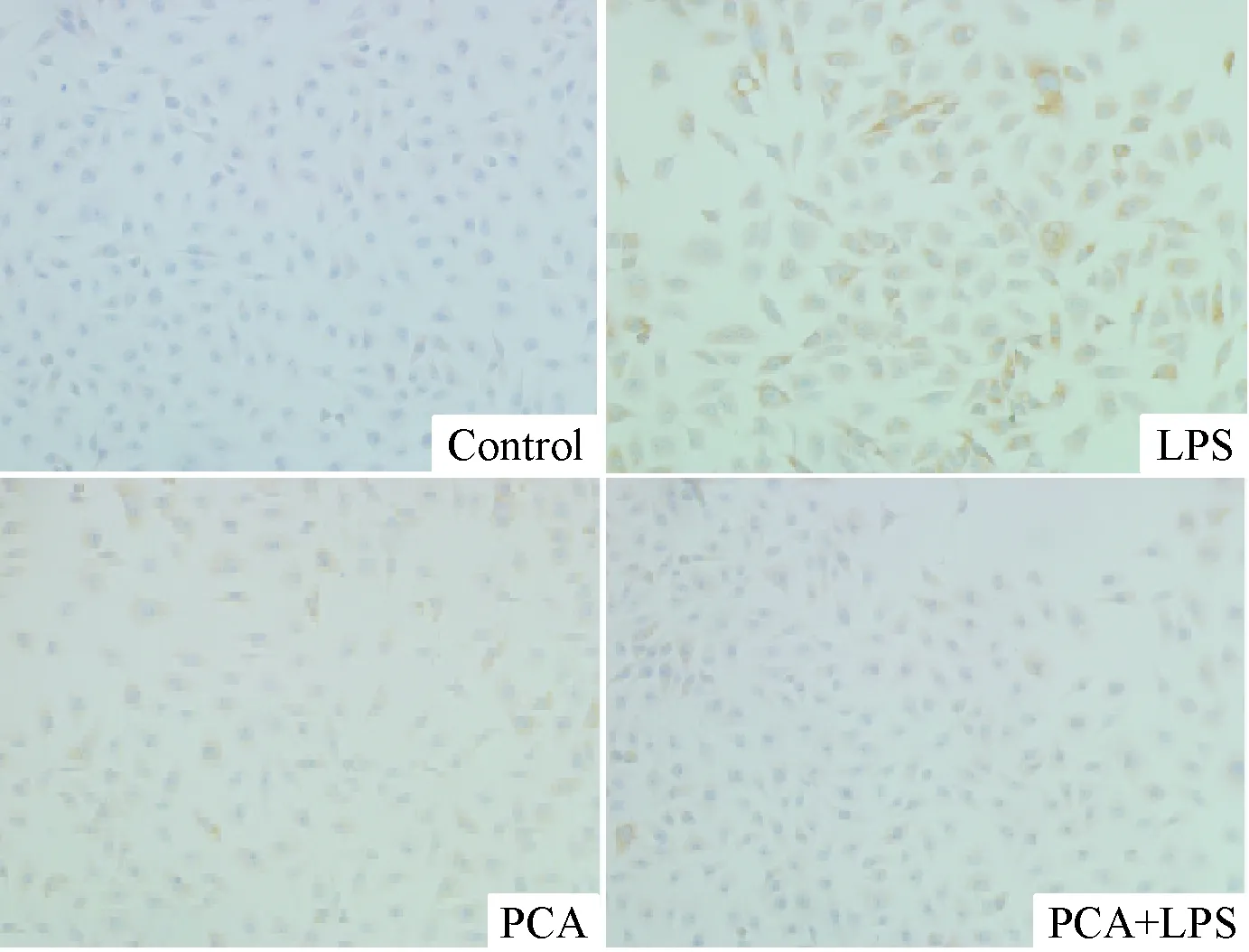
Figure 1. Distribution of TRAF6 protein in the HUVECs (×200).
图1HUVECs中TRAF6蛋白的分布
3 HUVECs胞内NF-κB p65、c-Jun及c-Fos蛋白的表达
Western blot结果显示,与对照组相比,LPS组中NF-κB p65、c-Jun和c-Fos的蛋白表达均明显增加(P<0.01);PCA+LPS组3种蛋白的表达则明显低于LPS组(P<0.01),见图2。
4 PCA对HUVECs损伤时TF mRNA及蛋白表达的影响
qPCR检测结果可见,与对照组比较,LPS组TF的mRNA表达明显增加(P<0.01);PCA组与对照组比较差异无统计学显著性;PCA+LPS组与LPS组比较,TF的mRNA表达明显减少(P<0.01),见图3。Western blot检测TF蛋白的结果可见,与对照组相比,LPS组TF蛋白表达明显增加(P<0.01),而PCA组的比值无显著变化;PCA+LPS组蛋白表达则明显低于LPS组(P<0.01),见图4。ELISA法检测细胞培养上清液中TF表达量可见,与对照组相比,LPS组TF的表达量明显增加(P<0.01),而PCA组的值无显著变化;PCA+LPS组TF值则明显低于LPS组(P<0.01),见图5。

Figure 2. The results of Western blot for protein expression of NF-κB p65, c-Jun and c-Fos. Mean±SD.n=3.**P<0.01vscontrol;△△P<0.01vsLPS.
图2NF-κBp65、c-Jun和c-Fos蛋白的Westernblot结果

Figure 3. The effect of PCA on the mRNA expression of TF in the HUVECs. Mean±SD.n=3.**P<0.01vscontrol;△△P<0.01vsLPS.
图3PCA对HUVECs损伤时TFmRNA表达的影响
讨 论
生理状态下VECs不表达TF,但病变的血管内皮细胞高表达TF,引起血液高凝状态,导致病理性血栓形成[11]。不同刺激诱导内皮细胞TF的表达涉及不同的信号。可以引起内皮细胞表达TF的刺激因子包括细胞因子(TNF-α、IL-1、IL-8)、LPS、生长因子(VEGF、FGF)[12]和缺氧等。现已知涉及到诱导TF表达的信号转导关键酶有很多,它们介导相同或不同的信号途径,但不管如何都认为p44/42 MAPK、p38 MAPK以及转录因子Egr-1、NF-κB、AP-1的激活对诱导TF是必需的[13]。
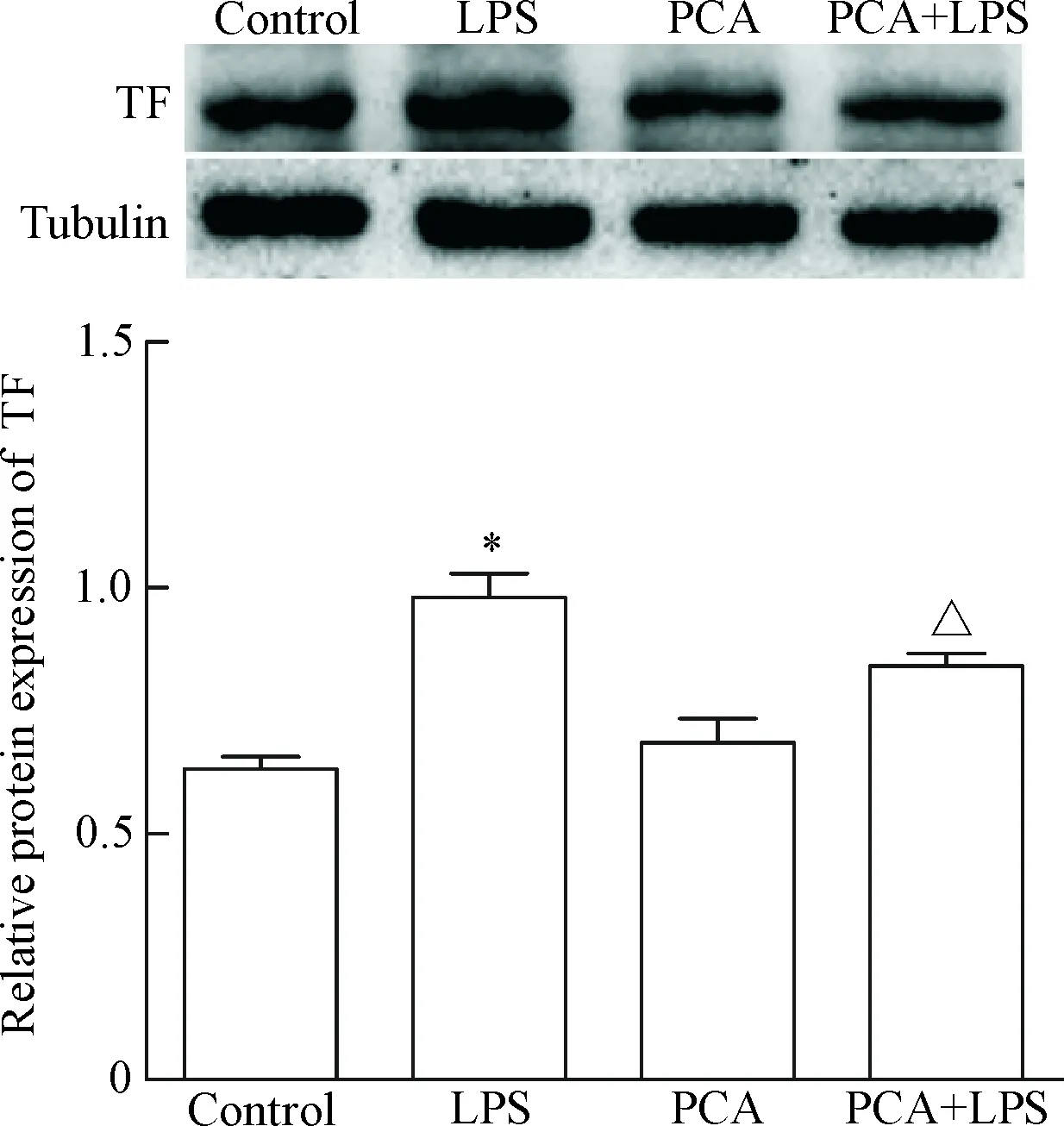
Figure 4. The result of Western blot for protein expression of TF. Mean±SD.n=3.*P<0.05vscontrol;△P<0.05vsLPS.
图4TF蛋白的Westernblot结果
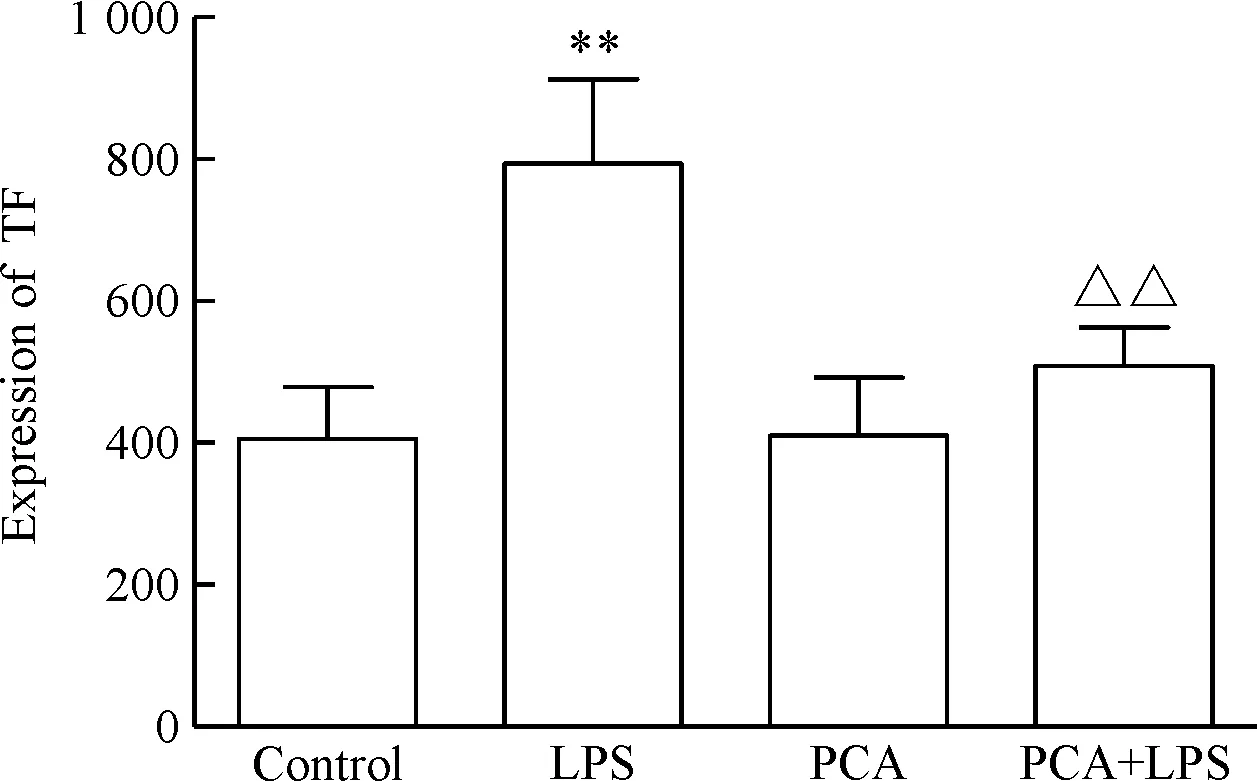
Figure 5. PCA reduces the TF expression in HUVECs culture supernatants. Mean±SD.n=8.**P<0.01vscontrol;△△P<0.01vsLPS.
图5PCA减少LPS诱导的HUVECs培养上清中TF表达
本实验室将PCA用于心血管疾病的研究,证实了PCA可改善LPS引起的大鼠心肌损伤,抑制大鼠微血栓的形成,对血栓性疾病发生发展的重要环节——VECs损伤有抑制作用,减少损伤的VECs合成分泌TF[14]。这些实验提示了PCA可抑制VECs分泌TF,发挥抗凝作用,但具体如何抑制TF的合成分泌机制还不明确。实验通过MTT法检测发现PCA+LPS实验组细胞活性明显大于LPS组,可见PCA对HUVECs具有一定的保护作用。TF的表达是通过细胞内的TRAF6泛素化后激活核转录因子诱导的。TRAF6是细胞内多功能的信号转导分子,是激活NF-κB通路和MAPK信号通路(TRAF6/JNK/AP-1途径)的交叉点[15]。NF-κB和AP-1是细胞中普遍存在的转录因子,介导细胞内信息传递,可调控多种细胞因子的基因表达。细胞处于静息状态时,这2种转录因子活性极低或被抑制,但当受到外界刺激时(如TNF-α、IL-1、LPS等),它们就会迅速被激活,启动基因的转录[16-17]。本实验显示PCA+LPS实验组TRAF6 平均光密度明显小于LPS组,TRAF6活化被抑制,NF-κB p65、c-Jun和c-Fos 3种蛋白的表达也被抑制,同时TF mRNA、蛋白在细胞培养上清液中含量均明显少于LPS组。蛋白的表达主要是靠基因调控[18]。因此得出,PCA可减轻LPS引起的HUVECs损伤,是通过抑制TRAF6、NF-κB及AP-1核转录因子的活化来抑制TF基因的表达,从而减少组织因子的释放。
[参 考 文 献]
[1] 张根葆, 陈冬云, 周志泳, 等. 蝮蛇毒蛋白C 激活物的纯化与抗血小板活性[J].皖南医学院学报, 2005, 24(1):8-10.
[2] 洪 流, 张家明, 陈华英, 等. D-二聚体含量检测在血栓性疾病中的临床应用[J]. 卫生职业教育, 2017, 35(20):96-97.
[3] Hoffman M, Chang JY, Ezban M, et al. An activated factor VII variant with enhanced tissue factor-independent activity speeds wound healing in a mouse hemophilia B mo-del [J]. J Thromb Haemost, 2016, 14(6):1249-1254.
[4] Balia C, Petrini S, Cordazzo C, et al. High glucose potentiates and renin-angiotensin blockade downregulates LPS-induced tissue factor expression in human mononu-clear cells [J]. Thromb Res, 2012, 130(3):552-556.
[5] Biedroń R, Peruń A, Józefowski S. CD36 differently regulates macrophage responses to smooth and rough lipopolysaccharide [J]. PLoS One, 2016, 11(4):e0153558.
[6] 胡文君, 张 振, 戴 敏. 丹皮酚通过抑制 PI3K/AKT-NF-κB通路对 LPS 诱导的与平滑肌细胞共培养的大鼠血管内皮细胞的保护作用[J]. 中国中药杂志, 2016, 41(12):2298-2302.
[7] Karim ZA, Vemana HP, Khasawneh FT. MALT1-ubiqui-tination triggers non-genomic NF-κB/IKK signaling upon platelet activation[J]. PLoS One, 2015, 10(3):e0119363.
[8] Mackman N. Regulation of the tissue factor gene[J]. Thromb Haemost, 1997, 78(1):747-754.
[9] 桑金凤, 张根葆, 周淑艳, 等. 尖吻蝮蛇毒PCA对HUVECs活性的影响[J].中国实验血液学杂志, 2017, 25(2):572-576.
[10] 桑金凤, 张根葆, 周淑艳. 尖吻蝮蛇毒PCA对人脐静脉血管内皮细胞的影响[J]. 皖南医学院院报, 2015, 34(5):409-415.
[11] 邓华菲, 李 坚, 周 琴, 等. PI3K/Akt/eNOS信号通路在葛根素抑制ox-LDL诱导的血管内皮细胞组织因子表达中的作用[J]. 中国病理生理杂志, 2017, 33(7):1214-1218.
[12] Chan EL, Haudek SB, Giroir BP, et al. Human coronary endothelial cell activation by endotoxin is characterized by NF-κB activation and TNF-α synthesis[J]. Shock, 2001, 16(5):349-354.
[13] Matschurat S, Blum S, Mitnacht Kraus R, et al. Negative regulatory role of PI3-kinase in TNF-induced tumor necrosis[J]. Int J Cancer, 2003, 107(1):30-37.
[14] 李 曙, 张根葆, 洪 云, 等. 蛇毒PCA 改善冠脉微血栓大鼠血液流变学的机制研究[J]. 中国病理生理杂志, 2012, 28(4):595-600.
[15] 徐 源, 王中群, 仲 威, 等. CD137-CD137L信号通过TRAF6/JNK/AP-1通路调控小鼠血管平滑肌细胞活化T细胞核因子c1表达[J]. 中国动脉硬化杂志, 2017, 25(1):7-12.
[16] Nakatsu F, Hase K, Ohno H. The role of the clathrin adaptor AP-1: polarized sorting and beyond[J]. Membranes (Basel), 2014, 4(4):747-763.
[17] Pateras I, Giaginis C, Tsigris C, et al. NF-κB signaling at the crossroads of inflammation and atherogenesis: sear-ching for new therapeutic links[J]. Expert Opin Ther Targets, 2014, 18 (9):1089-1101.
[18] Li S, Ren J, Xu N, et al. MicroRNA-19b functions as potential anti-thrombotic protector in patients with unstable angina by targeting tissue factor[J]. J Mol Cell Cardiol, 2014, 75:49-57.
