芥子碱对H2O2诱导BMSCs成脂分化的影响*
2018-05-17黄炜平刘爱军陈东风王洪琦
黄炜平, 李 可, 刘爱军, 陈东风, 王洪琦
(广州中医药大学基础医学院, 广东 广州 510006)
《中国居民营养与慢性病状况报告》指出近十年来居民膳食脂肪功能比超过30%,由肥胖引起的一系列严重合并症如高血压病和胰岛素抵抗等对人类的健康构成了严重的威胁。肥胖是由于脂肪细胞的数量增多和体积增大所致,而脂肪细胞已被证实来源于骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)。BMSCs是一类来源于中胚层的具有多向分化潜能的干细胞,具有高度的增殖能力,易纯化,均一性好,又因其低免疫源性和可移植性,被认为是组织工程学的种子细胞,在细胞移植和基因治疗方面得到广泛关注[1-2]。近年来研究发现,中药在调控BMSCs成脂分化中发挥积极作用[3-6],芥子碱(sinapine)作为轻身药莱菔子的有效成分,对BMSCs成脂分化的作用尚未见到相关报道。考虑氧化应激会增加不正常脂肪细胞的形成进而加大肥胖的发生率[7-8],因而本实验采用低浓度过氧化氢(hydrogen peroxide,H2O2)诱导BMSCs成脂分化作为模型,旨在探讨中药单体芥子碱对氧化应激引起BMSCs向脂肪细胞分化的影响,进一步了解芥子碱的药理作用。
材 料 和 方 法
1 实验材料与仪器
SPF级雄性SD大鼠购自广州中医药大学实验动物中心,动物许可证号:SCXK(粤)2013-0034, 使用程序符合《广州中医药大学实验动物伦理委员会章程》。
芥子碱硫氰酸盐购自广东省药品检验所(编号62.111702,CAS No.: 7431-77-8);DMEM低糖培养基、PBS、胎牛血清和0.25% EDTA-胰蛋白酶均购自Gibco;SD大鼠骨髓间充质干细胞专用培养基购自赛业生物科技有限公司; 抗CD29-FITC、CD44-FITC、CD45-PE-Cy5.5和CD90-PE流式抗体购自Abcam;CCK-8试剂盒购自Dojindo;油红O粉末购自Sigma;苏木素染色液由广州中医药大学张赛霞老师提供;30% H2O2购自天津市精细化学制剂厂;抗过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)抗体购自Santa Cruz;抗葡萄糖转运蛋白4(glucose transporter 4, Glut4)抗体购自Abclonal; 抗脂肪细胞蛋白2(adipocyte protein 2,aP2)抗体、 HRP标记的羊抗免IgG和HRP标记的羊抗鼠IgG均购自Abcam;抗β-actin抗体(货号M0627)购自博士德公司;引物购自上海生工;TRIzol总RNA抽提试剂、RevertAid First Strand cDNA Synthesis Kit和GeneRuler 100 bp DNA Ladder均购自Thermo Fisher;Talent qPCR PreMix(SYBR Green)购自Tiangen。
移液器(Eppendorf);CO2培养箱(Thermo 150i);倒置显微镜(Motic AE2000);流式细胞仪(BD);多功能酶标仪(EnSpire);图像分析系统(Olympus);紫外分光光度计(BioSpec-Nano);电泳转膜装置(Bio-Rad);PCR仪(Bio-Rad T100);荧光定量PCR仪(Bio-Rad CFX96);全自动化学发光图像分析仪(Tanno 5200)等。
2 方法
2.1大鼠BMSCs的获取 选取60~80 g健康雄性SD大鼠,乙醇浸泡15 min后采用颈椎脱位法处死大鼠,碘伏消毒手术暴露骨髓腔,用10 mL注射器抽吸含1%双抗的L-DMEM培养基反复吹打骨髓腔,吸取含骨髓的培养基于15 mL离心管常温离心(1 000 r/min)8 min,弃上清,获取细胞。所获取的BMSCs采用全骨髓培养法,将细胞用含10% FBS和1%抗生素的专用完全培养基培养于5% CO2、37 ℃培养箱中,24 h后半量换液,96 h后全量换液,此后每隔2~3 d换液。每天在倒置显微镜下观察细胞生长情况以及有无污染等并拍照。
2.2鉴定BMSCs表面标志物 待P3细胞长至融合90%左右,常规消化细胞并离心(1 000 r/min) 8 min,弃上清。预冷PBS洗涤2遍并离心弃上清,500 μL PBS重悬细胞(此时细胞数至少为1.0×106以上),实验分为空白对照组、同型对照组和实验组。每个流式管中分别吸取细胞悬液50 μL并加入不同标记抗体5 μL。室温避光孵育30 min,2 mL PBS溶液洗涤2遍以除去未结合抗体。离心后垂直倒掉上清液,分别用200 μL PBS重悬细胞,上流式细胞仪进行检测分析。实验重复3次,用FlowJo 7.6软件分析数据。
2.3CCK-8法检测芥子碱对BMSCs的毒性作用 取对数生长期BMSCs(P3)按照细胞密度每孔4.0×103接种于96孔板,待细胞融合70% 以上,弃细胞培养基,加入含药芥子碱的条件培养基,设置浓度梯度为5、10、20、40、80、160和320 μmol/L,同时设单细胞悬液不加药物的正常对照(normal control)组及无细胞培养液的空白对照(blank control)组。孵育24 h后弃培养基,每孔加入10 μL CCK-8溶液和100 μL新鲜完全培养基,混匀后置于5% CO2、37 ℃培养箱中孵育2 h后,多功能酶标仪于490 nm处检测吸光度,实验重复3次,每组6个复孔。
2.4BMSCs成脂分化模型的建立和实验分组设计 实验中模型的建立参照文献[9-10]并作修改,选取生长状态良好的BMSCs,待其生长融合85%左右,采用含H2O2无血清培养基(终浓度200 μmol/L)诱导BMSCs 1 h之后弃诱导液,更换成条件培养基。整体实验设计分组如下:正常对照(control)组、H2O2模型(model)组和芥子碱(sinapine)组。模型组和芥子碱组用无血清培养基稀释H2O2进行成脂分化诱导,同时正常对照组加上相同体积的无血清培养基统一条件。1 h后正常对照组和模型组更换成完全培养基,芥子碱组换成含药培养基,置于5% CO2、37 ℃培养箱中继续培养24 h后进行检测。
2.5油红O染色实验及半定量分析 按照每孔1.0×105的密度将细胞接种于24孔板中,孵育结束后弃去培养基,PBS洗涤3次,4%多聚甲醛固定20 min。弃固定液,PBS洗2遍,每孔加入适量60%异丙醇,室温放置5 min。完全弃掉异丙醇,每孔加入300 μL 60%油红O工作液,室温放置25 min。快速去掉油红染料,60%异丙醇速洗1遍,双蒸水洗3遍。弃双蒸水,苏木素染色15 s 后弃染色液,自来水洗3~4遍,甘油明胶封片。在图像分析系统下观察并随机选取5个视野拍摄照片。半定量分析不进行苏木素染色,油红染色结束并洗去多余染料后加入300 μL 100%异丙醇,在摇床中放置10 min,使细胞内的油红充分溶解,用移液器吸50 μL混合液于96孔板中,同时设立阴性对照组,多功能酶标仪于570 nm处检测吸光度,实验重复3次,每组5个复孔。
2.6Western blot测PPARγ、aP2和Glut4的蛋白表达 弃旧液,预冷PBS洗2遍,加入适量裂解液(RIPA∶PMSF=100∶1)用刮刀收集细胞于1.5 mL EP管中,冰上裂解30 min,超声5 min,离心(12 000 r/min)15 min,取上清,BCA蛋白定量将样品浓度调整一致后煮沸变性。蛋白样品30~50 μg于10%分离胶中电泳(条件为80 V 30 min、120 V 60 min);湿转(条件为300 mA 80 min)于PVDF膜上。室温封闭 2 h,I 抗4 ℃过夜或者室温孵育2 h;TBST洗脱6次,每次5 min, 加入II抗室温孵育1 h;TBST洗脱6次,每次5 min, 后曝光。所有抗体用5% BSA稀释,比例参照说明书。ECL化学发光工作液配合天能全自动化学发光图像分析仪曝光条带。应用ImageJ图像分析软件分析各组条带灰度值后进行统计学分析。
2.7qPCR法检测PPARγ、aP2和Glut4的mRNA表达 采用经典TRIzol-氯仿的方法抽提总RNA,检测浓度和纯度后,取1 μg进行逆转录合成第一链cDNA,具体方法按照说明书操作。逆转录条件为 65 ℃ 反应5 min,结束后置于冰上,此后是42 ℃ 反应60 min,升温至70 ℃ 反应5 min,降温至4 ℃。qPCR采用一步法,具体操作参照说明书。反应体系为15 μL。反应条件为95 ℃预变性反应3 min; 95 ℃变性反应5 s、60 ℃退火/延伸反应15 s,采集荧光信号并循环40次,最后绘制熔解曲线。采用2-ΔΔCt法分析统计各基因表达差异。引物序列见表1。

表1 qPCR的引物序列
3 统计学处理
所有数据输入Excel 2016、SPSS 20、GraphPad Prism 7统计软件进行整理和统计作图,以均数±标准差(mean±SD)表示,样品多组间比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 BMSCs的形态学观察及流式细胞术鉴定
倒置显微镜下观察体外分离所培养的原代大鼠BMSCs,P0和P1细胞混杂造血干细胞,经过换液传代,镜下观察细胞贴壁速度较快,呈现成纤维细胞外观,大部分为梭形,见图1A;随着传代次数增加,细胞形态、排列趋于一致,大量扩增后可见漩涡状排列,见图1B。流式细胞术检测第3代BMSCs,结果显示BMSCs高表达CD29、CD44和CD90,低表达CD45,其阳性率分别为99.79%、89.77%、99.41%和3.76%,证明按照上述方法培养BMSCs,至第3代细胞纯度较高,未见分化,可用于下一步实验,见图1C。
2 CCK-8法检测芥子碱对BMSCs的毒性作用
不同浓度的芥子碱对BMSCs作用24 h后对细胞活性有不同的影响。结果提示当药物浓度<40 μmol/L,芥子碱对BMSCs的活力影响较小;当药物浓度>40 μmol/L,随着芥子碱药物浓度的升高,BMSCs的活力明显被抑制(P<0.01),见图2A。在此基础上,对药物芥子碱低浓度范围内再次进行CCK-8实验,结果显示与正常对照组比较,浓度为15 μmol/L时,芥子碱对BMSCs的活力影响最小,见图2B。为确定芥子碱对BMSCs成脂分化的最佳有效浓度,选取5 μmol/L、10 μmol/L、20 μmol/L和40 μmol/L 4个浓度进行油红O半定量实验。
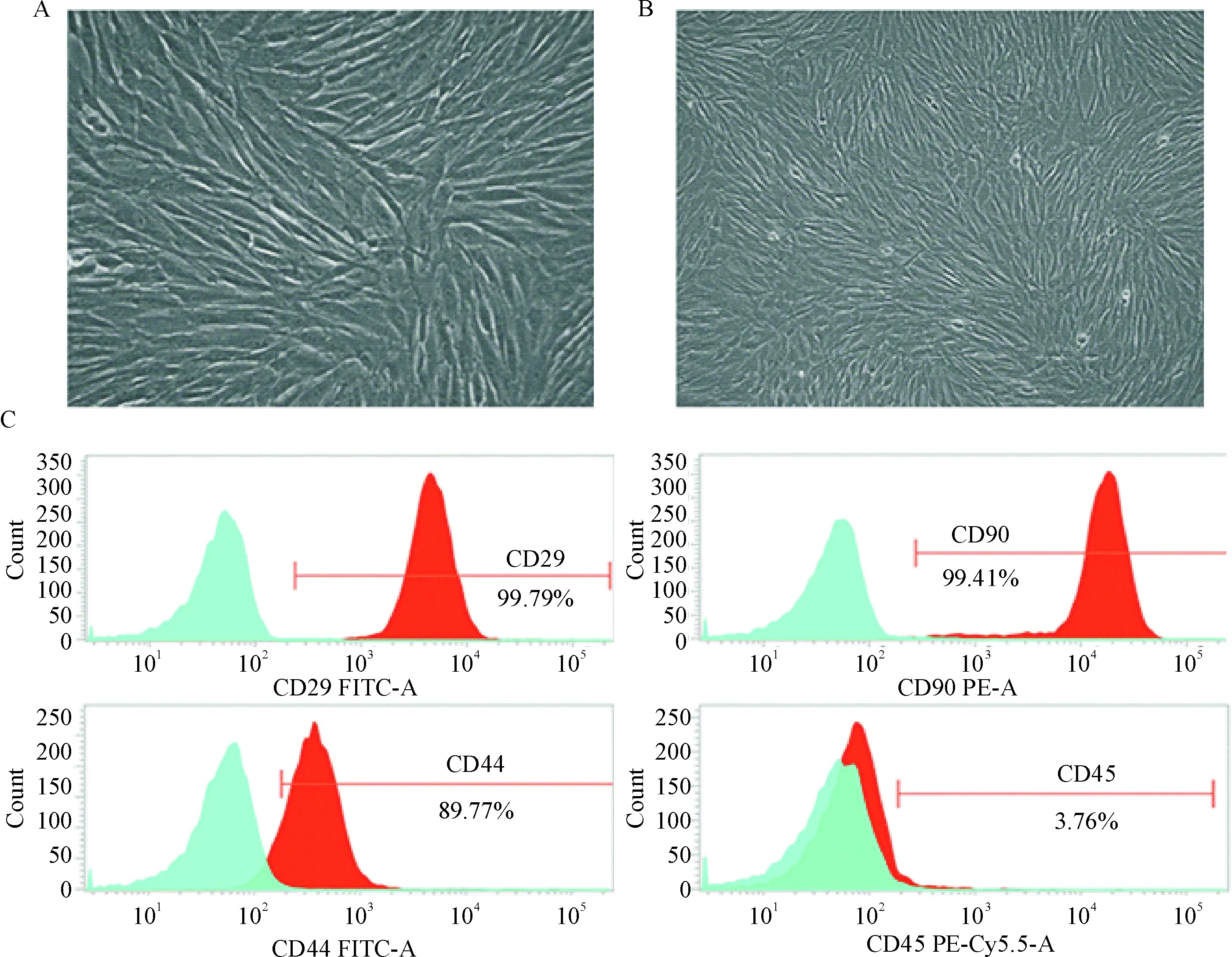
Figure 1. Culture and identification of BMSCs. A: BMSCs, P3 (×200); B: large numbers of expanded BMSCs, P3 (×100); C: flow cytometric analysis.
图1骨髓间充质干细胞的培养与鉴定

Figure 2. The toxicity of sinapine at different concentrations on the BMSCs. A: high concentration range; B: low concentration range. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group.
图2CCK-8法检测不同浓度芥子碱硫氰酸盐对BMSCs的毒性作用
3 油红O半定量及染色实验分析H2O2及芥子碱对BMSCs的影响
油红O半定量结果显示,H2O2模型组与正常对照组比较吸光度增加,提示H2O2明显促进BMSCs成脂分化,脂滴含量明显较多;而与模型组比较,随着芥子碱药物浓度的增加,BMSCs成脂分化的趋势明显受到抑制,见图3A。结合CCK-8实验结果,最终选取芥子碱浓度15 μmol/L进行实验。另外油红O染色结果显示,相对于正常未分化的BMSCs,经过H2O2诱导1 h后,包绕在细胞核周围的脂滴数量明显增多,更为直观地提示H2O2可促进BMSCs成脂分化;而药物芥子碱浓度15 μmol/L作用细胞24 h后脂滴数量明显减少,提示芥子碱抑制由H2O2诱导的BMSCs成脂分化过程,见图3B。

Figure 3. Oil Red O assay. A: the optimum and effective concentration of sinapine was selected by Oil Red O semi-quantitative assay; B: observation of the effect of sinapine at 15 μmol/L on the adipogenic differentiation of BMSCs induced by H2O2(×400). Mean±SD.n=6.*P<0.05vscontrol group;##P<0.01vsmodel group.
图3油红半定量及染色实验结果
4 芥子碱对H2O2诱导BMSCs成脂分化过程中PPARγ、aP2和Glut4的影响
以aP2、PPARγ和Glut4的表达情况来分析芥子碱作用于BMSCs 24 h后对其成脂分化的影响。Western blot结果显示相对于正常对照组,H2O2模型组中aP2、PPARγ和Glut4的蛋白表达水平均升高(P<0.01);而相比较H2O2模型组,芥子碱降低aP2、PPARγ和Glut4的表达(P<0.05),见图4A。qPCR结果同样显示在转录层面,H2O2模型组中aP2、PPARγ和Glut4基因的mRNA水平明显高于正常对照组(P<0.01)和加药芥子碱组(P<0.01),其中对PPARγ的转录调控最为明显,见图4B。Western Blot和qPCR结果均提示芥子碱能够降低H2O2诱导的BMSCs中脂肪分化相关蛋白的表达。
讨 论
1 H2O2可以促使BMSCs向脂肪细胞分化
肥胖会增加患心脏病、中风和糖尿病等疾病的风险,有资料明确表明氧化应激、肥胖和脂肪细胞这三者之间关系密切,氧化应激的增加会加速脂肪的累积进而引发代谢综合征,因而脂肪组织中的氧化还原状态是肥胖相关代谢综合征的一个潜在治疗靶点[10]。基于此,本研究利用H2O2创造氧化应激环境以促进BMSCs成脂分化作为模型。前期已有文献报道低浓度H2O2诱导1 h对BMSCs增殖没有影响[11],而后续补充的油红O、qPCR以及Western blot实验结果证明该模型的可行性。
2 芥子碱可以抑制BMSCs成脂分化,可能与其能够抑制脂质过氧化反应相关
中医理论认为肥胖之人身重气虚,不良于行,因而中药的功效中有了“轻身”这一词。莱菔子最早见于《日华子本草》,是十字花科植物莱菔的成熟种子,为健脾轻身药的一种,有降气化痰和消食除胀之功。现代药理研究发现芥子碱广泛存在于十字花科植物中,其在自然界常与有机酸结合成盐的形式存在,其中以芥子碱硫氰酸盐的形式存在最为广泛。芥子碱具有抗氧化、抗辐射、抗衰老、抗增殖、抗凋亡、降血压及促进肠胃蠕动等作用[12-18]。又有研究表明芥子碱硫氰酸盐作为莱菔子水溶性生物碱的主要成分,能够提高高密度脂蛋白胆固醇的含量,进而增强血脂代谢能力[19-20]。本实验通过检测不同浓度的芥子碱作用于细胞24 h后的光吸收度,结果提示芥子碱在浓度<40 μmol/L条件下对BMSCs几乎没有毒性,对其增殖抑制没有显著影响;随后采用H2O2诱导BMSCs成脂分化作为模型,通过油红O半定量及染色实验又发现芥子碱组脂滴数量减少,光吸收度降低,细胞形态逐渐呈纤维状。提示芥子碱能够逆转氧化反应形成的脂质化,明显抑制BMSCs向脂肪细胞方向分化。

Figure 4. The effects of sinapine on the expression of aP2, PPARγ and Glut4 at mRNA and protein levels in H2O2-induced BMSCs. A: Western blot for determining the relative protein expression of aP2, PPARγ and Glut4 in the BMSCs (n=4); B: qPCR for detecting the relative mRNA expression of aP2, PPARγ and Glut4 in the BMSCs (n=3). Mean±SD.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图4芥子碱硫氰酸盐对H2O2诱导BMSCs成脂分化过程中aP2、PPARγ和Glut4表达的影响
芥子碱结构的苯环带有羟基可形成化合物酚,酚类化合物具有清除氧自由基抗氧化作用,近年来有研究揭示芥子碱是一种非常有价值的天然抗氧化剂。人类疾病中如肿瘤、血管硬化及衰老等现象都涉及脂质过氧化作用,生物碱降血脂一般通过提高高密度脂蛋白胆固醇含量、抑制脂质过氧化、增强抗氧化酶活性等途径降低血脂[21],因而我们推测芥子碱亦可能是通过上述途径抑制BMSCs成脂分化。
3 芥子碱可以抑制BMSCs成脂分化,其机制或与AMPK和PPARγ信号通路有关
BMSCs具有多向分化潜能,给予适当的条件,细胞便可以定向分化,本研究通过流式细胞鉴定术可以鉴定原代BMSCs培养至第3代,其纯度高且细胞未分化。有研究报道,在完全分化的脂肪细胞中,PPARγ即使被敲低细胞仍然能保留其脂肪细胞的表型,表明在完全分化的脂肪细胞中,PPARγ可能不是维持脂肪细胞表型的必要条件,另外通过双重siRNA干扰方法,发现了PPARγ功能的缺失正是由Glut4和Glut1介导引起的[22]。除此之外有实验通过构建shRNA腺病毒载体靶向PPARγ基因,发现该载体能够有效阻断BMSCs或者3T3-L1等未完全分化细胞内PPARγ mRNA表达进而抑制其成脂分化,并且Glut4的表达亦有下调[23]。也有研究发现在早期未分化的BMSCs中可观察到PPARγ与C/EBPα关系密切,同时介导aP2的转录并互为正反馈调控促进BMSCs成脂分化[24-25]。在本次研究中发现芥子碱对BMSCs成脂分化的一些关键基因的表达具有影响。Western blot和qPCR提示与正常未分化的BMSCs相比,芥子碱组中aP2、PPARγ和Glut4表达量变化不一致,但明显低于模型组。
将PPARγ、aP2和Glut4通过蛋白富集分析发现,Glut4位于AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路,aP2位于PPARγ信号通路,三者均是BMSCs成脂分化中的关键转录因子,主要功能体现在正向调控棕色脂肪细胞的分化[26]。早期有报道AMPK与PPARγ信号通路在3T3-L1细胞成脂分化中存在相互交叉的关系,共同调节脂肪细胞的形成[27]。芥子碱能够抑制BMSCs成脂分化,其机制可能与AMPK和PPARγ信号通路有关。
综上所述,本研究采用低浓度H2O2诱导BMSCs建立成脂分化细胞模型,芥子碱作用于该模型可明显抑制BMSCs向脂肪细胞分化,但其具体机制尚未明确,上述两种推测有待进一步实验证明。
致谢:流式细胞术检测由中山大学孙逸仙纪念医院流式细胞室工作人员完成,感谢科室老师的帮助!
[参 考 文 献]
[1] Schrepfer S, Deuse T, Lange C, et al. Simplified protocol to isolate, purify, and culture expand mesenchymal stem cells[J]. Stem Cells Dev, 2007, 16(1):105-107.
[2] Phinney DG, Pittenger MF. Concise review: MSC-derived exosomes for cell-free therapy[J]. Stem Cells, 2017, 35(4):851-858.
[3] 张志峰, 陈 嘉, 叶伟洪, 等. 壮骨强筋片含药血清对老年大鼠骨髓基质干细胞成脂分化的影响[J]. 广州中医药大学学报, 2013, 30(3):352-356.
[4] 程志安, 韩 凌, 危建安, 等. 六味地黄丸、金匮肾气丸及健骨二仙丸含药血清对BMSCs成脂、成骨细胞分化相关基因的影响[J]. 中国中西医结合杂志, 2013, 33(2):261-265.
[5] 齐振熙, 李树强, 于 涛. 土鳖虫含药血清干预骨髓间充质干细胞的成脂分化[J]. 中国组织工程研究, 2013, 17(14):2597-2602.
[6] 齐振熙, 张占勇, 万 甜, 等. 葛根素干预激素诱导骨髓间充质干细胞成脂分化的Wnt信号途径[J]. 中国组织工程研究, 2014, 18(10):1502-1507.
[7] Kanda Y, Hinata T, Kang SW, et al. Reactive oxygen species mediate adipocyte differentiation in mesenchymal stem cells[J]. Life Sci, 2011, 89(7-8): 250-258.
[8] Turker I, Zhang Y, Zhang Y, et al. Oxidative stress as a regulator of adipogenesis[J]. FASEB J, 2007, 21(6): A1053.
[9] 张 娅, 陈民佳, 朱 明, 等. 低浓度H2O2预处理增强骨髓间充质干细胞活力[J]. 基础医学与临床, 2016, 36(3):342-347.
[10] Furukawa S, Fujita T, Shimabukuro M, et al. Increased oxidative stress in obesity and its impact on metabolic syndrome[J]. J Clin Invest, 2004, 114(12):1752-1761.
[11] 周健洪, 黎 晖, 宋述财, 等. 过氧化氢对骨髓间充质干细胞增殖活性的影响[J]. 广东医学, 2005, 26(9): 1199-1200.
[12] Li X, Han L, Li Y, et al. Protective effect of sinapine against hydroxyl radical-induced damage to mesenchymal stem cells and possible mechanisms[J]. Chem Pharma Bull, 2016, 64(4): 319-325.
[13] 黄德娟, 徐巍越, 黄德超. 花椰菜芥子碱对果蝇辐射的保护作用[J]. 营养学报, 2009, 31(6):588-590.
[14] 李 群, 顾瑞琦. 十字花科植物中的芥子碱对果蝇的抗衰老作用[J]. 应用与环境生物学报, 1999, 5(1): 32-35.
[15] Guo Y, An H, Feng L, et al. Sinapine as an active compound for inhibiting the proliferation of Caco-2 cells via downregulation of P-glycoprotein[J]. Food Chem Toxicol, 2014, 67(5):187-192.
[16] Yang CY, He L. Neuroprotective effects of sinapine on PC12 cells apoptosis induced by sodium dithionite[J]. Chin J Nat Med, 2008, 6(3):205-209.
[17] 丁 韵, 卢 轩, 王惠国, 等. 芥子碱氯化盐的制备及其对自发性高血压大鼠的降压作用[J]. 沈阳药科大学学报, 2013, 42(5):60-62.
[18] 朱立俏, 盛华刚, 周洪雷. 莱菔子水提液中芥子碱硫氰酸盐在大鼠小肠的吸收特性研究[J]. 中药新药与临床药理, 2014, 25(4):459-462.
[19] 张国侠, 盖国忠. 莱菔子总生物碱对Apo E基因敲除小鼠血脂的影响[J]. 中国老年学杂志, 2010, 30(6):844-845.
[20] 王 群, 孙忠迪, 刘 梅, 等. 炒莱菔子中芥子碱对高血脂大鼠血脂水平的影响[J]. 医学研究杂志, 2013, 42(5):60-62.
[21] 潘继勋. 中药有效成分降血脂作用研究进展[J]. 医药前沿, 2016, 6(13):17-19.
[22] Liao W, Nguyen MT, Yoshizaki T, et al. Suppression of PPAR-γ attenuates insulin-stimulated glucose uptake by affecting both GLUT1 and GLUT4 in 3T3-L1 adipocytes[J]. Am J Physiol Endocrinol Metab, 2007, 293(1):E219-E227.
[23] 冯志尉, 邓云平, 赵 慧, 等. shRNA干扰PPARγ基因表达预防兔激素性股骨头坏死的研究[J]. 成都医学院学报, 2017, 12(2):127-132.
[24] Payne VA, Au WS, Lowe CE, et al. C/EBP transcription factors regulateSREBP1cgene expression during adipogenesis[J]. Biochem J, 2009, 425(1):215-224.
[25] Nguyen TTN, Ha TT, Nguyen TH, et al. Peptide fraction pOh2 exerts antiadipogenic activity through inhibition of C/EBP-α and PPAR-γ expression in 3T3-L1 adipocytes[J]. Biomed Res Int, 2017, 2017:4826595.
[26] Li Y, Rong Y, Bao L, et al. Suppression of adipocyte differentiation and lipid accumulation by stearidonic acid (SDA) in 3T3-L1 cells[J]. Lipids Health Dis, 2017, 16:181.
[27] Jiang S, Wang W, Miner J, et al. Cross regulation of sirtuin 1, AMPK and PPARγ in conjugated linoleic acid treated adipocytes[J]. PLoS One, 2012, 7(11):e48874.
