人前列腺癌PC-3细胞系中肿瘤干细胞的富集、鉴定以及生物学特征的初步研究
2018-05-17冯杨焜徐新宇于得水冯宁翰包文平
汪 洋 冯杨焜 吴 岩 徐新宇 于得水 董 坚 冯宁翰 包文平
1.南京医科大学附属无锡第二医院泌尿外科(江苏无锡 214002);2.江苏省锡山高级中学;3.南通大学附属南通第三医院泌尿外科
前列腺癌是威胁男性健康的重要疾病。在美国,前列腺癌已经超越肺癌,成为男性发病率第一的肿瘤[1]。在中国,虽然前列腺癌的发病率远低于欧美地区,但是近年来发病率呈现明显的上升趋势[2]。目前前列腺癌主要依赖人前列腺特异性抗原(PSA)进行早期诊断[3,4]。然而前列腺癌早期症状不明显,缺乏特异性体征,导致患者就诊时往往已经进展至中晚期,只能进行内分泌保守治疗,多数患者病情进一步恶化,最终转为激素非依赖性肿瘤[5],发生复发、转移而预后不佳,迄今仍无有效的治疗方法。
肿瘤干细胞(cancer stem cell,CSC)是存在于肿瘤细胞系或肿瘤组织中的一小群特殊的细胞,具有自我更新、多向分化以及高致瘤性等特点[6],而且对化疗以及放疗具有高度抵抗[7,8],不易被常规治疗手段所根除,被认为是肿瘤形成的母细胞并能维持肿瘤不断生长,是肿瘤发生、进展、转移和复发的根源。起初,学者们认为CD44、CD133以及整合素α2β1可以作为分离前列腺癌的特异性标记物[9],随后人们又发现转运蛋白G超家族成员2(ABCG2)阳性的细胞具有前列腺癌干细胞特征[10],因此本研究通过流式细胞仪筛选出ABCG2阳性的PC-3 侧群(SP)细胞,利用体外功能实验研究SP细胞与NST细胞在生物学特征上的差异,探索SP细胞在前列腺癌发生、转移和与复发中扮演的角色。但是,由于其在总体肿瘤细胞中所占比例极低[10],实验研究中极难获得足够数量的前列腺癌干细胞,因此,寻找到简便而高效地富集前列腺癌干细胞的方法具有重要科学价值和现实意义。
材料与方法
一、实验材料
(一)细胞
人前列腺癌PC-3细胞系,购自中国科学院上海细胞库。
(二)试剂
胎牛血清(F B S)、表皮细胞生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)、无血清添加剂B27均购自美国GIBCO公司。牛血清白蛋白(BSA)、胰岛素、Hoechst 33342细胞核染料、PI染料、维拉帕米购自美国Sigma公司。反转录试剂盒购自美国Promega公司。实时定量 PCR试剂盒购自日本Takara公司。Anti-α-Tubulin MAb、Anti-VEGF mAb、 HRP 标记的羊抗鼠以及羊抗兔 IgG抗体购自美国Santa Cruz 公司。Anti-MMP7 mAb和Anti-ABCG2 mAb抗体购自美国Abcam公司。Transwell小室购自Millipore公司。Matrigel购自加拿大BD Biosciences公司。血管生成载玻片购自德国Ibidi公司。CCK8试剂盒购自日本同仁公司。
(三)仪器
流式细胞仪购自加拿大BD Biosciences公司,由南京医科大学分析测试中心提供。
二、实验方法
(一)PC-3细胞系悬浮聚球培养法
选择常规贴壁培养的,处于对数生长期的PC-3细胞株,用PBS 缓冲液洗涤2遍,随后利用含有0.2g/L EDTA的 胰蛋白酶对贴壁细胞进行消化,重悬于SFM培养液中,调整细胞密度为1×103/mL,然后接种于超低黏附的6孔板中,每个孔接种1×103个细胞,以SFM 培养液进行悬浮培养,每天摇动6孔板数次以阻止细胞贴壁。待细胞增殖形成显著团块后,收集于离心管中,待自然沉降30 min后小心弃去一半量的陈旧上清液,加入等量新鲜SFM 并缓慢机械吹打成单细胞悬液,再次重悬于SFM,继续在37 ℃、5% CO2细胞培养箱中培养。接种细胞后每隔3d在倒置显微镜下观察悬浮细胞球数目及形态。
(二)观察PC-3 细胞两种生长方式的转化
当PC-3 细胞在SFM 培养液中形成悬浮细胞球后, 收集并重悬于SSM 培养液中常规培养,待其呈单层细胞贴壁生长后,再次消化、收集并重悬于SFM培养液中,细胞可以再次形成悬浮细胞球。以上可重复多次。
(三)流式细胞学分选侧群细胞
以PC-3悬浮成球细胞为实验组,常规以含血清培养液(SSM)中单层贴壁培养的PC-3细胞为对照组;分别将两种细胞制备成单细胞悬液,调整细胞密度为1×106/mL, 分别设实验管及对照管。实验管加入Hoechst 33342(终质量浓度为5mg/L),对照管则先加入维拉帕米(终质量浓度为50μmol/L)孵育30 min,然后再加入Hoechst 33342(终浓度为5mg/L),37 ℃避光孵育90min,期间每15min振荡混匀1次,然后4℃低温离心5min,弃上清液,4 ℃预冷,PBS缓冲液洗涤2遍, 重悬于含体积分数为2% FBS 的PBS 中,加入PI 溶液(终质量浓度为1mg/L),冰上孵育30min。采用FACS 流式细胞仪(激发光350nm,采集波长为450nm和675nm)检测SP 细胞比率。
(四)Transwell小室细胞迁移实验检测SP 细胞迁移能力
胰酶消化细胞,终止消化后离心弃去培养液,用PBS洗1~2遍,用无血清培养基重悬。调整细胞密度至5×104/mL。取细胞悬液100μL加入Transwell小室。在24孔板下室中加入600μL含20% 血清的完全培养基。37 ℃、5% CO2细胞培养箱中常规培养12~24h,每隔6h收取24孔板中的Transwell小室,弃去孔中培养液,用无钙的PBS洗2遍,甲醇固定30min,将小室适当风干。0.1%结晶紫染色20 min,用棉签轻轻擦掉上层未迁移细胞,用PBS洗3遍。400倍显微镜下随机5个视野观察细胞,通过计数软件统计实验中进入下室的细胞数,从而获得两种细胞的迁移情况。
(五)Transwell小室细胞侵袭实验检测SP 细胞侵袭能力
采用BD公司的Matrigel按照1:8稀释,包被Transwell小室底部膜的上室面,置37℃培养箱孵育30min使Matrigel聚合成凝胶。使用前进行基底膜水化。
胰酶消化细胞,终止消化后离心弃去培养液,用PBS缓冲液洗1~2遍,用无血清培养基重悬。调整细胞密度至5×105/mL。取细胞悬液100μL加入Transwell小室。24孔板下室加入600μL含20% 血清的完全培养基。37 ℃、5% CO2细胞培养箱中常规培养12~48h,每隔6h收取24孔板中的Transwell小室,弃去孔中培养液,用无钙的PBS缓冲液洗2遍,甲醇固定30min,将小室适当风干。0.1%结晶紫染色20 min,用棉签轻轻擦掉上层未迁移细胞,用PBS缓冲液洗3遍。400倍显微镜下随机5个视野观察细胞,通过计数软件统计实验中进入下室的细胞数,从而获得两种细胞的侵袭情况。
(六)分析SP 细胞促血管生成能力
实验前一天将Matrigel置于冰盒中,放入4 ℃冰箱,使胶能过夜缓慢融化(同样要准备4 ℃预冷的枪头用于吸取Matrigel)。开始实验前,将Matrigel始终保持放在冰盒中。随后取出血管生成载玻片。每孔中加入10 μL Matrigel后盖上血管生成载玻片的盖子,放入37 ℃培养箱中,静置30min左右,等待胶凝结。胰酶消化人脐静脉内皮细胞(HUVEC),准备密度为2×105/mL的细胞悬液,充分混匀。每孔加入50 μL的细胞悬液(即每孔种104个细胞)。放入37℃培养箱中孵育,每1h倒置显微镜下观察微管形成情况并及时在显微镜下进行拍照,最后按照以下公式进行计算:

公式中,“发芽细胞”表示单个细胞形态由圆形演变成带尖角的细胞形态;“相连的细胞”指单个细胞相互接触、呈串连接的细胞;“多角形”表示多个细胞相互连接围成的多角形的管腔;分值“0”表示出现的多角形结构的细胞只有 1 层;“1”表示出现的多角形结构的细胞有 2~3 层;“3”表示出现的多角形结构的细胞超过 4 层以上。
(七)CCK8实验检测SP 细胞增殖能力
选择对数期生长的单层贴壁生长的细胞,消化计数后重悬于10% FBS的RPMI-1640培养基。调整细胞浓度,保证每孔100μL细胞悬液中含有2×103个细胞,每组设置4个复孔,将培养板在培养箱预培养24h(37℃, 5% CO2的条件下)后,每24h检测一块培养板中细胞的增殖活性。向每孔加入10 mL CCK-8溶液,将培养板在培养箱内孵育2h,用酶标仪测定在450 nm处的吸光度。
(八)反转录实时定量PCR(RT-qPCR)
提取细胞总RNA后通过反转录体系获取cDNA,经过实时定量PCR反应测得最终的Ct值。
(九)Western blot实验
收集处于对数期生长的细胞,经预冷的PBS洗涤后加入细胞裂解液提取细胞总蛋白。采用预先配好的10% SDS-PAGE电泳凝胶,将提取的蛋白样品按照每孔30 μL加入各泳道。电泳分离后进行电转,使得蛋白从凝胶转移至聚偏氟乙烯(PVDF)膜上,结束后将PVDF膜放入体积分数为5%的脱脂牛奶中室温封闭1h,将膜按照不同蛋白分子量进行裁剪,分别用1:1000稀释的Anti-Tubulin mAb、Anti-VEGF mAb、Anti-MMP7 mAb、Anti-ABCG2 mAb抗体孵育4℃过夜。孵育后的膜放入TBS-T中洗涤3次,用5%脱脂牛奶分别制备HRP标记羊抗鼠抗体和羊抗兔抗体作为二抗,分别在室温度孵育1h,结束后用TBS-T洗涤3次。最后利用化学发光剂进行发光检测。
结 果
一、PC-3 悬浮细胞球形成
PC-3肿瘤 细胞系在无血清替代培养液SFM 中悬浮培养48 h 后可见少量体积较小、松散的悬浮细胞球,第7天开始观察到典型的PC-3 悬浮细胞球,直径>60μm。此后细胞球逐渐增大、增多,第14天时悬浮细胞球数量较第7天时数量显著增多(P<0.05),且形态大小各异。随着时间延长,细胞球数量和体积继续增大(图1)。而用SSM 培养的PC-3 细胞系,则在接种后2 h 左右开始贴壁,不产生悬浮细胞团。
二、PC-3 悬浮球细胞在有无血清的条件下其生长方式可以出现交替转换
将PC-3 悬浮细胞球吹散、重悬为单细胞悬液后接种于SSM 中,12 h 后可以于显微镜下观察到PC-3 成球细胞沉于培养皿的底部并贴壁生长,且逐渐形成单细胞层, 形态上与常规培养的PC-3NST细胞无明显差异。经胰蛋白酶消化、 重悬为单细胞悬液后,重新培养于SFM中,7~9d细胞仍悬浮存活并聚集成球状(图2)。重复以上过程,相同现象可以完全复制出现, 而且这种转换能力并不会随着传代而减弱。

图1 第14天时悬浮细胞球数量较第7天时数量显著增多

图2 前列腺癌细胞株PC3在不同细胞培养条件下的细胞生长形态比较
三、PC-3 悬浮球细胞中富集了SP 细胞
FACS 双波长分析显示,PC-3 悬浮球细胞中SP细胞比率为(0.768±0.101)%(图3A), 且保持相对稳定,而在PC-3 NST细胞中SP细胞比率为(0.035±0.023)%(图3B)。两者间差异具有统计学意义(P<0.05)。
四、Transwell小室细胞迁移实验检测SP细胞迁移能力
我们利用Transwel小室迁移实验检测细胞的迁移能力,观察到在6h时NST细胞和SP细胞迁移到小室底部的细胞数,分别为(82±14)个细胞/视野 和(105±18)个细胞/视野;12h时分别为(134±21)个细胞/视野和(244±31)个细胞/视野。与NST细胞相比较,SP细胞在6h和12h迁移到小室底部的细胞数明显增多,差异具有统计学意义(P<0.05,图4),这提示我们SP细胞具有更强的迁移能力。
五、Transwell小室细胞侵袭实验检测SP细胞穿膜侵袭能力
我们又对两组细胞进行了Transwel小室细胞侵袭实验,与常规培养的NST细胞相比较,在8h时NST细胞和SP细胞穿过Matrigel 胶到达小室底部的细胞数分别为(68±5)个细胞/视野和(87±8)个细胞/视野;16h时分别为(120±22)个细胞/视野和(222±25)个细胞/视野。SP细胞在8h和16h穿过Matrigel胶到达小室底部的细胞数明显增多,差异具有统计学意义(P<0.05,图5),提示SP细胞具有更强的侵袭能力。

图3 PC-3 悬浮球细胞中SP细胞比率显著高于单层贴壁细胞
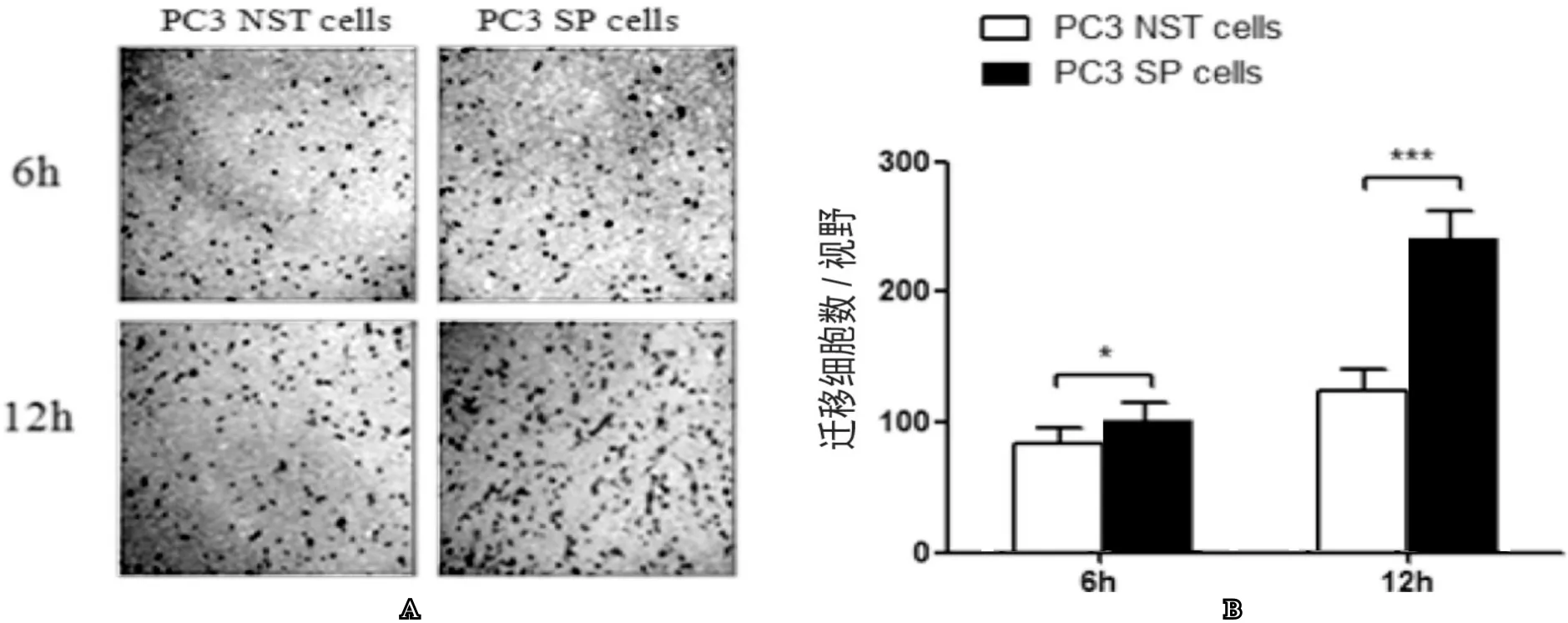
图4 利用Transwell小室细胞迁移实验比较SP细胞与NST细胞之间迁移能力
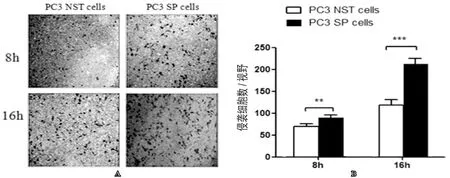
图5 利用Transwell小室细胞侵袭实验比较SP细胞与NST细胞之间细胞侵袭能力
六、利用HUVEC血管形成实验检测SP细胞的促血管生成能力
我们于不同时间段拍摄两组HUVEC细胞在血管生成载玻片中的血管生成情况,3h时NST细胞和SP细胞血管生成指数分别为(2.36±0.17)/视野和(2.92±0.2)/视野,6h时分别为(3.33±0.11)/视野和(4.86±0.12)/视野;与NST细胞相比,SP细胞促血管形成速度快,同时生成血管数目多,差异具有统计学意义(P<0.05,图6),说明SP细胞的促HUVEC血管生成能力强于NST细胞。

图6 利用血管生成实验观察SP细胞与NST细胞促HUVEC细胞血管生成情况的差异
七、CCK8实验检测SP细胞增殖能力
利用CCK8实验连续测量两组细胞1d、2d、3d、4d、5d、6d的细胞增殖情况。结果显示(图7),与NST细胞相比,SP细胞的增殖能力相对较弱。
八、利用实时定量PCR检测SP细胞中相关关键基因表达情况

图7 CCK8实验检测SP细胞与NST细胞之间增殖能力的数据统计
我们利用RT-qPCR检测SP细胞与NST细胞之间与血管生成相关的VEGF家族以及与迁移、侵袭关系密切的MMP家族基因和缺氧诱导因子HIF家族基因的表达水平,观察两组细胞之间各个基因表达水平差异情况。结果显示,SP细胞中HIF2α、VEGFA、VEGFR2、VEGFD、MMP7、MMP10等基因的表达量明显高于NST细胞,分别有2.47、2.34、2.75、6.69、1.62以及4.51倍左右的升高(图8)。
九、利用Western blot检测SP细胞中关键基因蛋白水平表达情况
根据RT-qPCR结果,我们发现了SP细胞与NST细胞之间差异表达明显的一组关键基因,我们进一步利用Western blot分别检测两组细胞在VEGF、MMP7 和HIF2α蛋白水平上的表达情况,结果显示,SP细胞中以上关键基因在蛋白水平上的表达量也显著高于NST细胞,分别有2.87、1.29以及2.85倍左右的升高(图9A、图9B、图9C)。与RT-qPCR结果相符。此外,我们还对两种细胞内的ABCG2蛋白进行检测,结果显示SP细胞中ABCG2蛋白表达水平显著高于NST细胞,差异具有统计学意义(图9D)。

图8 RT-qPCR检测SP细胞与单层贴壁细胞之间关键基因的统计分析结果

图9 利用Western blot分别检测两组细胞间与细胞侵袭以及血管生成相关的蛋白表达水平
讨 论
目前很多肿瘤干细胞并没有明确的表面标记物,这给筛选并分离出肿瘤干细胞提出了难题。Collins等[9]最早发现CD44、CD133以及整合素α2β1可以作为分离前列腺癌肿瘤干细胞的特异性标记物,然而随后有文献报道可以以CD44+/CD24-作为标记物从DU145[11]以及LNCaP[12]细胞系中分选出具有多向分化潜能的细胞群。其他的标记物类似乙醛脱氢酶(ALDH)[13-15]、转录因子Nanog[16-19]、OCT4[20]、Sox2[21]、CXCR4[22]、Sca-1[23,24]等也有报道可以作为前列腺癌干细胞的标记物进行应用。学者们在对这些标记物高表达的细胞群进行研究时,发现这些细胞也都具有干细胞的自我更新和多向分化潜能。然而,最近有研究表明[25],作为前列腺癌干细胞标记物的CD133,当表达阴性时依然拥有在小鼠内成瘤的能力。利用免疫荧光染色技术分析DU145细胞系中肿瘤干细胞表型,结果发现它们表现为CD44+/CD24+/α2β1+,而不是之前发现的CD44+/CD24-[26]。这些结果与之前的发现相矛盾,说明根据特异性标记物分选前列腺癌干细胞存在一定的困难,因此我们采用流式细胞仪侧群分选的方法来分离得到侧群细胞,通过研究前列腺癌侧群细胞的生物学特征来探索前列腺癌干细胞。SP侧群分选最初是Goodell等[27]提出,他们用Hoechst 33342细胞核染料对细胞进行染色,通过流式分选得出一部分染色较淡的细胞,称为SP细胞。在后续的研究中,人们发现这群细胞也具有肿瘤干细胞的相关特性,可以用来替代表面标志物作为获取肿瘤干细胞的新途径,目前在胶质瘤[28]、卵巢癌[29]和鼻咽癌[30]中SP细胞的存在和功能也得到了进一步证实,因此人们认为侧群细胞可以作为肿瘤干细胞的一种进行深入研究,而且相对于表面标记物的复杂性,侧群分选更加简单易行。
肿瘤干细胞理论为前列腺癌发病机制和靶向治疗的研究开辟了崭新的方向,迅速成为研究热点。但是由于肿瘤干细胞在总体细胞中所占的比例极为稀少,为进一步深入研究设置障碍。因此,如何高效分离、富集和纯化前列腺癌干细胞仍是目前学术界急待解决的难题。依靠表面特异性标记物流式分选肿瘤干细胞,虽然一度被认为是金标准,但长期研究发现,此方法仍存在较多局限性。在本研究中,我们采用体外无血清悬浮聚球法对常规贴壁培养的人雄激素非依赖性前列腺癌PC-3 细胞株进行悬浮培养,并成功富集了具有前列腺癌干细胞特性的细胞群,方法简便并且高效。置于SSM 和SFM 两种培养液中交替培养后,我们发现PC-3 悬浮球细胞与NST细胞之间可以相互转换,而且这种生长形式的相互转换并不会随着传代而减弱,证明PC-3 悬浮球细胞具有自我更新、多向分化潜能和微环境依赖性,并且可以相对稳定地遗传。
同时,在本研究中,通过流式检测技术得知PC-3 悬浮球细胞中SP 细胞比例显著高于NST细胞中SP 细胞的比例,同样证明通过悬浮聚球培养法可以从PC-3 细胞系中有效富集SP侧群细胞。
除此之外,在本研究中,我们通过Transwel小室迁移、侵袭实验,发现与NST细胞相比较,SP细胞具有更强的迁移以及侵袭能力。微管形成实验结果显示,SP细胞无论在促血管生成的速度以及HUVEC血管生成的数目上都显著高于NST细胞。肿瘤干细胞生长周期受到调控,相对于肿瘤中其他癌细胞生长缓慢,这是为了维持其自身的稳定性,只有当肿瘤组织癌细胞减少时,肿瘤干细胞才会进行分裂,分化为癌细胞,补充损失的部分。因此,本次研究中CCK8实验结果显示SP细胞的增殖能力相对较弱,也验证了这一假说,这也从另一方面证实SP细胞与肿瘤干细胞之间存在必然的关联。
缺氧诱导因子在肿瘤的能量代谢、血管生成和转移中起到重要作用,但是目前关于HIF2α的研究尚少。最新报道指出HIF2α在肾癌中参与CXCR4的扩增[31]以及VEGFA的表达调控[32],而CXCR4是目前报道的前列腺癌干细胞的标记物之一,说明HIF2α也可能参与了前列腺癌干细胞表面标记物的调节。此外,研究还发现[33]HIF2α参与CCL5/HIF2α/AR通路的信号调控,对前列腺癌干细胞的增殖和前列腺癌的转移起到重要作用。VEGF是主要的血管生成因子,而VEGFR2作为VEGF受体,两者结合后能够促进肿瘤血管生成,引起肿瘤的增殖和侵袭。同时VEGF可能与HIF2α相互作用,共同调节前列腺癌中血管生成,但两者之间是直接作用还是间接作用还需要进一步研究。基质金属蛋白酶MMP家族与肿瘤形成密不可分,有研究证实MMP参与肿瘤的迁移侵袭过程,通过降解细胞外基质,侵蚀破坏基膜,使得肿瘤穿过并进入血管,转移至继发部位,MMP7和MMP10作为MMP家族中的成员,也被发现与前列腺癌转移和侵袭相关[34]。本次研究我们利用RT-qPCR和Western blot实验分别对与迁移、侵袭和血管生成可能相关的基因在mRNA、蛋白水平上进行检测,我们发现SP细胞中HIF2α、VEGF、MMP表达量无论在mRNA水平还是蛋白水平上都明显高于NST细胞,这与体外功能实验结果相符合,进一步在分子水平上证实了SP细胞具有更强的迁移、侵袭以及促微管形成能力。
利用侧群分选的方法避免了筛选前列腺癌标记物的困难,但是分离出的SP细胞是否与前列腺癌干细胞的所有特征相一致需要进一步去验证。本课题只对前列腺癌PC-3细胞系进行了探讨,其他的细胞系中如DU145、LNCaP等也需要进行同样的研究。
综上所述,前列腺癌SP细胞虽然在前列腺癌组织中含量很低,但是其对前列腺癌难以治愈提供了一种解释,SP细胞具有肿瘤干细胞的自我更新以及多向分化潜能,它的迁移、侵袭以及促血管生成能力可能是晚期肿瘤转移的关键所在,而较弱的增殖能力与其分裂周期长相关,大部分时间SP细胞都处于静息状态,能够避免被作用于细胞周期的抗肿瘤药物杀伤,这有可能是目前前列腺癌对临床药物治疗不敏感的重要原因之一。在这些现有研究的基础上,下一步我们将进一步深入研究调控前列腺癌SP细胞表达的基因,通过升高或者降低目的基因的表达,从而达到抑制前列腺癌SP细胞的作用,希望借此能够寻找到一条治疗前列腺癌的有效方案。
参考文献
1 Siegel RL, Fedewa SA, Miller KD,et al.Cancer statistics for Hispanics/Latinos, 2015.CA Cancer J Clin2015;65(6):457-480
2 彭鹏, 龚杨明, 鲍萍萍, 等.中国2008年前列腺癌发病、死亡和患病情况的估计及预测.中华流行病学杂志2012; 33(10): 1056-1059
3 Stamey TA, Yang N, Hay AR,et al.Prostate-specific antigen as a serum marker for adenocarcinoma of the prostate.N Engl J Med1987; 317(15): 909-916
4 Stamey TA, Kabalin JN, Ferrari M,et al.Prostate specific antigen in the diagnosis and treatment of adenocarcinoma of the prostate.IV.Anti-androgen treated patients.J Urol1989; 141(5): 1088-1090
5 Semenas J, Allegrucci C, Boorjian SA,et al.Overcoming drug resistance and treating advanced prostate cancer.Curr Drug Targets2012; 13(10): 1308-1323
6 Clarke MF, Dick JE, Dirks PB,et al.Cancer stem cells--perspectives on current status and future directions:AACR Workshop on cancer stem cells.Cancer Res2006;66 (19): 9339-934
7 Li X, Lewis MT, Huang J,et al.Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy.J Natl Cancer Inst2008; 100(9): 672-679
8 Diehn M, Cho RW, Lobo NA,et al.Association of reactive oxygen species levels and radioresistance in cancer stem cells.Nature2009; 458 (7239): 780-783
9 Collins AT, Berry PA, Hyde C,et al.Prospective identification of tumorigenic prostate cancer stem cells.Cancer Res2005; 65(23): 10946-10951
10 Gangavarapu KJ, Azabdaftari G, Morrison CD, et al.Aldehyde dehydrogenase and ATP binding cassette transporter G2 (ABCG2) functional assays isolate different populations of prostate stem cells where ABCG2 function selects for cells with increased stem cell activity.Stem Cell Res Ther2013; 4(5): 132
11 Salvatori L, Caporuscio F, Verdina A,et al.Cell-to-cell signaling influences the fate of prostate cancer stem cells and their potential to generate more aggressive tumors.PloS One2012; 7(2): e31467
12 Hurt EM, Kawasaki BT, Klarmann GJ,et al.CD44+CD24(-) prostate cells are early cancer progenitor/stem cells that provide a model for patients with poor prognosis.Br J Cancer2008; 98(4): 756-765
13 Hellsten R, Johansson M, Dahlman A,et al.Galiellalactone inhibits stem cell-like ALDH-positive prostate cancer cells.PloS One2011; 6(7): e22118
14 Li T, Su Y, Mei Y,et al.ALDH1A1 is a marker for malignant prostate stem cells and predictor of prostate cancer patients' outcome.Lab Invest2010; 90(2): 234-244
15 Yu C, Yao Z, Jiang Y,et al.Prostate cancer stem cell biology.Minerva Urol Nefrol2012; 64(1): 19-33
16 Chambers I, Colby D, Robertson M,et al.Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells.Cell2003; 113(5): 643-655
17 Mitsui K, Tokuzawa Y, Itoh H,et al.The Homeoprotein Nanog Is Required for Maintenance of Pluripotency in Mouse Epiblast and ES Cells.Cell2003; 113(5): 631-642
18 Noh KH, Kim BW, Song KH,et al.Nanog signaling in cancer promotes stem-like phenotype and immune evasion.J Clin Invest2012; 122(11): 4077-4093
19 Miyazawa K, Tanaka T, Nakai D,et al.Immunohistochemical expression of four different stem cell markers in prostate cancer: High expression of NANOG in conjunction with hypoxiainducible factor1α expression is involved in prostate epithelial malignancy.Oncol Lett2014;8(3):985-992
20 Lin Y, Yang Y, Li W,et al.Reciprocal regulation of Akt and Oct4 promotes the self-renewal and survival of embryonal carcinoma cells.Mol Cell2012; 48(4):627-640
21 Rodriguez-Pinilla SM, Sarrio D, Moreno-Bueno G, et al.Sox2: a possible driver of the basal-like phenotype in sporadic breast cancer.Mod Pathol2007; 20(4): 474-481
22 Miki J, Furusato B, Li H,et al.Identification of putative stem cell markers, CD133 and CXCR4, in hTERT-immortalized primary nonmalignant and malignant tumorderived human prostate epithelial cell lines and in prostate cancer specimens.Cancer Res2007; 67(7): 3153-3161
23 Mulholland D J, Li X, Morim A,et al.Lin-Sca-1+CD49fhigh stem/progenitors are tumor-initiating cells in the Pten-null prostate cancer model.Cancer Res2009;69(22): 8555-8562
24 Xin L, Lawson DA, Witte ON.The Sca-1 cell surface marker enriches for a prostate-regenerating cell subpopulation that can initiate prostate tumorigenesis.Proc Natl Acad Sci U S A2005; 102(19): 6942-6947
25 Grosse-Gehling P, Fargeas CA, Dittfeld C,et al.CD133 as a biomarker for putative cancer stem cells in solid tumours: limitations, problems and challenges.J Pathol2013; 229(3): 355-378
26 Rybak AP, He L, Kapoor A,et al.Characterization of sphere-propagating cells with stem-like properties from DU145 prostate cancer cells.Biochim Biophys Acta2011;1813(5): 683-694
27 Goodell MA, Brose K, Paradis G,et al.Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo.J Exp Med1996; 183(4):1797-1806
28 Kondo T, Setoguchi T, Taga T.Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line.Proc Natl Acad Sci U S A2004; 101(3): 781-786
29 Bapat SA, Mali AM, Koppikar CB,et al.Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian cancer.Cancer Res2005;65(8): 3025-3029
30 Wang J, Guo LP, Chen LZ,et al.Identification of cancer stem cell-like side population cells in human nasopharyngeal carcinoma cell line.Cancer Res2007;67(8): 3716-3724
31 Micucci C, Matacchione G, Valli D,et al.HIF2α is involved in the expansion of CXCR4-positive cancer stem-like cells in renal cell carcinoma.Br J Cancer2015;113(8): 1178-1185
32 Song W, Yeh CR, He D,et al.Infiltrating neutrophils promote renal cell carcinoma progression via VEGFa/HIF2α and estrogen receptor β signals.Oncotarget2015; 6(22): 19290-19304
33 Luo J, Lee SO, Cui Y,et al.Infiltrating bone marrow mesenchymal stem cells (BM-MSCs) increase prostate cancer cell invasionviaaltering the CCL5/HIF2α/androgen receptor signals.Oncotarget2015; 6(29):27555-27565
34 周洪澜, 邢春伟, 葛岩, 等.前列腺癌中基质金属蛋白酶7,9的表达及其与VEGF的关系.中国老年学杂志 2007;27(14): 1385-1387
