非连续密度梯度法对弱精子症患者精子参数及DNA完整性的影响*
2018-05-17邓顺美李月华马春杰王奇玲秦卫兵刘晓华张欣宗唐运革
邓顺美 庞 韬 李月华 马春杰 王奇玲 刘 晃 秦卫兵 刘晓华 张欣宗 唐运革
国家卫生和计划生育委员会男性生殖与遗传重点实验室、广东省计划生育科学技术研究所(广州 510600)
对于部分弱精子症患者而言, 仅仅依靠药物治疗是无法获得自然妊娠的,必须依靠人类辅助生殖技术才能使他们达到生育后代的目的。然而无论是采用人工授精,还是体外受精与胚胎移植技术(IVF-ET)都需要对精子进行制备优选, 筛选出活力更强、精子形态更好的精子来实施人类辅助生殖技术。目前,对于弱精子症患者的精液通常采用非连续密度梯度法来优选精子,本方法优选出的精子通常精子活力和精子形态都会得到改善,但对精子功能相关参数的影响尚不明确。本实验试图采用非连续密度梯度法对弱精子症患者精液进行精子制备优选,分析精子制备前后的精液质量参数和精子DNA完整性,评估非连续密度梯度法在改善精子质量参数和精子DNA完整性方面的有效性。
资料与方法
一、样本来源
26例弱精子症精液标本来自于2016年3月至2016年6月在广东省计划生育专科医院男科门诊就诊的男性不育症患者,年龄22~35岁,平均年龄(32±6)岁。弱精子症患者准入标准为精液标本量≥1.5mL,精子浓度≥15×106/mL,精子总活力[前向运动精子(PR)+非前向运动精子(NP)]<40%,前向运动精子(PR)百分率<32%,正常形态精子百分率≥4%,所有样本均排除支原体、衣原体感染, 附睾或睾丸炎,系统性疾病病史,且患者常规体格检查正常。准入患者禁欲2~7d,采用手淫法收集精液于干燥无菌取精杯, 置于37℃恒温水浴箱中待液化。
二、仪器与试剂
SCA精子质量分析系统,精子计数玻片均为西班牙Microptic s.l.公司产品。改良巴氏染色液来自于贝索生物技术有限公司,精子洗液、40%和80%梯度离心液购置于Gynotec公司。精子核DNA荧光染色试剂盒来自于深圳市华康公司。80i荧光显微镜为日本尼康公司产品。
三、精液常规及精子形态分析
使用一次性精子计数玻片(goldcyto),采用SCA精子质量分析系统对精子制备前后精子浓度、精子总活力、PR百分率进行分析。对于精子浓度大于50×106/mL的标本先进行稀释, 然后再做精液常规分析。仪器参数设置与操作方法严格按照生产厂家制定的操作规程实施。采用WHO主编的《人类精液检查与处理实验室手册》[1]推荐的改良巴氏染色法分析精子形态。
四、精子DNA完整率检测
采用精子核DNA荧光染色试剂盒进行精子DNA完整性检测分析。双链DNA结合吖啶橙荧光染料后精子在荧光显微镜下呈现绿色荧光,单链DNA结合荧光染料后精子显示红色荧光。每份精液标本染色后,在荧光显微镜下记数至少200个精子,计算绿色荧光精子所占的百分率,该百分率即为精子DNA完整率。
五、非连续密度梯度法
采用WHO主编的《人类精液检查与处理实验室手册》推荐的非连续密度梯度离心法对精液标本进行精子制备[1]。非连续密度梯度离心制备后的精子沉淀物用培养液统一调至0.5mL。
六、制备后检测
对制备后的精子标本按照上述三和四所述方法进行精液常规、精子形态分析和精子DNA完整性检测。
七、统计分析方法
采用SPSS软件对精子制备前后各精液参数进行配对t检验。
结 果
26例弱精子症患者精液标本通过非连续密度梯度离心法进行精子制备,制备前精液体积为(4.22±1.54)mL,制备后精子体积统一调至0.5mL。其他精液参数制备前后的检测数据见表1。统计分析结果显示精子制备后精子浓度显著下降,精子总活力、PR百分率,正常形态精子百分率,以及精子DNA完整率较制备前显著提高,差异均具统计学意义(P<0.05)。
表1 26例弱精子症患者精子制备前后各精液参数检测结果比较(±s)
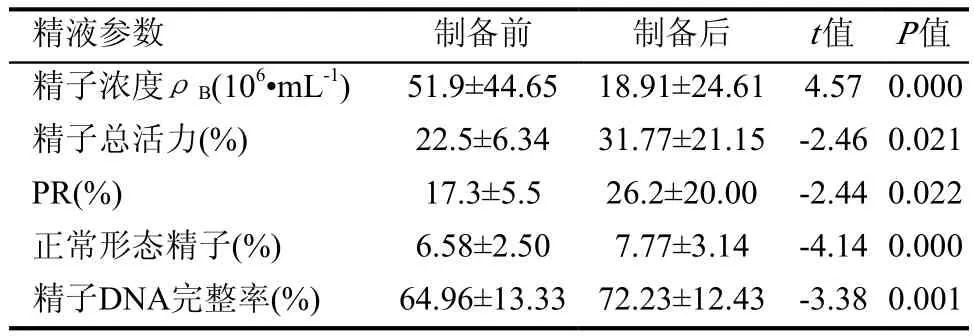
表1 26例弱精子症患者精子制备前后各精液参数检测结果比较(±s)
精液参数 制备前 制备后 t值 P值精子浓度ρB(106•mL-1) 51.9±44.65 18.91±24.61 4.57 0.000精子总活力(%) 22.5±6.34 31.77±21.15 -2.46 0.021 PR(%) 17.3±5.5 26.2±20.00 -2.44 0.022正常形态精子(%) 6.58±2.50 7.77±3.14 -4.14 0.000精子DNA完整率(%) 64.96±13.33 72.23±12.43 -3.38 0.001
讨 论
在不育症患者夫妇中,大约有30%~40%是由男方因素引起,15%~20%是由男女双方因素共同所致。因此,男性因素是不育症不可忽视的重要原因。精液参数异常是引起男性不育的常见原因,弱精子症导致的男性不育就是其中之一。由于男性生殖系统特殊的解剖及生理特性,使得因男性因素引起的不育症通过药物或手术治疗的效果较差,而且,约有3%~5%的不育症属于难治性的,必须通过辅助生殖技术才能达到妊娠的目的[2]。
弱精子症患者由于精子活力降低导致精子穿透宫颈黏液的功能下降,无法在最佳时间内游到卵子所在位置,因而,也就导致精子的受精能力下降,甚至部分弱精子症患者只能通过人类辅助生殖技术才能解决生育问题。无论是采用人工授精,还是IVF-ET,辅助生殖治疗前都必须制备优化精子,去除精浆中使精子失去受精能力的物质。目前,常用的精液优化处理方法有简单洗涤法、直接上游法和非连续密度梯度离心法等。对于精液参数正常的标本,多采用上游法,对于弱精子症患者精液标本,则多采用非连续密度梯度离心法[1]。不同的精子制备方法有不同的优缺点,上游法能显著提高PR百分率,但对提高正常形态精子百分率无明显改善[3];选择非连续密度梯度离心则可富集更多活力好、形态正常的精子,有利于提高卵子的受精率[4]。精子制备方法很多,各种方法对精液常规分析参数的影响大都已有定论,但对精子DNA 完整性的影响,研究结果却不尽相同。已有研究报道,上游法、密度梯度离心法均可以不同程度优化精液质量,显著提高精子DNA完整率[5],但是其研究对象均来自于精液参数正常的男性。另一方面,精子DNA损伤又与男性不育密切相关,其损伤程度与自然受孕率呈显著负相关。有报道认为精子DNA碎片指数(DFI)≥30%,则自然生育的可能性几乎为零[6]。本研究运用非连续密度梯度离心法对弱精子症患者精液标本进行精子优选制备,并对制备前后的精液标本进行精液常规和精子形态分析,采用吖啶橙染色方法检测精子DNA完整性。26例弱精子症患者精液标本通过非连续密度梯度离心法制备精子后,精子DNA完整率较制备前明显改善,而且精子总活力、PR和正常形态精子百分率也得到显著提高。精子浓度较制备前之所以显著下降,是因为在精子优选制备过程中部分精子丢失的缘故。已知精子成熟是精子核高度浓缩、组蛋白被鱼精蛋白取代的过程,成熟后的精子其密度较高,因此,在非连续密度梯度离心过程中,正常精子与非成熟精子、畸形精子、不活动精子及精液中的其他细胞成分在运动能力、运动轨迹和浮力密度等方面存在差异,在非连续密度梯度溶液柱中运动的能力也有差异,离心后精液中的各种成分在密度梯度溶液柱中达到平衡,成熟精子因密度最高而沉淀在离心管底部,从而可以有效筛选出分化成熟而形态相对正常、活动力更好的精子。已有文献报道通过非连续密度梯度离心法体外处理后的精子发生凋亡和坏死的比例明显降低,有活力的精子平均百分比明显升高[7]。本研究显示,弱精子症患者精液经非连续密度梯度离心法处理后,大量的死亡或 DNA 损伤的精子被去除,从而使分化成熟的正常精子(绿色荧光精子)比例增加,精子DNA 完整率得到显著提高,结果与Xue等[8]在优化处理畸形精子症精液标本时所得结果类似。
综上所述,对于弱精子症患者精液标本,采用非连续密度梯度法制备精子,不仅能提高精子活力和正常形态精子百分率,还能富集到更多DNA完整的精子,有效提高制备后精子的DNA完整率,为后续实施人类辅助生殖技术提供安全保障。
参考文献
1 WHO主编.国家人口和计划生育委员会科学技术研究所译.人类精液检查与处理实验室手册.北京: 人民卫生出版社, 2011: 135-139
2 熊承良, 吴明章, 刘继红, 等主编.人类精子学.武汉: 湖北科学技术出版社, 2002: 548
3 Mortimer D.Laboratory standards in routine clinical andrology.Reprod Med Rev1994; 3(3): 97-111
4 Morshedi M, Duran HE, Taylor S,et al.Efficacy and pregnancy outcome of two methods of semen preparation for intrauterine insemination: a prospective randomized study.Fertil Steril2003; 79 suppl 3: 1625-1632
5 王新生, 孟凡会, 刘海宁, 等.精液体外处理对精子核DNA链完整性影响的研究.中国男科学杂志 2004;18(4): 22-24
6 Bungum M, Humaidan P, Axmon A, et al.Sperm DNA integrity assessment in prediction of assisted reproduction technology outcome.Hum Reprod2007; 22(1): 174-179
7 徐鸿毅, 罗清炳, 邓凯, 等.密度梯度离心后精子悬液中弹性硬蛋白酶浓度和精子DNA完整性的测定.中国优生与遗传杂志 2015; 23(2): 94-95, 127
8 Xue X, Wang WS, Shi JZ,et al.Efficacy of swim-up versus density gradient centrifugation in improving sperm deformity rate and DNA fragmentation index in semen samples from teratozoospermic patients.J Assist Reprod Genet2014; 31(9): 1161-1166
