补肾活血方通过VEGF/VEGFR2相关通路促进生精障碍模型小鼠睾丸微循环的研究*
2018-05-17董伟航金保方孙大林滨邓伟民崔毓桂
董伟航 金保方 孙大林 蔡 滨邓伟民 崔毓桂 童 丽 吴 萍**
1.青海大学医学院(西宁 810001);2.东南大学附属中大医院中西医结合男科;3.南京医科大学第一附属医院生殖医学科
生精障碍是临床治疗少、弱、无精子症患者时所面临的直接问题。精子的发生乃至成熟受到多重因素的调节,越来越多研究证实精子发生与睾丸微循环之间存在紧密联系,生精小管的高代谢环境需要睾丸充足的血流灌注[1],而无精子症患者睾丸生精环境破坏的同时微循环调控能力亦下降[2]。
中医认为,补肾填精可以促进精子发生。然而,单纯通过补肾填精治疗男性不育症,在临床实践过程中,或效或不效,已经引发了人们的广泛思考。
改善睾丸微循环,在补肾填精的基础上加以养血活血,能否改观单纯补肾填精“或效或不效”的问题?研究团队在前期临床研究中发现,与传统的补肾精代表中药五子衍宗丸相比,补肾活血中药养精胶囊(Yangjing Capsule, YC)能够更加显著的提高男性不育症患者的精子数量和活力[1]。而后动物实验亦证实:YC可以显著改善环磷酰胺(Cyclophosphamide,CP)所致生殖损伤小鼠的睾丸、附睾损伤情况,降低CP所致的生精细胞凋亡及凋亡率,促进精子发生[1]。我们推测YC改善CP小鼠生精障碍的机制亦与其改善睾丸微循环相关。
本实验通过检测CP模型组小鼠与YC治疗组(低、中、高剂量)小鼠之间睾丸CD34、VEGFR2、SRC及AKT1的表达变化,明确了补肾活血方对CP模型小鼠睾丸微循环的改善作用并初步探索了其机制。
材料与方法
一、材料
(一)实验动物
雄性BALB/c小鼠(清洁级)60只,8~10周龄,体质量(20±2)g。实验室温度 (21±2)℃,相对湿度40%~70%,常规饲料喂养,自由饮水。适应性饲养1周后进行后续实验。
(二)药物与试剂
养精胶囊,0.5g /粒 [南京军区南京总医院制剂科,院临 ( 2004) 第 01002 号];注射用环磷酰胺(山西普德药业股份有限公司);40×柠檬酸钠-EDTA抗原修复液(Beyotime,P0086);封闭用正常山羊血清工作液(ZSGB-BIO,ZLI-9022);免疫染色一抗稀释液(Beyotime,P0103);即用型免疫组化EliVision plus试剂盒(福州迈新生物技术开发有限公司,Kit-9901);DAB显色试剂盒(博士德生物,AR1022);MiniBEST Univerasl RNA Extraction Kit(Takara,9767);Prime ScriptTM RT Master Mix(Takara,RR036B);SYBR®Primix Ex TaqTM(Takara,RR420B);RIPA裂解液(Beyotime,P0013C);PMSF(Beyotime,ST506);BCA蛋白测定试剂盒(Beyotime,P0010);NuPAGETM 4-12% Bis-Tris Protein Gels, 1.5 mm, 15-well(Thermo Fisher,NP0336BOX);NuPAGETM MOPS SDS Running Buffer(ThermoFisher,NP0001);NuPAGETM Sample Reducing Agent(ThermoFisher,NP0004);NuPAGETM LDS Sample Buffer(ThermoFisher,NP0007);CD34 Antibody(proteintech,14486-1-AP);VEGF Receptor 2 Rabbit Polyclonal antibody(proteintech,26415-1-AP);Albumin Bovin V(BIOSHARP);SRC Rabbit Polyclonal antibody(proteintech,11097-1-AP);AKT1 Rabbit Polyclonal antibody(proteintech,10176-2-AP);GAPDH Antibody(proteintech,10494-1-AP);alpha Tubulin Rabbit Polyclonal antibody(proteintech,11224-1-AP);Peroxidase-conjugated Affinipure Goat Anti-Rabbit IgG(Jackson ImmunoResearch,103599);Western一抗稀释液(Beyotime,P0023A);Western二抗稀释液(Beyotime,P0023D);Immobilon Western Chemiluminescent HRP Substrate (Millipore,WBKLS0100 )。
(三)仪器
BMJ-III型包埋仪(常州市中威电子仪器有限公司);切片机(Peica);恒温振荡器(国华,ZD-85);倒置荧光显微镜(Nikon,TI-DH);混合器(太仓市科教器材厂);台式冷冻离心机(Eppendorf AG,5404);核酸蛋白测定仪(Eppendorf AG,6132);PCR仪(Eppendorf AG,5333);StepOnePlus®Real-Time PCR System(ThermoFisher);匀浆器(IKA);全波长酶标仪(ThermoFisher,1510);垂直电泳系统(BIORAD,PowerPacTM Basic);曝光机(Tanon,4200F)。
二、方法
(一)分组与给药
60只小鼠随机分成空白组、模型组、YC低剂量组、YC中剂量组、YC高剂量组(每组12只)。除空白组外,其余小鼠腹腔注射CP 50 mg/kg,空白组腹腔注射等量生理盐水,连续注射7d,各组常规喂养。
而后每日灌胃给药1次,其中空白组、模型组取生理盐水(10 ml/kg),YC低、中、高剂量组取生理盐水配置的YC混悬液(新鲜配置,取YC内容物用生理盐水溶解,分别配置成0.063 g/mL、0.126 g/mL与0.252 g/mL,低、中、高剂量组分别根据小鼠体质量按原药取0.63 g/kg,1.26 g/kg,2.52 g/kg灌胃),连续30d,期间常规喂养。
(二)实验步骤
第30日给药1h后,脱颈处死各组小鼠,摘取双侧睾丸。各组小鼠组内随机各半分A、B两组(每组6只),A组睾丸固定24h后脱水,石蜡包埋,B组睾丸-70℃冻存。
1.组织石蜡切片HE染色观察组织形态:石蜡切片5μm,60℃烤片2h,二甲苯脱蜡,梯度水化。苏木素浸染5min,自来水冲洗10min。0.5% HCL(75%乙醇配)分化10s,自来水冲洗1min。伊红浸染2min,自来水冲洗1min。梯度脱水,二甲苯透明,中性树胶封片,通风橱晾干。镜下观察染色情况。
2.组织石蜡切片免疫组化检测CD34染色:石蜡切片5μm,60℃烤片2h,二甲苯脱蜡,梯度水化。切片滴加3%双氧水室温避光孵育10 min,双蒸水冲洗3min×3。切片泡入双蒸水稀释的1×柠檬酸钠-EDTA抗原修复液中,置微波炉高火5min而后低火15min,自然冷却。滴加5%山羊血清37℃封闭30min。以免疫染色一抗稀释液配置CD34一抗(1:50),37℃摇床孵育90min,PBS冲洗3min×3。按免疫组化试剂盒说明孵育二抗。滴加DAB染料,镜下观察显色后双蒸水充分冲洗。苏木素复染5min,0.5% HCL(75%乙醇配)分化10s,双蒸水反蓝。梯度脱水,二甲苯透明,中性树胶封片,通风橱晾干。镜下观察染色情况。
3.RT-qPCR检测组织Vegfr2、Src、Akt1的mRNA表达:以RNA提取试剂盒提取组织RNA,RT试剂盒逆转录,而后配置20μL上样体系进行qPCR检测。上样体系为:SYBR 10μL,dH2O 7μL,ROX 0.4μL,上游引物0.8μL,下游引物0.8μL,cDNA 1μL。引物由上海英俊生物技术有限公司合成,序列如下,Vegfr2上游:CATTATCCTCGTCGGCACT,下游:GCATCATAAGGCAAGCGTTC;Src上游:CAGGACAGAATACGGAGACCA,下游:TTGGCCTAAAGACCCTGTTG;Akt1上游:GACTGTGGCAGATGGACTCA,下游:CCAGAATCACCTTCCCAAAG;β-actin上游:GCTACAGCTTCACCACCACAG,下游:GGTCTTTACGGATGTCAACGTC。反应采用标准两步法,以2-ΔΔCT相对定量法处理数据而后比较各组mRNA表达情况。
4.Western-blotting检测组织VEGFR2、SRC、AKT1的蛋白表达:以预先加入1% PMSF的RIPA裂解液提取组织蛋白,匀浆器匀浆。混合器振荡20s,冰上静置10min,重复2次。4℃ 12000×g,离心30min,取上清液以BCA蛋白测定试剂盒测定蛋白浓度。按预制胶说明配置上样体系。而后进行Westernblotting。其中一抗稀释比例如下,CD34:1/500,VEGFR2:1/500,SRC:1/500,AKT1:1/500,GAPDH:1/10000,α-TUBLIN:1/1000,二抗稀释比例为1/10000,封闭液为TBST配置的5% BSA。一抗4℃摇床孵育16h,二抗37℃摇床孵育1h。曝光后取相对灰度值进行统计比较各组蛋白表达情况。
三、统计学分析
所有数据均采用SPSS 19.0统计软件处理,结果用均数±标准差(±s)表示,均数比较采用单因素方差分析,P<0.05表示差异有统计学意义。
结 果
一、各组小鼠睾丸HE染色组织形态
从睾丸组织形态来看,空白组小鼠生精小管形态正常,各级生精细胞排列整齐、有序,管腔中可见大量成形的精子,间质细胞形态及数目亦正常。模型组小鼠可见生精小管缺损,管腔内几乎无成熟精子,间质细胞明显减少。YC低剂量组生精上皮仍薄且有生精细胞缺失,但部分管腔中可见少量成熟的精子,间质细胞增多。YC中剂量组小鼠生精上皮增厚,各级生精细胞排列有序,部分管腔中可见大量成熟精子,且间质细胞数目明显增多。YC高剂量组小鼠生精小管形态接近正常,多数管腔中可见大量成熟精子,间质细胞形态数目恢复较好(图1)。
二、各组小鼠睾丸CD34免疫组化染色及蛋白表达情况
从CD34免疫组化染色结果来看,模型组染色明显弱于空白组,而YC低、中、高剂量组染色逐步加深(图1)。
从Western-Blotting结果来看,模型组CD34蛋白表达明显低于空白组,而YC高剂量组CD34蛋白表达明显高于模型组,差异具统计学意义(P<0.01,图2)。
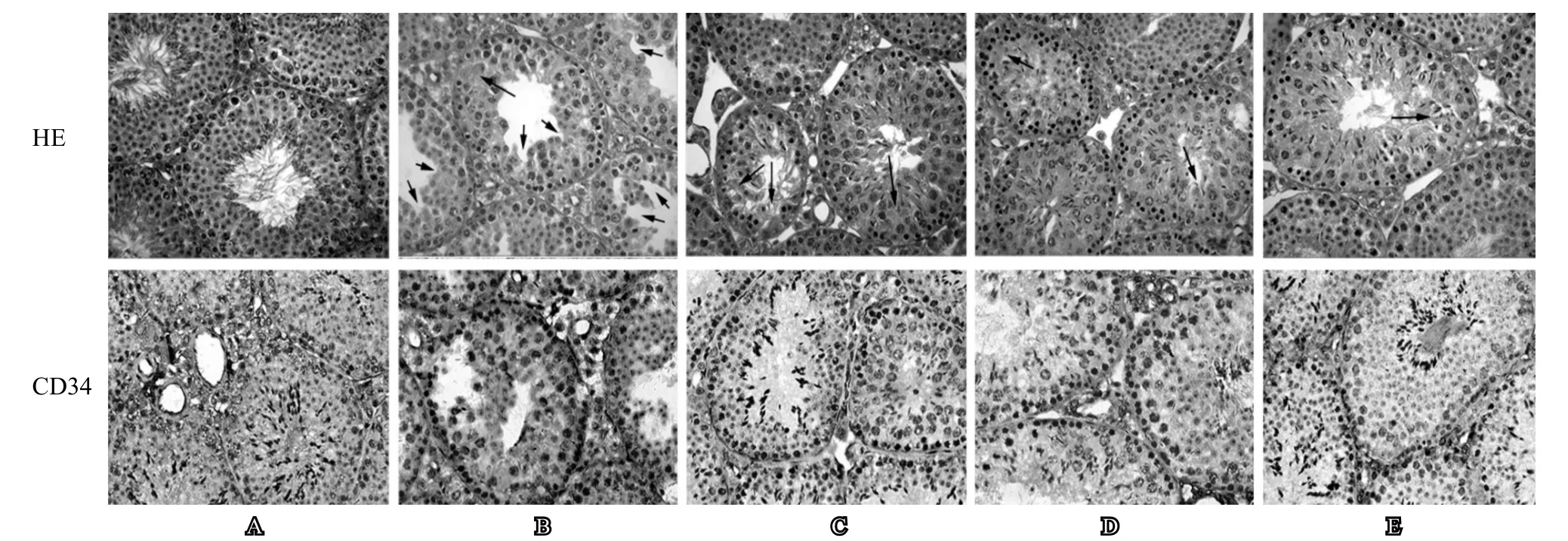
图1 养精胶囊对小鼠睾丸组织形态及CD34免疫组化染色强度的影响(400×)
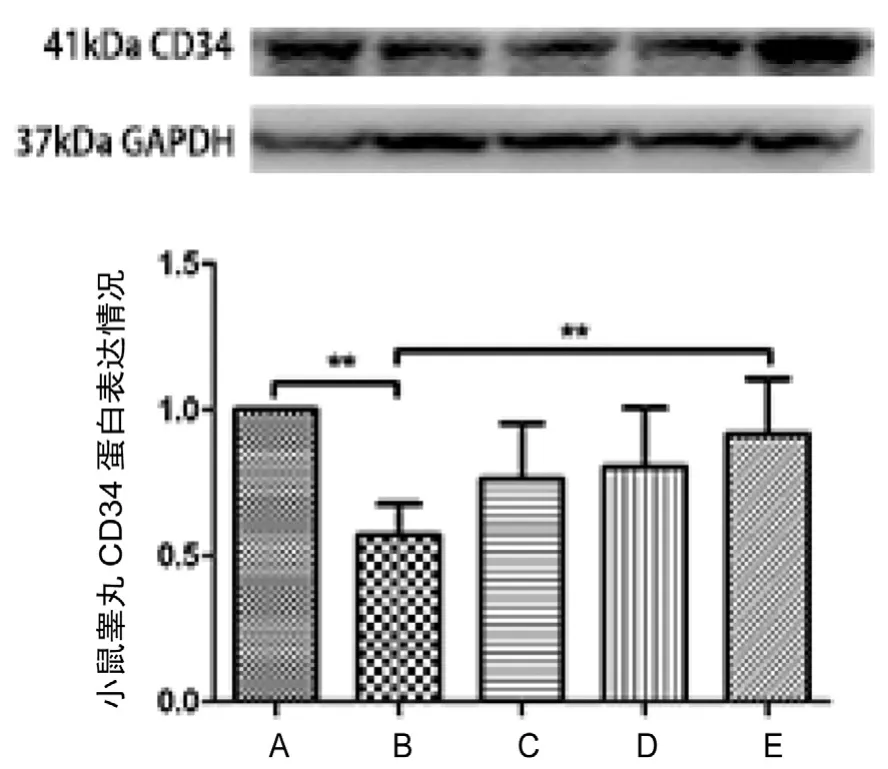
图2 养精胶囊对小鼠睾丸CD34蛋白表达的影响
三、各组小鼠睾丸VEGFR2、SRC、AKT1的mRNA与蛋白表达情况
模型组小鼠睾丸Vegfr2的mRNA表达明显高于空白组,差异具统计学意义(P<0.05);而模型组小鼠睾丸VEGFR2的蛋白表达较空白组明显下降,差异具统计学意义(P<0.001);YC高剂量组小鼠睾丸VEGFR2的蛋白水平较模型组明显上升,差异具统计学意义(P<0.001)。各组小鼠睾丸在Src与Akt1的mRNA表达上无统计差异(P>0.05),但在蛋白表达上,模型组小鼠睾丸SRC表达较空白组明显降低,差异具统计学意义(P<0.05);而YC高剂量组小鼠睾丸SRC蛋白水平较模型组明显提高,差异具统计学意义(P<0.001)。模型组AKT1蛋白表达较空白组明显下降,差异具统计学意义(P<0.05);YC治疗组小鼠睾丸AKT1蛋白表达与模型组比较无统计学差异(图3)。
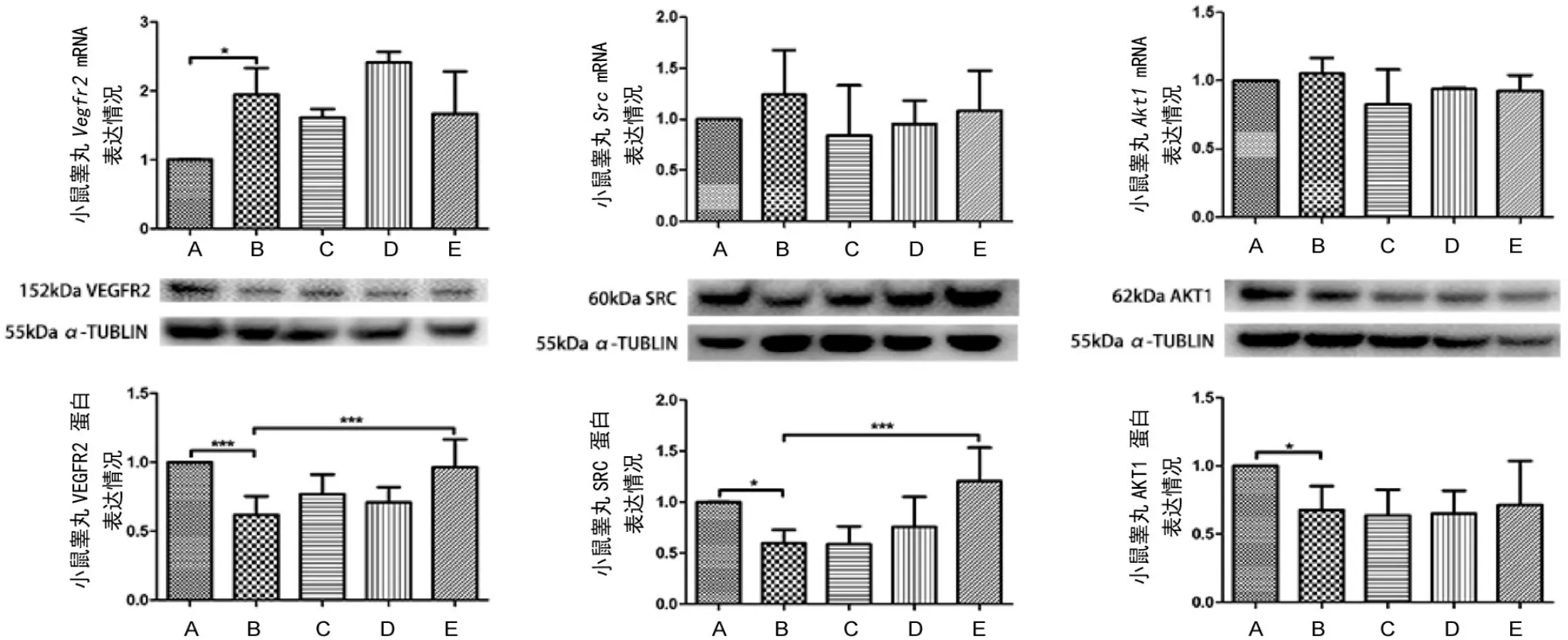
图3 养精胶囊对小鼠睾丸VEGFR2、SRC、AKT1的mRNA与蛋白表达的影响
讨 论
血管内皮因子通路VEGF通路是血管生成的经典通路,VEGFA与其受体VEGFR2的结合可诱导血管内皮细胞的增殖与迁徙[5],其对于睾丸微血管生成,血流灌注,以及睾丸微环境的改善起着至关重要的作用。目前我们发现血管VEGF/VEGFR2可通过PI3K/AKT通路与SRC因子两条支线作用于内皮型一氧化氮合酶(eNOS)进而促进血管生成。VEGFA于细胞膜与VEGFR2结合后,VEGF/VEGFR2激活钙蛋白酶2,而后钙蛋白酶2于胞膜与埃兹蛋白及磷酸肌醇结合,该复合物进而刺激PI3K/AMPK/AKT通路促使eNOS合成与NO分泌,同时通过刺激蛋白络氨酸磷酸酶1B(protein phosphotyrosine phosphatase 1B,PTP1B)负反馈于VEGFR2[6]。VEGFR2在络氨酸磷酸化后激活AKT,而eNOS的丝氨酸177位点经AKT或PKA磷酸化进而激活NO的分泌[7]。VEGFR2亦可通过pY949(小鼠)或pY951(人)引起SRC表达上升[8]。细胞膜上的G蛋白偶联受体(GPCR)可磷酸化SRC的Tyr783位点,激活磷脂酶Cɣ(PLCɣ),进而激活Ca+/CaM通路。而VEGFA/VEGFR2亦是通过PI3K/AKT通路与Ca+/CaM通路激活eNOS进而促进NO分泌[8]。学者将PI3K的酪氨酸磷酸化过程细化为SRC经PKA激活,而后抑制PP1,诱导CaMKII和Pyk2活化,进而使PI3K酪氨酸磷酸化[14],此过程提示SRC亦参与调控PI3K/AKT通路。而对于CD34,其作为血管内皮标记物,已有学者证实其在大鼠睾丸表达并将其作为反映睾丸微血管密度的指标[10]。
血管生成与精子发生之间存在紧密联系。实验发现6周龄VEGFA敲除小鼠附睾成熟精子与未分化的精原细胞均明显减少,睾丸生精小管生精细胞大量缺失且在部分生精小管中排列紊乱[12]。以SH5抑制AKT磷酸化后,研究人员发现种马精子总数和活力被明显抑制,同时伴随着线粒体膜电位降低,精子CASP3与CASP7表达明显上升[13]。
“精者血之所成也”,“血即精之属也”,精和血都由水谷精微化生和充养,化源相同,两者相互滋生,相互转化,此为“精血同源”。“脉者,资始于肾间动气”,“夫血者,水谷之精气也,和调于五脏,洒陈于六腑,男子化而为精,女子上为乳汁,下为经水”,血管的形成需要肾精的滋养,精子的发生亦需要血的充盈。补肾活血方养精胶囊由熟地黄、淫羊藿、黄芪、当归、炙水蛭、王不留行、荔枝核、紫河车、黄精、煅牡蛎、沙苑子11味中药组成,方中熟地黄滋肾益阴,养血填精;淫羊藿补肾壮阳,祛风除湿。两者共为君药,滋阴扶阳、补肾填精。黄芪、当归取当归补血汤之意,合“精血同源”之理,养血补精之功,共为臣药。炙水蛭、王不留行、荔枝核活血通经,理气逐瘀,改善睾丸微循环,为佐药。紫河车乃血肉有情之品,益气养血,补肾益精;黄精乃坤土之精,益气养阴,滋肾填精;煅牡蛎益精收涩,沙苑子补肾固精,共助封藏,共为使药。因此,我们把养精胶囊作为以补肾活血法治疗男性生精障碍的代表方药,同时结合当代社会人体微循环功能普遍下降的特点,依据“精血同源”理论以补肾活血方养精胶囊治疗男性不育症,尤其是特发性少、弱、无精子症疗效确切[14-16]。
CP不仅抑制睾丸生精能力,其对组织血管生成亦有抑制作用。研究发现CP可使小鼠腹膜内肿瘤周围血管变薄变细并使得腹水VEGFA浓度明显降低[11]。在前期实验证实YC改善CP致生精障碍模型小鼠生精功能的基础上,本次实验进一步证实了CP能够引发小鼠睾丸微循环损伤,而YC能够通过上调小鼠睾丸VEGF/VEGFR2相关通路中VEGFR2与SRC的蛋白表达进而改善CP模型小鼠微循环,且极可能由此进一步改善小鼠生精能力。CP能明显降低小鼠睾丸AKT1的蛋白表达,但遗憾的是本次实验YC并未逆转CP对小鼠睾丸AKT1的抑制作用,我们推测原因有两点,其一是YC仅通过VEGFR2/SRC/eNOS通路改善小鼠睾丸微循环,但在前期实验中我们发现CP显著诱发小鼠睾丸生精细胞凋亡,YC能明显降低BAX/BCL-2的基因和蛋白表达水平比值从而抑制CP引起的生精细胞凋亡[1],而AKT可磷酸化BAD,阻断BAD对BCL-2的抑制进而拮抗凋亡[17],结合AKT作用机制可知AKT需经磷酸化方能激活[7,9],所以我们更偏向于第二个原因,即是YC提升了CP小鼠磷酸化AKT(P-AKT)水平而使得AKT水平相对无差异。若有机会,我们将在后续实验中验证这一点。
参考文献
1 Zelli R, Troisi A, Elad Ngonput A,et al.JEvaluation of testicular artery blood flow by Doppler ultrasonography as a predictor of spermatogenesis in the dog.Res Vet Sci2013; 95(2): 632-637
2 Jaiswal D, Trivedi S, Agrawal NK,et al.Dysregulation of apoptotic pathway candidate genes and proteins in infertile azoospermia patients.Fertil Steril2015; 104(3):736-43.e6
3 金保方, 黄宇烽, 杨晓玉, 等.养精胶囊治疗弱精子症的临床观察.南京中医药大学学报 2006; 22(5): 286-289
4 Zhao H, Jin B, Zhang X,et al.Yangjing Capsule ameliorates spermatogenesis in male mice exposed to cyclophosphamide.Evid Based Complement Alternat Med2015; 2015: 980583
5 Teubner A, Müller K, Bartmann CP,et al.Effects of an anabolic steroid (Durateston) on testicular angiogenesis in peripubertal stallions.Theriogenology2015; 84(3): 323-332
6 Zhang Y, Liu NM, Wang Y,et al.Endothelial cell calpain as a critical modulator of angiogenesis.Biochim BiophysActa2017; 1863(6): 1326-1335
7 Wang S, Iring A, Strilic B,et al.P2Y2 and Gq/G11 control blood pressure by mediating endothelial mechanotransduction.J Clin Invest2015; 125(8): 3077-3086
8 Simons M, Gordon E, Claesson-Welsh L.Mechanisms and regulation ofendothelial VEGF receptor signalling.Nat Rev Mol Cell Biol2016; 17(10): 611-625
9 Egholm C, Khammy MM, Dalsgaard T,et al.GLP-1 inhibits VEGFA-mediated signaling in isolated human endothelial cell ilation of rat mesenteric arteries.Am J Physiol Heart Circ Physiol2016; 311(5): H1214-H1224
10 Rotfeld H, Hillman P, Ickowicz D,et al.PKA and CaMKII mediate PI3K activation in bovine sperm by inhibition of the PKC/PP1 cascade.Reproduction2014;147(3): 347-356
11 Arena S, Minutoli L, Arena F,et al.Polydeoxyribonucleotide administration improves the intra-testicular vascularization in rat experimental varicocele.Fertil Steril2012; 97(1):165-168
12 Lu N, Sargent KM, Clopton DT,et al.Loss of vascular endothelial growth factor A (VEGFA) isoforms in the testes of male mice causes subfertility, reduces sperm numbers, and alters expression of genes that regulate undifferentiated spermatogonia.Endocrinology2013;154(12): 4790-4802
13 Gallardo Bolaños JM, Balao da Silva CM, Martín Muñoz P,et al.Phosphorylated AKT preserves stallion sperm viability and motility by inhibiting caspases 3 and 7.Reproduction2014; 148(2): 221-235
14 金保方, 黄宇烽, 夏欣一, 等.养精胶囊联合锌硒宝对不育患者精子DNA完整性的影响.中国男科学杂志 2006;20(12): 45-49
15 张华俊.养精胶囊治疗DAZ基因缺失所致无精子症的临床价值.南京中医药大学 2010
16 Basu A, Bhattacharjee A, Ghosh P,et al.Sensitizing effects of an organovanadium compound during adjuvant therapy with cyclophosphamide in a murine tumor model.Biomed Pharmacother2017; 93: 816-829
17 Kashyap D, Kumar G, Sharma A,et al.Mechanistic insight into carnosol-mediated pharmacological effects:Recent trends and advancements.Life Sci2017; 169: 27-36
