半滑舌鳎外周血T淋巴细胞的分离、鉴定及TCRβ基因免疫应答分析
2018-05-16汪林庆陈亚东孙璐明沙珍霞
汪林庆 王 航 陈亚东, 杨 光 白 莉 孙璐明 沙珍霞,
(1. 福州大学生物科学与工程学院, 福州 350116; 2. 青岛大学生命科学学院, 青岛 266071; 3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室, 青岛 266235)
鱼类是最早具有获得性免疫系统的脊椎动物,获得性免疫功能依赖于T、B淋巴细胞2个亚群[1,2]。目前, 分离鱼类免疫细胞比较常见的是密度梯度离心法[3,4], 但是对T、B淋巴细胞的分离和鉴定还缺乏有效的手段。根据B细胞表面凹凸不平, 而T细胞表面微绒毛多较光滑的细胞特性, 尼龙毛法成功应用在哺乳动物T、B淋巴细胞的分离上, 一些学者利用尼龙毛法在鱼类上也成功分离了淋巴细胞[5,6]。T细胞受体(T cell receptor, TCR)是一种非常重要的T细胞抗原识别受体[7], 大多数T细胞的TCR由α和β肽链组成, 少数T细胞的TCR由γ和δ肽链组成[8]。
半滑舌鳎(Cynoglossus semilaevis)属鲽形目(Pleuronectiformes)、舌鳎科(Cynoglossidae)、舌鳎属(Cynoglossus), 是我国重要的海水养殖鱼类, 但日益频发的病害影响了养殖业可持续发展, 对半滑舌鳎免疫机制的解析是病害防治的根本途径之一。鉴于多数鱼类上尚缺乏有效的淋巴细胞分离、培养和鉴定技术, 本文通过开展外周血T淋巴细胞的分离和鉴定, 以期为利用体外分离和短期培养的T淋巴细胞开展免疫基因功能研究提供细胞平台;同时通过对TCRβ基因的组织表达和免疫应答趋势进行分析, 对半滑舌鳎获得性免疫研究提供理论依据。
1 材料与方法
1.1 实验材料
半滑舌鳎购自日照东鑫现代渔业技术研究所,鱼龄为1.5龄左右, 平均体重(310±5) g, 平均体长(30.6±0.1) cm。健康实验鱼在24℃水箱中暂养7d,以消除环境胁迫。
1.2 主要试剂
Hank’s缓冲液(Solarbio, 北京), 淋巴细胞分离液(Gibco, 美国), Ficoll-400(Solarbio, 北京), 瑞氏染液(Solarbio, 北京), 鼠抗人FITC-CD3单克隆抗体,鼠抗人FITC-CD19单克隆抗体, MTT (3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide)(Sigma, 美国), 植物凝集素PHA (Sigma, 美国), 台盼蓝, 尼龙毛。
DMEM完全培养基: DMEM基本培养基中添加15%FBS (胎牛血清, Gibco, 美国), 1 mmol/L的丙酮酸钠, 50 mmol/L的 2-Me (2-巯基乙醇), 100 U/mL的青霉素, 100 U/mL的链霉素, 0.3 μg/mL的PHA,培养基pH为 7.0—7.3。
1.3 半滑舌鳎外周血淋巴细胞的分离
将人淋巴细胞分离液用Ficoll-400调整密度为1.080, 用于半滑舌鳎外周血白膜层细胞的分离。先将半滑舌鳎置于冰水中麻醉, 用70%酒精棉球擦拭体表, 使用肝素抗凝管抽取尾静脉外周血, 立刻混匀, 在超净工作台中将全血与Hank’s缓冲液1∶3稀释混匀, 取分离液各3 mL于15 mL离心管中, 再各取2 mL稀释血液缓缓置于分离液液面上, 水平离心机1000 r/min离心20min, 收集白膜层细胞, 加入5倍体积的Hank’s缓冲液洗2次, 1000 r/min离心5min收集细胞沉淀, 重悬于DMEM完全培养基, 24℃培养箱培养3h后收集上层悬浮细胞, 0.2%台盼蓝活性计数。调整细胞浓度为6×105个/mL进行后续培养。
1.4 淋巴细胞体外代谢活力的检测
将密度为6×105个/mL悬浮淋巴细胞接种在含有0.3 μg/mL PHA的DMEM完全培养基中, 用96孔培养板培养, 培养温度为24℃。分别在0、6h、12h、18h、24h、36h、48h加入50 μL MTT溶液,继续孵育4h。洗掉MTT溶液后, 每孔加150 μL DMSO, 平板摇床缓缓摇动10min, 采用酶标仪检测570 nm波长处每孔细胞的光密度, 重复3次。
1.5 淋巴细胞的进一步分离
用1%HCl浸泡尼龙毛, 煮沸5—10min, 加蒸馏水冲洗直至溶液呈中性, 室温晾干, 将尼龙毛梳理开, 使其无结; 5 mL注射器移去活塞, 装入0.4 g尼龙毛, 压实, 铝箔包好管口高压蒸汽灭菌。完全DMEM培养基流过注射筒并没过尼龙毛, 封住下出口, 直立于24℃培养箱孵育≥45min。打开下出口流出培养基, 将收集的淋巴细胞稀释到107个/mL, 加1 mL细胞悬液, 封闭出口, 再加2—3 mL DMEM完全培养基, 24℃培养箱直立孵育45min。打开下出口, 收集最初流出的非黏附细胞, 关闭出口加入0.7%冰冷生理盐水, 震荡, 套上活塞, 推出液体, 收集黏附细胞, 0.2%台盼蓝检测细胞活性。
1.6 T样、B样淋巴细胞的鉴定
将收集的黏附细胞和非黏附细胞分别培养, 并与50 μL鼠抗人FITC-CD3、FITC-CD19单克隆抗体混匀, 4℃静置 30min, 洗弃上清, 流式细胞仪分别检测其特异结合率, 与鼠抗人FITC-CD3结合的为T样淋巴细胞, 与鼠抗人FITC-CD19结合的为B样淋巴细胞。
1.7 T细胞的鉴定
分别收集黏附细胞和非黏附细胞, 用于RNA提取。RNA提取按照RNA提取试剂盒(天根, 北京)说明书进行操作。cDNA第一条链的合成按照反转录试剂盒(宝生物, 大连)说明书进行, 得到的cDNA在–20℃保存待用。根据已发表的半滑舌鳎转录组数据[9]中的TCR基因序列信息(XM_017043019.1), 设计特异性引物T1-F和T1-R (表 1)进行PCR扩增(目的片段长度为760 bp左右), 经测序验证获得了TCRβ的基因序列, 根据测序得到的半滑舌鳎TCRβ基因序列设计qRT-PCR引物为qT1-F、qT1-R (目的片段长度为216 bp)(表 1)。分别以非黏附细胞和黏附细胞为模板, 用T1-F和T1-R引物对、qT1-F、qT1-R引物对进行PCR扩增。
1.8 半滑舌鳎组织的收集
感染实验参照孙璐明等[10]方法略作修改, 采取实验室自行分离鉴定的鳗弧菌(Vibrio anguillarum),菌体为杆状或弧状, 单鞭毛, 革兰氏阴性菌, 氧化酶阳性, 过氧化氢酶阳性, 葡萄糖发酵阳性, 对弧菌抑制剂敏感, 具有极强的致病性。在28℃, 2216E液体培养基中进行扩培。按照3.18×105CFU/g (半数致死量,LD50)对健康半滑舌鳎进行腹腔注射; 对照组注射同等体积1×PBS缓冲溶液。在注射后的0、6h、12h、24h、48h、72h 6个时间点取样, 每个时间点设置3个平行样, 分别取肝、小肠、脾、头肾、鳃、血液6种基本免疫组织; 另外随机选3条健康鱼分别收集肝、脾、头肾、后肾、小肠、胃、血液、鳃、皮肤、肌肉、心脏、脑、卵巢13个组织, 所取组织迅速投入液氮中冻存, 用于RNA提取和cDNA制备。
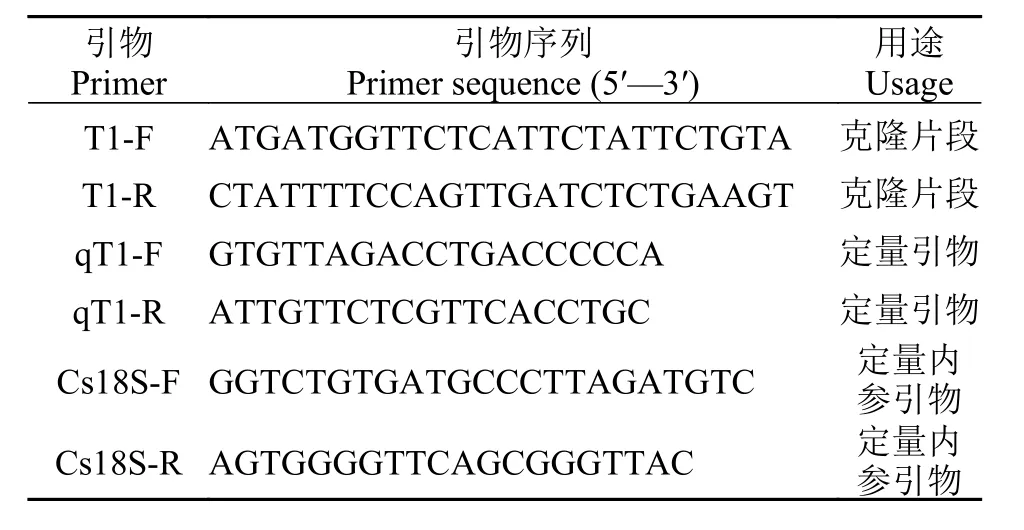
表 1 半滑舌鳎TCRβ基因克隆和表达分析所用引物Tab. 1 Primers used for expression analysis and cloning of TCRβ in C. semilaevis
1.9 半滑舌鳎TCR基因实时定量分析
以各组织cDNA为模板, 设计qRT-PCR引物为qT1-F、qT1-R (表 1), 以半滑舌鳎18S rRNA基因为内参, 设计引物为Cs18S-F、Cs18S-R (表 1)。用SYBR Green荧光定量试剂盒(天根, 北京)按照说明书在ABI PRISM 7500Fast实时定量扩增仪上进行qRT-PCR反应。
1.10 统计学分析
使用SPSS19.0统计软件对qRT-PCR检测结果进行分析。实时定量数据用3组重复平均值±标准误(SE)表示, 使用2–ΔΔCt法计算相对表达量。采用单因素方差分析法中的Duncan法对多组样本均数进行两两比较分析,P<0.05时, 认为存在显著性差异。
2 结果
2.1 半滑舌鳎外周血淋巴细胞的分离
外周血经水平离心机离心20min后, 分为明显的5层, 从下至上分别为红细胞层、粒细胞层、分离液层、白膜层和血浆层(图 1)。白膜层中包含淋巴细胞和单核/巨噬细胞。收集白膜层细胞, 洗涤两次后接种到DMEM完全培养基中培养3h, 单核/巨噬细胞贴壁, 收集悬浮的淋巴细胞(图 2)。在倒置显微镜下观察, 淋巴细胞呈圆形, 直径6—8 μm左右, 瑞氏染色发现核质比较大, 细胞核呈圆形, 几乎占据整个细胞, 具有典型的淋巴细胞形态特征(图3), 0.2%台盼蓝检测细胞活性, 活细胞百分率大于85%。

图 1 密度为1.080 mg/mL的分离液分离效果Fig. 1 The result of separating blood of founder with density of 1.080 mg/mL
2.2 淋巴细胞体外代谢活力生长曲线
实验结果表明, 在有丝分裂原PHA的刺激下,半滑舌鳎外周血淋巴细胞个体变大, 在体外可以增殖(图 4), 在培养12—24h之后细胞细胞增殖迅速,随后细胞不再增殖, 细胞数量慢慢减少, 24—48h后细胞数量保持相对稳定。体外培养条件下淋巴细胞不贴壁, 呈悬浮状态, 细胞间相互黏连聚集呈葡萄串状(图 5)。

图 2 100倍镜下的悬浮淋巴细胞Fig. 2 Suspending lymphocytes under the microscope (100×)

图 3 淋巴细胞瑞氏染色(100倍油镜)Fig. 3 Lymphocyte Wright's staining (100-fold oil mirror)

图 4 半滑舌鳎外周血淋巴细胞生长曲线Fig. 4 The growth curve of peripheral blood lymphocyte of C.Semilaevis
2.3 黏附细胞和非黏附细胞的鉴定
对黏附细胞和非黏附细胞采用流式细胞仪结合单克隆抗体进行检测。结果表明, 非黏附细胞与鼠抗人FTIC-CD3单克隆抗体的结合率为3.18%, 黏附细胞不与鼠抗人FTIC-CD3单克隆抗体结合,CD3分子在哺乳动物中被证实是T淋巴细胞表面抗原, 因此可以认为分离的半滑舌鳎外周血淋巴细胞中的非黏附细胞为T样淋巴细胞。同样, 黏附细胞和鼠抗人FTIC-CD19单克隆抗体的结合率为7.87%,非黏附细胞不与该抗体结合, 而CD19在哺乳动物中被认定为B淋巴细胞的表面抗原, 因此黏附细胞证明为半滑舌鳎B样淋巴细胞。为进一步确认淋巴细胞的特性, 将分离的2种细胞分别用TCRβ基因克隆验证。由于TCRβ在T细胞表面特异表达, 而在B细胞表面不表达, 通过2对不同引物的扩增(T1-F/R和qT1-F/R), 在非黏附细胞中分别获得了760和261 bp左右的PCR扩增产物, 在黏附细胞中检测不到TCRβ基因的表达, 表明收集的非黏附细胞是T淋巴细胞。
2.4 半滑舌鳎TCRβ基因在健康组织的表达
TCRβ基因在13个健康组织中均有表达(图 6),在肠中相对表达量最高(12.22), 其次是胃(9.09)、脾脏(8.17), 在头肾、后肾、皮肤和鳃中也有较高的表达量, 在肌肉和脑中的表达量相对低(肌肉0.13、脑0.57), 说明TCRβ基因在不同组织中存在表达差异性。
2.5 半滑舌鳎感染鳗弧菌后TCRβ基因在免疫组织中的表达
鳗弧菌感染半滑舌鳎后0、6h、12h、24h、48h、72h和96h,TCRβ基因在不同时间点6种免疫组织(肝、脾、头肾、鳃、肠和血液)中呈现出不同的表达水平(图 7)。结果表明: 在肝和脾中TCRβ基因的表达呈现相同的上调趋势, 其表达峰值出现在鳗弧菌感染后96h, 在肝中为对照组表达量的27.4倍;在脾脏中则是对照组的21.7倍; 在鳃中TCRβ基因表达上调, 最大表达量出现在感染后72h, 是对照组的11.5倍, 96h时依然保持较高的表达水平; 在头肾、血液和肠中的表达量变化不大, 在头肾中下调或上调表达量在2倍左右; 在血液中表达的最低值出现在12h, 为对照组的0.02倍, 其表达的趋势为先下降后上升, 48h基本恢复到正常表达水平。在肠中鳗弧菌感染后6h表达量增加了3倍, 但随后的各时间点TCRβ基本处于下调表达状态。

图 5 淋巴细胞体外悬浮培养Fig. 5 Suspension culture of lymphocytes

图 6 TCRβ基因在半滑舌鳎健康组织中的相对表达量Fig. 6 The relative expression of TCRβ gene in normal tissues of C. semilaevis
3 讨论
3.1 T淋巴细胞的分离鉴定
采用密度梯度离心方法进行鱼类外周血淋巴细胞的分离已经有很多成功的报道。早在20世纪80年代, Sakai[5]用18% Ficoll溶液分离得到金鱼(Carassius auratus)和鳟(Salmo playtcephalus)淋巴细胞, Blaxhall[4]用Ficoll-paque或Percoll梯度离心法分离了河鲑(Satmo truttaL.)、鲤(Cyprinus carpio)外周血淋巴细胞。但是由于鱼类的多样性比较高,不同鱼类所用分离液的密度有所不同。本实验对淋巴细胞分离方法进行了改进, 建立了适用于半滑舌鳎外周血淋巴细胞的分离方法。这一结果与报道的物种如鲤、金鱼等淋巴细胞分离结果相似。
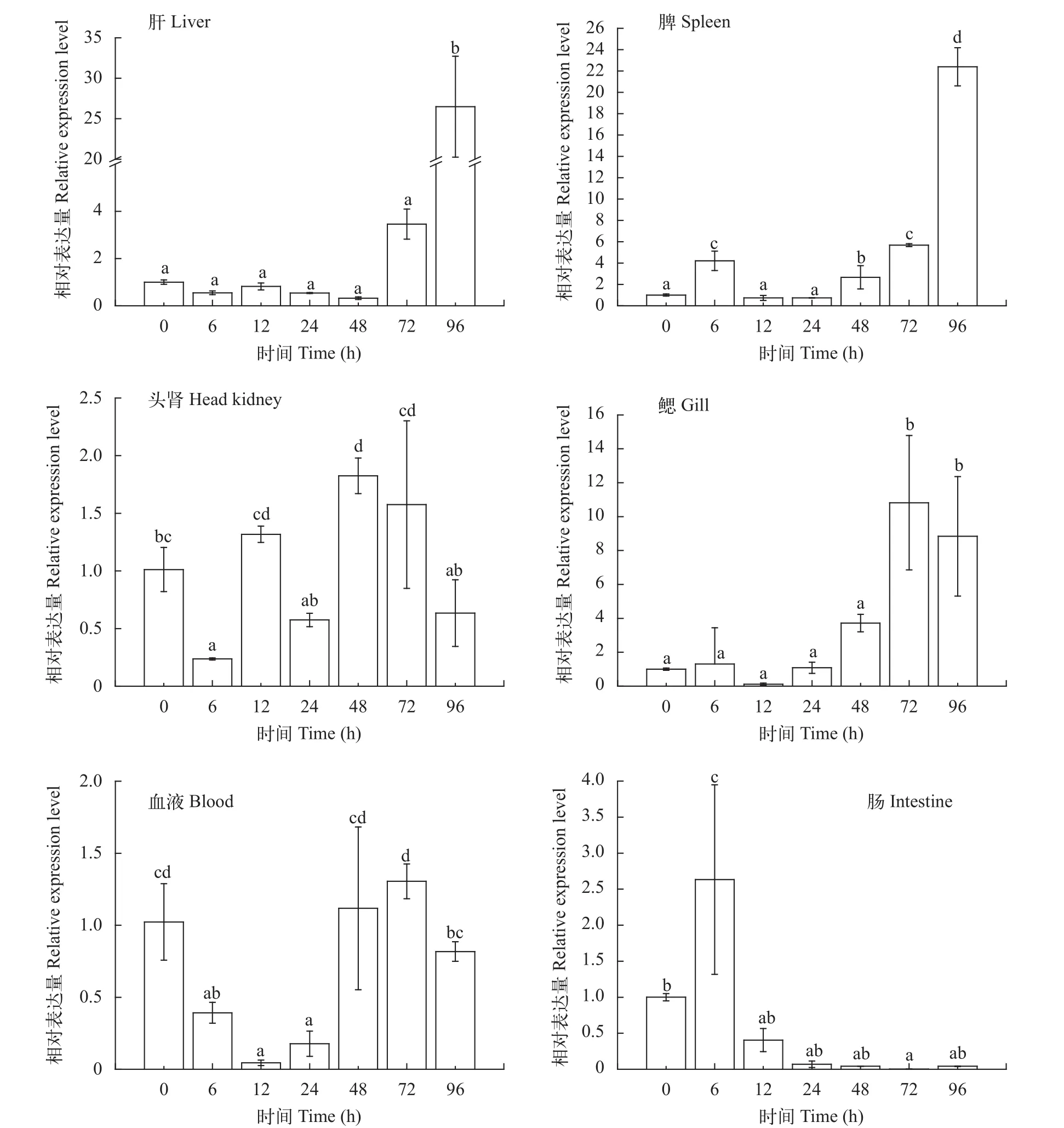
图 7 鳗弧菌感染半滑舌鳎后不同时间点6种组织(肝、脾、头肾、鳃、肠和血液)中TCRβ基因的相对表达水平Fig. 7 Relative expression of TCRβ gene in six tissues (liver, spleen, head kidney, gills, intestine and blood) of C. semilaevis at different time points after Vibrio anguillarum infection
体外培养的淋巴细胞不易传代生长, 而适当浓度的PHA (植物血凝素)可以促进淋巴细胞体外生长, 使之成功分裂增殖。如Fujiwara等[11]用含有18 μg/mL PHA的M199培养液培养虹鳟(Oncorhynchus mykiss)外周血淋巴细胞可达6d并用于染色体组型实验。本文采用含有PHA终浓度为0.3 μg/mL的完全DMEM培养基, 对分离获得的半滑舌鳎外周血淋巴细胞成功实现了体外培养, 淋巴细胞在18h后增殖达到对数期, 且稳定的增殖状态可维持48h。
在鱼类上, 目前由于缺少特异抗体, 对淋巴细胞的类群划分还存在比较大的困难。但随着基因组学的发展, 通过细胞表面特异基因的检测已成为鉴定淋巴细胞的有效手段。鱼类淋巴细胞表面标记的研究处于初级阶段, 利用现有的单抗分离的淋巴细胞往往并不是单一的细胞亚群[12—14]。尼龙毛法是分离鱼类T、B淋巴细胞的有效手段, Tate[15]通过尼龙毛法收集了对PHA、ConA敏感的鱼类非黏附细胞及对LPS敏感的黏附细胞。Xia等[5]用尼龙法分离鳗鲡(Anguilla japonica)淋巴细胞, 发现黏附性细胞具有B淋巴细胞有丝分裂反应特性, 而非黏附性细胞有T淋巴细胞有丝分裂特性。本研究结果表明, 尼龙毛法同样适用于半滑舌鳎外周血淋巴细胞的分离。目前, CD3[16,17]和CD19分别被认定为B淋巴细胞T淋巴细胞的表面抗原分子[18—20]。通过蛋白序列比对得知, 半滑舌鳎CD3(NCBI:NO XP_008306806.1)与人CD3(NCBI:NO XP_016874032.1)蛋白序列相似性为29%; 半滑舌鳎CD19(本实验室未发表数据)与人CD19(NCBI:NO XP_016874032.1)蛋白序列的相似性为44%左右。另外, 人类的CD3和CD19抗体已经成功的应用于多种水生动物的淋巴细胞鉴定, 如中华鳖(Trionyx Sinensis)[21], 海星(Asteroidea)[22]等。根据T淋巴细胞表面特异CD3分子标记和B淋巴细胞表面特异的CD19分子标记, 利用流式细胞仪检测到半滑舌鳎外周血中非黏附淋巴细胞和黏附淋巴细胞与鼠抗人FTIC-CD3单抗和鼠抗人FTIC-CD19单抗结合效率分别为3.18%和7.87%。且由于TCRβ在T细胞特异性表达,而在B细胞不表达, 本实验表明收集的非黏附细胞是T淋巴细胞, 黏附细胞是B淋巴细胞。目前应用TCR的表达鉴定鱼类的T细胞的方法在斑马鱼(Barchydanio reriovar)、大西洋鳕(Gadus morhua)等鱼类上亦有报道[23,24]。
3.2 TCRβ基因的表达特征分析
T细胞受体(TCR)作为T细胞识别内/外源性抗原的分子, 在免疫应答和免疫调节中发挥着重要的作用。自20世纪 80 年代T细胞受体基因被先后发现和克隆以来[25,26], 关于T细胞受体与机体获得性免疫[27]、自身免疫性疾病[28]、淋巴系统肿瘤[29]以及与病原分子[30]相互识别的关系得到了广泛的研究。目前, 人和鼠的T细胞受体的研究较多, 而对鱼类等动物TCR分子结构与功能研究较少。本研究表明,TCRβ在半滑舌鳎各个健康组织中都有表达,在肠道中的表达最高, 在胃、头肾、后肾和脾中的表达相对其他组织也较高。肠是最大的免疫器官,肠上分布着大量的肠相关淋巴组织(Gut associated lymphoid tissues, GALTs), 头肾、脾脏是鱼类的系统免疫器官, 也含有大量的T细胞, 故表达量较高。感染鳗弧菌后TCRβ在肝、脾、鳃中的表达量上调趋势明显, 且表达的峰值基本出现在72—96h。本研究结果说明TCRβ以在病原刺激后, 参与了机体的获得性免疫应答。TCRβ基因在鳗弧菌刺激后在肠中的表达变化幅度不大, 仅在感染6h后出现了小幅上调表达, 12h后则呈现下调表达趋势, 可能与采用腹腔注射的感染方式有关。肠道是最早接触病原菌的组织, 因此在腹腔注射导致肠道感染后的短时间内, 免疫细胞在肠道富集, 导致肠道中在感染后的6h内TCRβ表达量提高; 随后, 病原菌进入其他组织, 激活其他免疫组织该基因的表达。这一点可以通过其他组织普遍在感染后的48h表达量上升得到印证, 感染鳗弧菌后TCRβ在肝、脾、鳃中的表达量上调趋势明显, 且表达的峰值基本出现在72—96h。
本研究通过密度梯度离心和短期细胞培养方法, 结合尼龙毛法、流式细胞仪成功分离、鉴定了半滑舌鳎外周血T样淋巴细胞和B样淋巴细胞, 并进一步通过T细胞特异表面受体基因TCRβ表达对T细胞进行了鉴定; 这为后续半滑舌鳎免疫学研究建立了奠定了良好的细胞学基础。同时通过检测TCRβ基因在健康组织中、病原刺激后不同的免疫组织中基因的表达变化趋势, 验证了TCRβ基因在机体获得性免疫应答中发挥的重要作用。
参考文献:
[1] Abbas A K, Lichtman A H, Pober J S. Antigen processing and presentation to T lymphocytes [J].Cellular and Molecular Immunology, 2003: 115—137
[2] Vantourout P, Hayday A. Six-of-the-best: unique contributions of γδ T cells to immunology [J].Nature Reviews Immunology, 2013, 13(2): 88—100
[3] Blaxhall P C. The separation and cultivation of fish lymphocytes [J].Fish Immunology, 1985, 11: 245—60
[4] Blaxhall P C, Hood K. Cytochemical enzyme staining of fish lymphocytes separated on a Percoll gradient [J].Journal of Fish Biology, 1985, 27(6): 749—755
[5] Sakai K. Separation of lymphycytes from the peripheral blood of rainbow trout (Salmo gairdnerii) and goldfish[J].Bulletin of the Japanese Society of Scientific Fisheries(Japan), 1981, 47(10): 1281—1288
[6] Xia C, Kusuda R. Studies on the heterogeneity of lymphocyte population in Eel,Anguilla japonica[J].Suisanzoshoku(Japan), 1993, 41(1): 119—123
[7] Yamamoto R, Uenishi H, Hatsuse H,et al. TRAV gene usage in pig T-cell receptor alpha cDNA [J].Immunogenetics, 2005, 57(3-4): 219—225
[8] Bonneville M, O'brien R L, Born W K. γδ T cell effector functions: a blend of innate programming and acquired plasticity [J].Nature Reviews Immunology, 2010, 10(7):467—478
[9] Zhang X, Wang S, Chen S,et al. Transcriptome analysis revealed changes of multiple genes involved in immunity inCynoglossus semilaevisduringVibrio anguillaruminfection [J].Fish & Shellfish Immunology, 2015, 43(1):209—218
[10] Sun L M, Yu M J, Chen Y D,et al. AKT-interacting protein gene cloning and its expression profile in response to pathogen infection in half smooth tongue sole (Cynoglossus semilaevis) [J].Acta Hydrobiologica Sinica, 2016,40(3): 467—473 [孙璐明, 于孟君, 陈亚东, 等. 半滑舌鳎AKT-ineracting protein基因的克隆及免疫应答表达分析. 水生生物学报, 2016, 40(3): 467—473]
[11] Fujiwara A, Nishida-Umehara C, Sakamoto T,et al. Improved fish lymphocyte culture for chromosome preparation [J].Genetica, 2001, 111(1-3): 77—89
[12] Verburg-van Kemenade B M L, Nowak B, Engelsma M Y,et al. Differential effects of cortisol on apoptosis and proliferation of carp B-lymphocytes from head kidney,spleen and blood [J].Fish & Shellfish Immunology, 1999,9(5): 405—415
[13] Scapigliati G, Mazzini M, Mastrolia L,et al. Production and characterisation of a monoclonal antibody against the thymocytes of the sea bassDicentrarchus labrax(L.)(Teleostea, Percicthydae) [J].Fish & Shellfish Immunology, 1995, 5(6): 393—405
[14] Romano N, Taverne-Thiele J J, Van Maanen J C,et al.Leucocyte subpopulations in developing carp (Cyprinus carpioL.): immunocytochemical studies [J].Fish &Shellfish Immunology, 1997, 7(7): 439—453
[15] Tate H. Immunosuppressive effect of infectious pancreatic necrosis virus on rainbow trout (Oncorhynchus mykiss)[J].The Japanese Journal of Veterinary Science, 1990,52(5): 931—937
[16] Bankfalvi A, Navabi H, Bier B,et al. Wet autoclave pretreatment for antigen retrieval in diagnostic immunohistochemistry [J].The Journal of Pathology, 1994, 174(3):223—228
[17] Kaiko G E, Horvat J C, Beagley K W,et al. Immunological decision-making: how does the immune system decide to mount a helper T-cell response [J]?Immunology, 2008, 123(3): 326—338
[18] van Zelm M C, Reisli I, van der Burg M,et al. An antibody-deficiency syndrome due to mutations in the CD19 gene [J].New England Journal of Medicine, 2006,354(18): 1901—1912
[19] Scheuermann R H, Racila E. CD19 antigen in leukemia and lymphoma diagnosis and immunotherapy [J].Leukemia & Lymphoma, 1995, 18(5-6): 385—397
[20] Chung E Y, Psathas J N, Yu D,et al. CD19 is a major B cell receptor-independent activator of MYC-driven B-lymphomagenesis [J].The Journal of Clinical Investigation, 2012, 122(6): 2257
[21] Guo Q. Studies on surface antigens of t lymphocyte in grass carp,Ctenopharyngodon idellusand Chinese oftshelled turtle,Trionyx sinensis[J].Acta Hydrobiologica Sinica, 2001, 25(5): 455—461 [郭琼林. 草鱼, 中华鳖T淋巴细胞表面抗原的研究. 水生生物学报, 2001,25(5): 455—461]
[22] Leclerc M, Arneodo V J, Legac E,et al. Identification of T-like and B-like lymphocyte subsets in sea starAsterias rubensby monoclonal antibodies to human leukocytes[J].Thymus, 1993, 21(3): 133—139
[23] Haire R N, Rast J P, Litman R T,et al. Characterization of three isotypes of immunoglobulin light chains and T-cell antigen receptor a in zebrafish [J].Immunogenetics,2000, 51(11): 915—923
[24] Wermenstam N E, Pilström L. T-cell antigen receptors in Atlantic cod (Gadus morhuaL.): structure, organisation and expression of TCR α and β genes [J].Developmental &Comparative Immunology, 2001, 25(2): 117—135
[25] Davis M M. T cell receptor gene diversity and selection[J].Annual Review of Biochemistry, 1990, 59(1): 475—496
[26] Lai E, Wilson R K, Hood L E. Physical maps of the mouse and human immunoglobulin-like loci [J].Advances in Immunology, 1989, 46: 1—59
[27] Sakuma H, Kohyama K, Jee Y,et al. Tracking of Vβ8.2-positive encephalitogenic T cells by complementarity-determining region 3 spectratyping and subsequent southern blot hybridization in lewis rats after neuroantigen sensitization [J].The Journal of Immunology, 2004,173(7): 4516—4522
[28] Puisieux I, Even J, Pannetier C,et al. Oligoclonality of tumor-infiltrating lymphocytes from human melanomas[J].The Journal of Immunology, 1994, 153(6): 2807—2818
[29] Farace F, Orlanducci F, Dietrich P Y,et al. T cell repertoire in patients with B chronic lymphocytic leukemia.Evidence for multiple in vivo T cell clonal expansions [J].The Journal of Immunology, 1994, 153(9): 4281—4290
[30] Miles J J, Borg N A, Brennan R M,et al. TCRα genes direct MHC restriction in the potent human T cell response to a class I-bound viral epitope [J].The Journal of Immunology, 2006, 177(10): 6804—6814
