挺水植物与浮叶植物光合荧光特性的差异
2018-05-16周长芳龙水云王文琳夏秦冬平措桑珠徐紫萱
谢 春, 周长芳, 龙水云, 王文琳, 夏秦冬, 平措桑珠, 徐紫萱
南京大学生命科学学院, 南京 210023
湿地是地球上生产力最高、生物多样性最丰富的生态系统之一[1]。湿地生境的异质性造就了不同生活型的水生植物,如挺水植物、浮叶植物、沉水植物、漂浮植物等[2- 3]。水生植物作为湿地生态系统结构的重要组成部分,对维持其生物多样性、发挥其水质净化等多种功能具有重要意义[4- 5]。当前中国和很多发达国家普遍存在湿地面积减少和湿地质量退化等问题[6- 7],水生植被的恢复已成为湿地生态恢复的关键步骤之一[8- 10]。其中如何正确筛选候选植物(也称工具种),是当前湿地恢复理论研究和工程实施过程中亟待解决的问题。
光能是驱动生态系统能量代谢的源泉,但植物所吸收光能并非全部用于光合碳固定,其中部分能量可通过荧光反射和热能耗散掉。尤其在高光环境下,后两者是植物避免辐射损伤、实现高光保护的重要途径。湿地光环境十分复杂。挺水植物常生长于滨岸带,光资源有时受滨岸陆生植物的影响,其上下层叶片之间差异也较大。浮叶植物常生长于开阔水面,光资源多充足均一,且叶片下表面直接与水接触,容易散热。沉水植物光资源有限。由此我们猜测不同生活型水生植物在光能利用方面存在差异。受植物生长环境和仪器设备等因素的限制,目前水生植物光合的研究远远落后于陆生植物。
叶绿素荧光分析技术是当前植物光合研究领域中的新兴主流技术之一,该技术可以很好地将所吸收光能中用于光化学、荧光和热耗散的部分给予区分,在水生植物光合研究过程中也日益受到重视[11- 14]。本研究选取了江苏地区常见挺水植物和浮叶植物的代表种,拟通过对其光合荧光特征的比较,揭示两类生活型水生植物光合特征尤其是高光保护机制的差异,为湿地恢复工具种的筛选提供理论依据。鉴于光合色素在光能吸收和传递过程中的重要性,本实验还通过比叶重的换算,对两种计量方式下色素含量的变化趋势进行了比较。
1 材料与方法
1.1 实验材料
实验所选挺水植物代表种为菖蒲AcoruscalamusL.、梭鱼草PontederiacordataL.、再力花ThaliadealbataFraser及茭草Zizanialatifolia(Griseb.)Stapf,浮叶植物代表种为黄睡莲NymphaeamexicanaZucc.、莼菜BraseniaschreberiJ. F. Gmel.、金银莲花Nymphoidesindica(L.)O. Kuntze及菱TrapabispinosaRoxb。上述除莼菜和菱为江浙地区著名“水八仙”(8种水生蔬菜)外,其余6种均为湿地恢复常用工具种。实验前所测植株均在本校校园景观湿地中生长1年以上。所处地理位置为长江中下游亚热带向暖温带过渡区域,夏季旺盛生长季日均最高温度32℃左右,最低温度25℃左右。该景观湿地属于半自然开放湿地,除水位受人工宏观调控外,植物生长于全日照自然光环境中。采样期间水质基本理化参数为:pH 7.83(HI98160 pH/ORP测定仪)、氧化还原电位225.8mV(测定设备同pH)、电导率267.8μs/cm(DDB- 303A电导率仪)、浊度6.86NTU(WGZ- 200B浊度计)、溶氧6.04mg/L(JPBJ- 608溶解氧测定仪)、总磷0.07mg/L(钼酸铵分光光度法(GB11893—89))、总氮1.1mg/L(HACH DR2800水质分析仪和配套的消解仪测定)、化学需氧量3.46mg/L(酸性高锰酸盐滴定法(GB11892—89))。其中,总磷、总氮、化学需氧量在实验室完成分析,其余指标均在现场测定。
1.2 测定方法
1.2.1 叶绿素荧光参数的测定
实验于2016年7—8月间,选择各物种的健康植株,取顶部第一片完全展开、无明显残缺或病斑的叶片进行分析。使用超便携式调制叶绿素荧光仪MINI-PAM(WALZ,Germany),测定叶绿素荧光基本参数[15]。清晨暗适应30min后,打开饱和脉冲,记录最大荧光值Fm和最小荧光值Fo,并标记测定位点。待叶片在自然光环境下充分活化后,启动快速光曲线自动测量模式,记录系列光梯度下的饱和荧光值Fm′、实时荧光值Ft及最小荧光值Fo′。为尽量模拟两种生活型植物叶片的生长环境,浮叶植物叶绿素荧光测定采用自制铝箔叶夹,并保证测定过程中叶片始终飘浮于水面。挺水植物测定采用WALZ公司标准叶夹。上述测定每种植物重复5次。
参考Maxwell等[16]的方法作进一步分析,获得本研究所需参数。其中暗适应前提下,光系统Ⅱ(PSⅡ)最大光化学效率Fv/Fm=(Fm-Fo)/Fm,反映PSⅡ最大光能转换潜力。光活化条件下,PSⅡ实际光化学量子产量ΦPSⅡ=(Fm′-Ft)/Fm′,反映所吸收光能中用于光化学的部分;电子传递速率ETR=ΦPSⅡ×PAR×0.5×0.84(PAR为光合有效辐射),反映植物光能传递的效率;光化学淬灭系数qP=(Fm′-Ft)/(Fm′-Fo′),反映PSⅡ反应中心开放的部分;非光化学淬灭系数NPQ=(Fm-Fm′)/Fm′,反映所吸收光能中用于热耗散的部分。
基于Ralph曲线拟合模型和指数衰减方程[17],经修改后对ETR进行拟合分析(Ralph等[17]采用的计算公式为rETR=ΦPSⅡ×PAR,本文统一采用Maxwell等[16]关于ETR的计算公式,故所得拟合参数值和Ralph等[17]会有差异)。通过拟合方程ETR=Ps×(1-e-α×PAR/Ps)×e-β×PAR/Ps、 ETRm=Ps×[α/(α+β)]×[β/(α+β)]β/α、Ek= ETRm/α及Em=Ps/α×ln[(α+β)/β],获取初始斜率α、光抑制系数β、最大潜在电子传递速率Ps、最大电子传递速率ETRm、最小饱和光强Ek和饱和光强Em。其中α反映植物对光限制区域的利用能力,β反映植物在高光辐射区域的响应能力。
1.2.2 比叶重及色素含量的测定
取上述相同叶片,以已知面积(S)的圆形打孔器截取叶圆片并即时称鲜重(M),计算比叶重SLW=M/S[18]。取上述鲜叶材料,快速匀浆后,用80%丙酮提取色素,用UV- 2800A分光光度计(UNICO,USA)测得叶绿素a(Chla)、叶绿素b(Chlb)以及类胡萝卜素(Cars)浓度[19]。结合材料鲜重和比叶重将上述色素浓度单位换算为mg/g FW(单位鲜重)或mg/m2(单位面积)。由于同一物种不同样本间比叶重变化极小,本实验中比叶重分析只重复4次。色素含量分析重复5次。
1.3 数据分析
采用SPSS 22.0完成ETR曲线方程拟合,并对所有数据进行统计检验。采用单因素方差分析和Duncan检验比较不同植物间各指标差异的显著性,P<0.05时认为差异显著。文中数据均为各测量指标的平均值±标准误差。采用Excel 2013完成作图。
2 结果与分析
2.1 两种生活型水生植物Fv/Fm值的分析
实验中所有植物PSⅡ的Fv/Fm值均大于0.8(图1),说明所选样本均相对健康。挺水植物和浮叶植物之间整体未见显著差异(P>0.05),但挺水植物内部不同物种间变化范围明显大于浮叶植物。挺水植物再力花Fv/Fm值显著高于其他物种(P<0.05),菖蒲、茭草显著低于其他物种(P<0.05)。
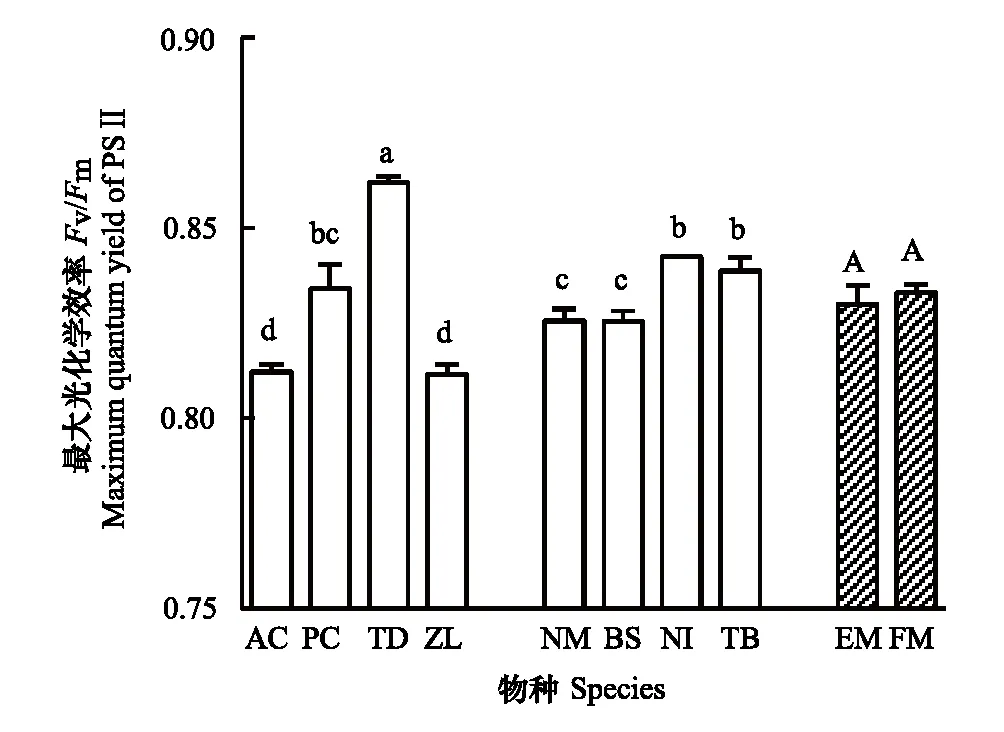
图1 两种生活型水生植物的最大光化学效率Fv/Fm Fig.1 Maximum quantum yield of PSⅡ in the two life forms of aquatic macrophytesAC:菖蒲 Acorus calamus;PC:梭鱼草 Pontederia cordata;TD:再力花 Thalia dealbata;ZL:茭草 Zizania latifolia;NM:黄睡莲 Nymphaea mexicana;BS:莼菜 Brasenia schreberi;NI:金银莲花 Nymphoides indica;TB:菱 Trapa bispinosa。图中带斜杠的数据为同一生活型的均值,EM:挺水植物;FM:浮叶植物;图中数据为平均值±标准误差(同一物种,n=5;同一生活型,n=20),数据顶部不同小写、大写字母分别表示物种间、生活型间差异显著(P<0.05)
2.2 两种生活型水生植物ΦPSⅡ、ETR、qP、NPQ值的分析
不同挺水植物之间ΦPSⅡ值存在一定差异(图2),其中再力花和梭鱼草较菖蒲和茭草显著上浮(P<0.05)。不同浮叶植物间ΦPSⅡ值差异相对较小(图2),并在整体上与挺水植物中的菖蒲和茭草接近。不同挺水植物间ETR变化幅度较大(图2)。其中再力花和梭鱼草ETR值约为菖蒲和茭草的2倍(P<0.05)。不同浮叶植物间ETR也略有差异,由高到低依次为金银莲花>莼菜>菱和黄睡莲,但总体变化幅度小于挺水植物(图2)。同挺水植物相比,4种浮叶植物ETR值均小于再力花和梭鱼草(P<0.05),其中莼菜、金银莲花ETR值大于菖蒲和茭草(P<0.05),黄睡莲、菱ETR值与菖蒲和茭草接近(P>0.05)。
挺水植物qP值变化范围和浮叶植物相似(图2)。挺水植物中,梭鱼草qP值高于再力花、菖蒲和茭草(图2,P<0.05)。浮叶植物中金银莲花qP值略高于莼菜、黄睡莲和菱(图2,P<0.05)。 不同挺水植物间NPQ值存在较大差异(图2),其中梭鱼草NPQ值约为其他挺水植物的2—3倍(P<0.05)。剩余挺水植物NPQ由高到低依次为菖蒲>茭草>再力花。浮叶植物NPQ值整体较低,其内部变化幅度也相对较小(图2)。其中黄睡莲NPQ和挺水植物再力花接近(P>0.05),金银莲花NPQ略高于黄睡莲(P>0.05),而莼菜和菱则显著低于黄睡莲(P<0.05)。
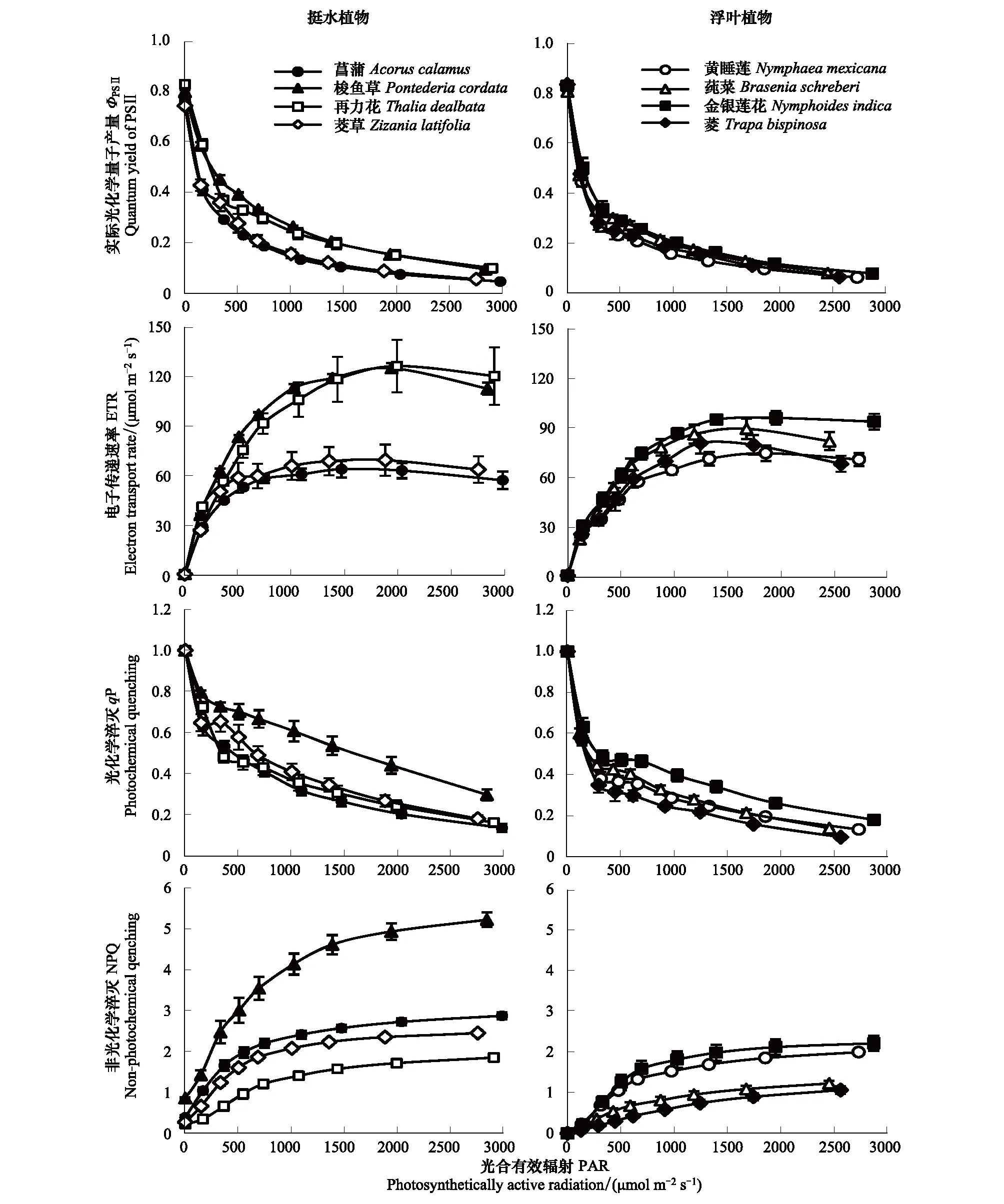
图2 两种生活型水生植物的实际光化学量子产量ΦPSⅡ、电子传递速率ETR、光化学淬灭qP和非光化学淬灭NPQFig.2 Quantum yield of PSⅡ, electron transport rate, photochemical quenching and non-photochemical quenching of the two life forms of aquatic macrophytes
2.3 两种生活型水生植物ETR曲线拟合分析
上述ETR曲线均可以用指数衰减方程较好地拟合,其中挺水植物拟合度R2>0.983,浮叶植物拟合度R2>0.957(n=5)。拟合结果显示,挺水植物ETR曲线初始斜率α普遍高于浮叶植物(表1),前者物种间α值变化范围也略大于后者。前者α值由大到小依次为梭鱼草>茭草>再力花>菖蒲,后者α值由大到小依次为金银莲花>莼菜>菱>黄睡莲。实验中挺水植物与浮叶植物光抑制系数β虽略有差异,但两者数值均极低。除浮叶植物莼菜和菱β值为0.014外,其余植物的β值均≤0.01,说明所测水生植物均不容易发生高光抑制。
经拟合所得最大潜在电子传递速率Ps和最大电子传递速率ETRm在不同植物中的变化趋势与实测最大ETR值相同,均表现为挺水植物中变化范围大于浮叶植物,且梭鱼草和再力花在所有植物中较高,菖蒲和茭草在所有植物中较低。
不同挺水植物间最小饱和光强Ek变化范围也明显大于浮叶植物,其中再力花Ek值显著高于菖蒲和茭草(P<0.05),梭鱼草Ek值居中并和所有浮叶植物Ek值接近。再力花饱和光强Em值也最高,茭草Em值最低。两者之间差异显著(P<0.05),但与其他植物差异不显著。
2.4 两种生活型水生植物比叶重SLW的分析
挺水植物叶片整体SLW小于浮叶植物,但两者内部SLW值变化幅度均较大(图3)。挺水植物菖蒲、梭鱼草、再力花之间SLW值略有差异(P<0.05),但变化幅度不大。茭草SLW则显著低于其他植物(P<0.05)。浮叶植物金银莲花SLW值在所有植物中最高(P<0.05),莼菜和菱SLW值在浮叶植物中相对较低(P<0.05)。
2.5 两种生活型水生植物叶片色素的分析
受SLW影响,实验中单位叶面积和单位叶鲜重计量方式下水生植物之间的色素含量变化趋势略有差异,但均显示挺水植物叶绿素(Chls)含量整体高于浮叶植物(图4)。以单位叶面积计算,挺水植物中菖蒲Chls含量最高,再力花其次,梭鱼草和茭草均较低(P<0.05)。但由于茭草比叶重极小,其单位叶鲜重的Chls8种水生
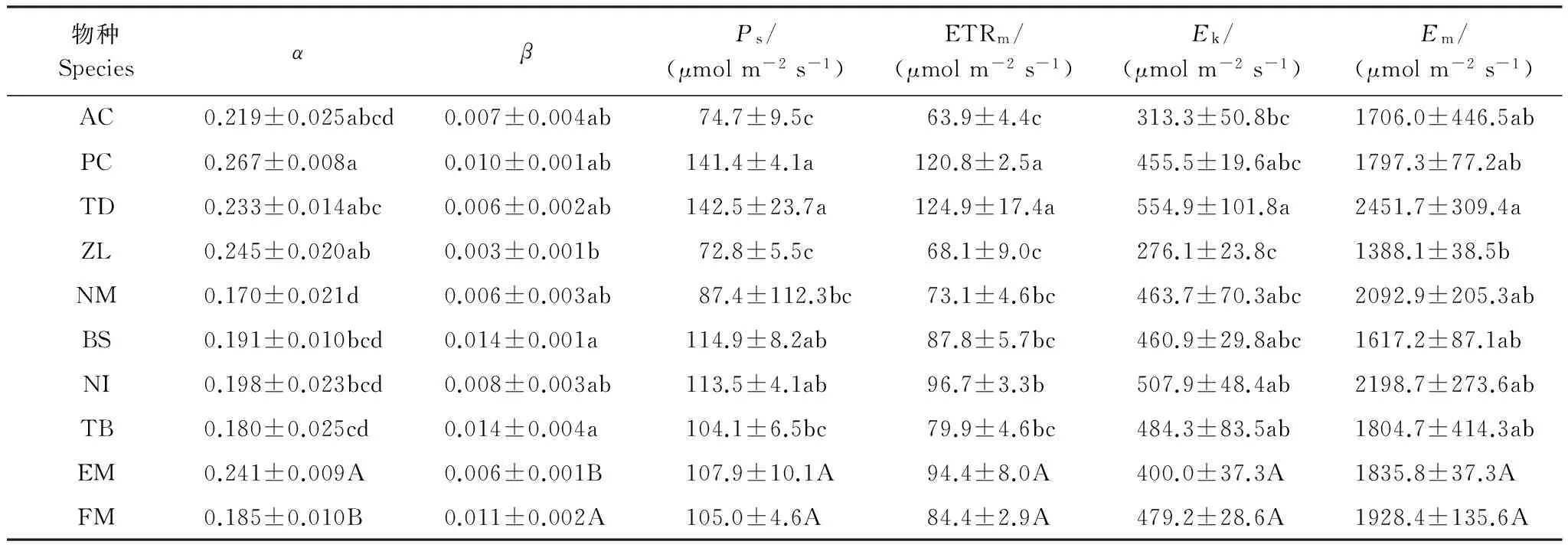
表1 两种生活型水生植物ETR曲线的拟合参数
AC:菖蒲Acoruscalamus;PC:梭鱼草Pontederiacordata;TD:再力花Thaliadealbata;ZL:茭草Zizanialatifolia;NM:黄睡莲Nymphaeamexicana;BS:莼菜Braseniaschreberi;NI:金银莲花Nymphoidesindica;TB:菱Trapabispinosa;EM:挺水植物;FM:浮叶植物;α:初始斜率 Initial slope;β:抑制系数 Photoinhibition coefficient;Ps:最大潜在电子传递速率 Maximum potential electron transport rate;ETRm:最大电子传递速率 Maximum electron transport rate;Ek:最小饱和光强 Minimum saturating irradiance;Em:饱和光强 Saturating irradiance;表中数据为平均值±标准误差(同一物种,n=5;同一生活型,n=20),不同小写、大写字母分别代表物种间、生活型间差异显著(P<0.05)
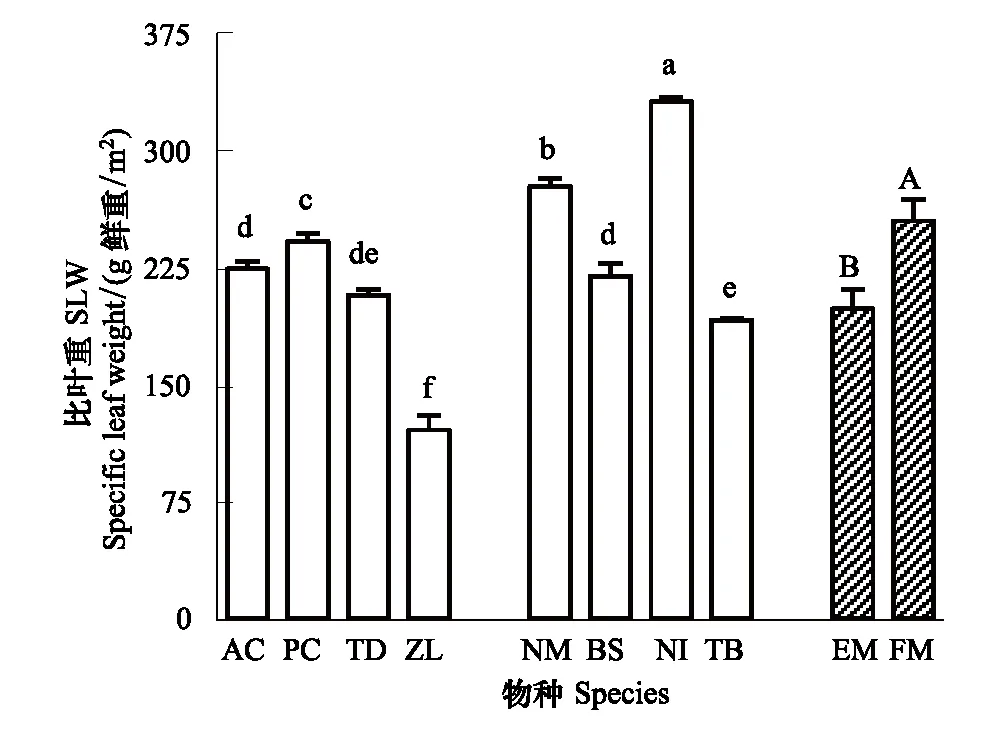
图3 两种生活型水生植物的比叶重SLW Fig.3 Specific leaf weight of the two life forms of aquatic macrophytesAC:菖蒲 Acorus calamus;PC:梭鱼草 Pontederia cordata;TD:再力花 Thalia dealbata;ZL:茭草 Zizania latifolia;NM:黄睡莲 Nymphaea mexicana;BS:莼菜 Brasenia schreberi;NI:金银莲花 Nymphoides indica;TB:菱 Trapa bispinosa;图中带斜杠的数据为同一生活型的均值,EM:挺水植物;FM:浮叶植物;图中数据为平均值±标准误差(同一物种,n=4;同一生活型,n=16),数据顶部不同小写、大写字母分别表示物种间、生活型间差异显著(P<0.05)
含量比菖蒲还高(P<0.05)。浮叶植物中单位叶面积Chls含量由高到低依次为莼菜>黄睡莲>金银莲花和菱。以单位叶鲜重计,莼菜Chls含量仍然最高,但金银莲花显著低于黄睡莲和菱(P<0.05)。上述除再力花Chla/b的比值为5.4以外(P<0.05,图4),其余植物Chla/b比值均为4左右。
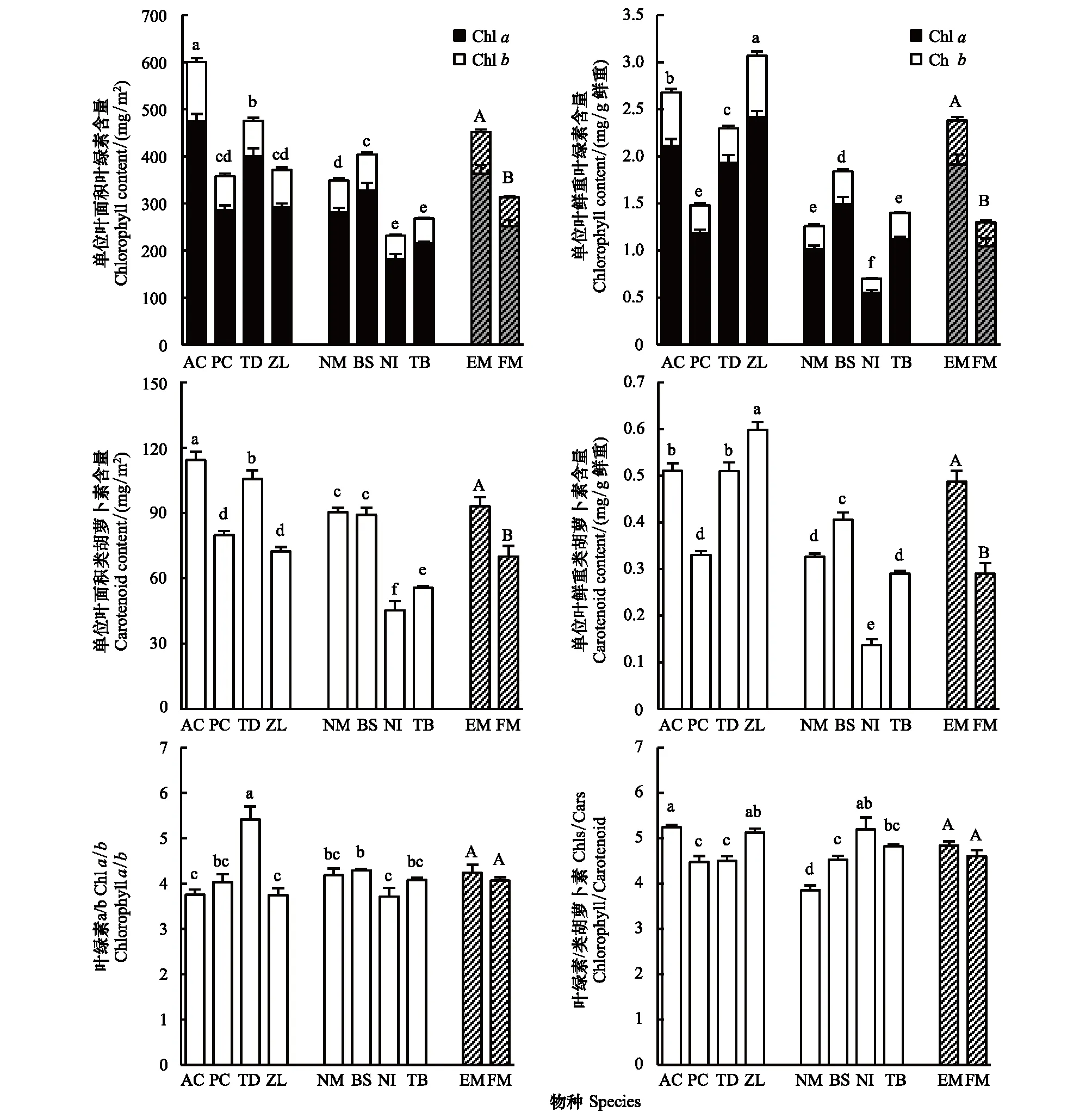
图4 两种生活型水生植物的光合色素含量Fig.4 Photosynthetic pigment content of the two life forms of aquatic macrophytesAC:菖蒲 Acorus calamus;PC:梭鱼草 Pontederia cordata;TD:再力花 Thalia dealbata;ZL:茭草 Zizania latifolia;NM:黄睡莲 Nymphaea mexicana;BS:莼菜 Brasenia schreberi;NI:金银莲花 Nymphoides indica;TB:菱 Trapa bispinosa;图中带斜杠的数据为同一生活型的均值,EM:挺水植物;FM:浮叶植物;图中数据为平均值±标准误差(同一物种,n=5;同一生活型,n=20),数据顶部不同小写、大写字母分别表示物种间、生活型间差异显著(P<0.05);叶绿素含量图中的字母代表总叶绿素(Chl a+Chl b)差异的显著性
植物类胡萝卜素(Cars)含量的差异与Chls相似(图4)。挺水植物中,菖蒲和再力花单位叶面积Cars含量高于梭鱼草和茭草(P<0.05),但以单位叶鲜重计,茭草最高(P<0.05)。浮叶植物中,黄睡莲和莼菜单位叶面积Cars含量高于金银莲花和菱(P<0.05),单位叶鲜重计,其含量由高到低为莼菜>黄睡莲、菱>金银莲花。有关Chls/Cars比值,挺水植物和浮叶植物之间没有显著差异。挺水植物中菖蒲和茭草较高,梭鱼草和再力花略低(P<0.05)。浮叶植物中金银莲花略高,黄睡莲略低(P<0.05)。
3 讨论
植物对不同环境条件的光合适应表现在形态、结构、生理等各个水平[20- 21]。从生理学角度,一般认为PSⅡ对强光及高温等胁迫因子的敏感性大于光系统Ⅰ(PSⅠ)[22],故反映PSⅡ光合生理状态的荧光参数Fv/Fm、ΦPSⅡ、ETR、NPQ等常被用来评估植物的光合生理状态。其中经充分暗适应后所得Fv/Fm值能反映PSⅡ反应中心内禀光能转换能力。当植物受到环境胁迫而PSⅡ反应中心受到损伤时,Fv/Fm值将显著下降[16]。本实验中8种水生植物的Fv/Fm值均大于0.8,表明所测植株均处于健康状态。
研究显示,挺水植物Fv/Fm、ΦPSⅡ、ETR、NPQ等参数的变化幅度均大于浮叶植物。该结果验证了我们初期的假设,挺水植物所处环境异质性大,其光合荧光参数变化幅度宽;而浮叶植物所处环境相对均一,其光合荧光特性也趋同。挺水植物光合荧光参数较大的可塑性应该是其长期适应性进化的结果。王金旺等[2]也曾证实挺水植物的生态位宽度普遍高于浮叶植物,类似叶片光合适应机制与所处环境的相关性在陆生植物中也有报道[23]。
按照Ralph等[17]的理论,ETR曲线拟合所得初始斜率α值反映植物在弱光区的光合能力,与叶片的捕光能力成正比。本研究显示挺水植物整体α值大于浮叶植物,由此可推测挺水植物整体的捕光能力大于浮叶植物。该α值整体上可以和色素含量相对应。光合色素是植物吸收光能并实现最初光电转换的重要载体[24],本实验中挺水植物Chls和Cars含量整体高于浮叶植物。但就同一生活型的不同植物之间,上述对应关系并不明确。这中间可能还涉及叶片结构等其他因素的影响,相关问题仍有待进一步研究。另外Ek反映植物对光能的利用方式,与荧光淬灭有关,PAR
有关强光下水生植物的适应机制,挺水植物和浮叶植物之间可能存在较大差异。植物叶片对高光辐射的防御机制包括主动避光(如避光运动)、生理保护(如热耗散)以及损伤修复(如PSⅡ修复)等[25]。其中非光化学淬灭(热耗散)是PSⅡ的主要光合保护机制[26- 27]。实验中挺水植物NPQ值普遍较高。其中梭鱼草随着光强的增加NPQ值也出现了最大幅度的提高,可推测其通过非光化学淬灭进行高光保护的能力最强。实验中再力花比较特殊,其Fv/Fm、ΦPSⅡ、ETR值很高,但NPQ却相对略低。有报导强光下叶片能合拢的物种的NPQ值显著低于叶片不能合拢的物种,叶片合拢能弥补对PSⅡ光保护的生理缺失[28]。再力花的横出平行叶脉有利于卷曲合拢,但是否能据此进行高光保护还有待探究。实验中浮叶植物NPQ随光强的变化范围明显低于挺水植物,该结果证实了我们初期的假想,基于非光化学淬灭的光保护能力对浮叶植物可能并不十分重要。浮叶植物叶片由于下表面与水充分接触,可通过水的缓冲带走过多的热量,以维持叶温稳定。不过NPQ值过低也不利于高光下浮叶植物的生长。我们发现莼菜NPQ值极低,实验室培植过程中也发现莼菜叶片在强光高温下快速腐烂的问题。张雷等[29]也曾报道莼菜具有夏眠现象。这很可能与莼菜NPQ值极低有关,莼菜PSⅡ光保护能力较弱,不适宜在高温强光下生长。另外,有研究表明叶黄素循环在叶片耗散过剩光能过程中起重要作用[30- 31]。我们推测叶黄素循环Cars含量和NPQ值存在一定相关性,实验中也发现挺水植物Cars含量整体高于浮叶植物,但现有数据尚不能得出水生植物中Cars与NPQ值之间的显著联系。本实验未涉及沉水植物,由于水下光照有限,对低光的适应是其生存的关键[32],我们推测强光保护机制在沉水植物中并不重要。
有关Chla/b和Chls/Cars的比值,一般陆地阳生叶片Chla/b比值3.0—3.4,Chls/Cars比值3.8—4.4;阴生叶片Chla/b比值2.4—2.7, Chls/Cars比值4.8—5.7[33]。我们实验所选8种水生植物的Chla/b比值均大于3.7,可认为所测水生植物均为阳生植物。再力花Chla/b比值甚至高达5.4,似乎与其高光合能力相对应。挺水植物梭鱼草和再力花Chls/Cars比值接近4.4,符合阳生植物特征;但菖蒲和茭草Chls/Cars比值均超过5.1,更像阴生植物。浮叶植物金银莲花也存在Chls/Cars比值(5.2,接近陆地阴生植物)和光合能力都很高的矛盾。上述结果也暗示了水生植物色素比例的复杂性,水生植物色素之间的作用和协调机制可能与陆生植物存在巨大差异。至于SLW在不同水生植物中的差异,及由此导致的两种单位表达方式下光合色素含量变化规律的不一致性,Lichtenthaler等[33]也曾表述用不同参数系统进行比较可能得到完全相反的结果。由此可见,在对不同实验结果进行比较时,必须注意研究方法和单位的一致性。
4 结论
挺水植物叶片相对浮叶植物所处环境异质性较大,因而挺水植物Fv/Fm、ΦPSⅡ、ETR、NPQ等光合荧光参数以及叶绿素、类胡萝卜素含量的变化范围均大于浮叶植物。由ETR曲线拟合所得Ps、ETRm、Ek、Em等参数也证实了这一特征。挺水植物NPQ值随光强的变化范围较大,表明热耗散是其高光保护的重要机制;浮叶植物NPQ热耗散对高光辐射的保护意义不明显,其可能更多地依赖水体直接带走多余的热量。由于水生植物叶片含水量较高且不同植物间 SLW值差异较大,导致不同水生植物间单位叶面积和单位叶鲜重的色素含量变化规律存在一定差异。但挺水植物色素含量整体高于浮叶植物,且所有水生植物的Chla/b的比值普遍高于陆生植物。结合Chls/Cars比值,挺水植物中再力花、梭鱼草光合能力较强,为典型阳生型;菖蒲、茭草光合能力较弱,部分指标符合阴生型特征。实验所测4种浮叶植物均属于阳生型,但物种间光合荧光参数变化幅度相对较小,其色素组成与其光合能力强弱之间的关系不能简单套用陆生植物相关理论进行解释。
参考文献(References):
[1] Russi D, ten Brink P, Farmer A, Badura T, Coates D, Förster J, Kumar R, Davidson N. The Economics of ecosystems and biodiversity for water and wetlands. Executive Summary. London: IEEP, 2013.
[2] 王金旺, 邹颖颖, 于丹. 瓯江流域水生植物多样性与生态位研究. 水生生物学报, 2015, 39(6): 1184- 1197.
[3] Chambers P A, Lacoul P, Murphy K J, Thomaz S M. Global diversity of aquatic macrophytes in freshwater. Hydrobiologia, 2008, 595(1): 9- 26.
[4] 李冬林, 王磊, 丁晶晶, 芮雯奕. 水生植物的生态功能和资源应用. 湿地科学, 2011, 9(3): 290- 296.
[5] Wang C, Zheng S S, Wang P F, Qian J. Effects of vegetations on the removal of contaminants in aquatic environments: A review. Journal of Hydrodynamics, 2014, 26(4): 497- 511.
[6] Kingsford R T, Basset A, Jackson L. Wetlands: conservation′s poor cousins. Aquatic Conservation: Marine and Freshwater Ecosystems, 2016, 26(5): 892- 916.
[7] 崔丽娟, 张骁栋, 张曼胤. 中国湿地保护与管理的任务与展望——对《湿地保护修复制度方案》的解读. 环境保护, 2017, (4): 13- 17.
[8] Zhou C F, Jia X B, Liu J N, Bai X H, Xu G M, Hu F Q, Shen R L, Li H L, An S Q. Wetland restoration in highly eutrophicated fish ponds in east China. // Carey P, ed. Landscape ecology and conservation (Proceedings of the 15th annual IALE (UK) conference). Cambridge, UK: IALE, 2008: 25- 32.
[9] Stefanik K C, Mitsch W J. Structural and functional vegetation development in created and restored wetland mitigation banks of different ages. Ecological Engineering, 2012, 39: 104- 112.
[10] 秦伯强, 张运林, 高光, 朱广伟, 龚志军, 董百丽. 湖泊生态恢复的关键因子分析. 地理科学进展, 2014, 33(7): 918- 924.
[11] 宋玉芝, 蔡炜, 秦伯强. 太湖常见浮叶植物和沉水植物的光合荧光特性比较. 应用生态学报, 2009, 20(3): 569- 573.
[12] 李杨, 潘珉, 何锋, 宋任彬, 杜劲松. 不同底质对海菜花叶绿素荧光诱导动力学参数及净光合速率的影响. 生态学报, 2017, 37(8): 2809- 2817.
[13] Ritchie R J. Photosynthesis in the blue water lily (NymphaeacaeruleaSaligny) using pulse amplitude modulation fluorometry. International Journal of Plant Science, 2012, 173(2): 124- 136.
[14] 简敏菲, 汪斯琛, 余厚平, 李玲玉, 简美锋, 余冠军. Cd2+、Cu2+胁迫对黑藻(Hydrillaverticillata)的生长及光合荧光特性的影响. 生态学报, 2016, 36(6): 1719- 1727.
[15] 胡楚琦, 刘金珂, 王天弘, 王文琳, 卢山, 周长芳. 三种盐胁迫对互花米草和芦苇光合作用的影响. 植物生态学报, 2015, 39(1): 92- 103.
[16] Maxwell K, Johnson G N. Chlorophyll fluorescence—a practical guide. Journal of Experimental Botany, 2000, 51(345): 659- 668.
[17] Ralph P J, Gademann R. Rapid light curves: A powerful tool to assess photosynthetic activity. Aquatic Botany, 2005, 82(3): 222- 237.
[18] Mishanin V I, Trubitsin B V, Benkov M A, Minin A A, Tikhonov A N. Light acclimation of shade-tolerant and light-resistantTradescantiaspecies: induction of chlorophyllafluorescence and P700photooxidation, expression of PsbS and Lhcb1 proteins. Photosynthesis Research, 2016, 130(1/3): 275- 291.
[19] Lichtenthaler H K, Wellburn A R. Determinations of total carotenoids and chlorophyllsaandbof leaf extracts in different solvents. Biochemical Society Transactions, 1983, 11(5): 591- 592.
[20] 陈修文, 于丹, 刘春花. 秋季水位波动频率对喜旱莲子草、粉绿狐尾藻和水龙的影响. 植物生态学报, 2016, 40(5): 493- 501.
[21] Zivcak M, Kalaji H M, Shao H B, Olsovska K, Brestic M. Photosynthetic proton and electron transport in wheat leaves under prolonged moderate drought stress. Journal of Photochemistry and Photobiology B: Biology, 2014, 137: 107- 115.
[22] Gururani M A, Venkatesh J, Tran L S P. Regulation of photosynthesis during abiotic stress-induced photoinhibition. Molecular Plant, 2015, 8(9): 1304- 1320.
[23] Zhou Y, Huang L H, Wei X L, Zhou H Y, Chen X. Physiological, morphological, and anatomical changes inRhododendronagastumin response to shading. Plant Growth Regulation, 2017, 81(1): 23- 30.
[24] Mirkovic T, Ostroumov E E, Anna J M, van Grondelle R, Govindjee, Scholes G D. Light absorption and energy transfer in the antenna complexes of photosynthetic organisms. Chemical Reviews, 2017, 117(2): 249- 293.
[25] 董潇潇, 靳红磊, 王宏斌. 植物光系统高光适应机制研究进展. 植物生理学报, 2016, 52(11): 1725- 1732.
[26] Brestic M, Zivcak M, Kunderlikova K, Sytar O, Shao H B, Kalaji H M, Allakhverdiev S I. Low PSI content limits the photoprotection of PSI and PSII in early growth stages of chlorophyllb-deficient wheat mutant lines. Photosynthesis Research, 2015, 125(1/2): 151- 166.
[27] Brestic M, Zivcak M, Kunderlikova K, Allakhverdiev S I. High temperature specifically affects the photoprotective responses of chlorophyllb-deficient wheat mutant lines. Photosynthesis Research, 2016, 130(1/3): 251- 266.
[28] Huang W, Zhang S B, Cao K F. Evidence for leaf fold to remedy the deficiency of physiological photoprotection for photosystem II. Photosynthesis Research, 2012, 110(3): 185- 191.
[29] 张雷, 王凌云, 陈淑玲. 莼菜的特征特性及栽培管理技术. 现代农业科技, 2015, (12): 101- 102, 113- 113.
[30] Jahns P, Holzwarth A R. The role of the xanthophyll cycle and of lutein in photoprotection of photosystem II. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2012, 1817(1): 182- 193.
[31] Joubert C, Young P R, Eyéghé-Bickong H A, Vivier M A. Field-grown grapevine berries use carotenoids and the associated xanthophyll cycles to acclimate to UV exposure differentially in high and low light (shade) conditions. Frontiers in Plant Science, 2016, 7: 786, doi: 10.3389/fpls.2016.00786.
[32] 吴明丽, 李叙勇. 光衰减及其相关环境因子对沉水植物生长影响研究进展. 生态学报, 2012, 32(22): 7202- 7212.
