短期氮磷配施对刨花楠细根形态及其土壤微生物的影响
2018-05-16钟全林徐朝斌张中瑞程栋梁
王 艳,钟全林,*,徐朝斌,张中瑞,程栋梁
1 福建师范大学地理科学学院, 福州 350007 2 湿润亚热带山地生态国家重点实验室培育基地/福建省植物生理生态重点实验室, 福州 350007
人类活动使氮沉降逐年增加,氮输入的增加不仅会引起地上生态系统发生一系列的变化,对地下生物群落(主要是细根和土壤微生物)也有重要影响。细根是植物养分和水分的“源”[1],其形态特征的变化可以用来衡量植物养分及水分的吸收利用状况,并指示植物对环境变化的适应策略。以往的研究大多将根系按直径大小分为粗根和细根,但该方法忽略了不同级别细根的生理功能差异,掩盖了根系结构和功能之间的联系[2],而Pregizter 等人提出的根序分级方法则避免了这些问题,能较好地揭示细根生理生态特征[2]。不同根序的细根形态对土壤氮磷养分的添加有不同的响应。施氮可显著增加日本扁柏(Chamaecyparisobtusa)1—3级细根的比根长,并显著降低其组织密度[3];马尾松(pinusmassoniana)细根根长和根表面积随磷肥施用量的增加有增加的趋势,但生长一定时期后磷肥用量增加到一定程度就对细根根长和根表面积的作用不明显[4]。日本落叶松(Larixkaempfer)表层土壤内(0—10cm)一级根平均根长在氮磷配施后显著降低,而其亚表层(10—20cm)三级根的组织密度则显著增加,但日本落叶松各级根序细根比表面积和平均直径对氮磷配施的响应则均不显著[5]。
土壤微生物是地下生物群落的另一重要组成部分,对环境变化敏感,在物质循环和养分流动中发挥着重要作用[6],氮磷添加对其也有重要影响。添加氮会提高土壤微生物总磷脂脂肪酸(PLFA)含量和土壤细菌、放线菌 PLFA 生物标记数量,但对真菌 PLFA 生物标记数量影响不明显[7];高磷处理(30g m-2a-1)显著增加细菌、真菌的丰度,低磷(5g m-2a-1)和中磷(15g m-2a-1)处理则使真菌/细菌降低[8];但Liu等对氮磷同时添加进行研究则发现:氮磷配施对土壤微生物没有交互影响[9]。
细根和土壤微生物作为地下生物群落的主要组成部分,二者之间存在诸多联系,细根可为土壤微生物提供碳源和根系分泌物等养分,而微生物的侵染又能提高细根养分吸收能力[10],而且二者均与土壤养分存在密切的关系并对土壤养分的变化十分敏感,然而关于细根、土壤微生物和土壤养分三者及其相互关系如何响应于氮磷配施的研究鲜有报道。因此,本文计划以刨花楠为对象,通过模拟氮沉降,研究氮磷配施对不同根序的细根形态特征和土壤微生物的影响,并分析氮磷配施情况下细根和土壤微生物间的相互关系,研究结果为评估全球氮沉降等环境变化问题对我国亚热带地区森林植物地下生物群落及地下生态系统养分流动的影响等提供理论依据。
刨花楠(Machiluspauhoi)为樟科润楠属,又名刨花树、楠木等,是分布于我国亚热带的一种常绿阔叶乔木树种,其生长速度快,外形美观,既是珍贵用材树种又是优美的家庭观赏树。目前国内对刨花楠的研究主要集中在对刨花楠地上部分的研究,例如,刨花楠叶片表型性状[11]、生长特性[12]、叶片化学计量比特征[13]等方面,而有关氮磷配施对刨花楠地下生物群落影响的研究则未见相关报道,因此本文以1年生刨花楠幼苗为研究对象开展这方面的研究,以期解决以下几个问题:(1)刨花楠幼苗不同根序的细根形态(比根长、比根面积、平均直径和组织密度)是如何响应于氮磷配施?(2)在氮磷配施条件下,不同根序的细根形态与土壤微生物之间存在何种关系?研究结果可为探究最适合刨花楠幼苗阶段生长的施肥模式,精准施肥提供理论依据,并可为进一步探讨亚热带常绿阔叶林地下生物群落(主要是细根和土壤微生物)对全球环境变化(如氮沉降等)的响应与适应机制等提供理论参考,对于研究常绿乔木树种幼苗更新及维护其地下生态系统的稳定性等也具有重要现实意义。
1 材料与方法
1.1 实验地概况
试验地位于福建省南平市顺昌县(26°38′—27°121′N,117°29′—118°14′E),该区域属于亚热带季风气候,气候温暖,雨量充沛,阳光充足,四季分明,年平均气温为18.9℃,最冷月1月份平均气温7.9℃,最热月7月份平均气温28.1℃。年平均降水量一般在1600—1900mm之间,降水多集中在2—9月,约占全年降水量的86.6%;全年平均无霜期为305d,年平均日照时数约1740.7h。
1.2 实验设计
本实验在福建省南平市顺昌县林技中心的高度约2.5m的大棚内进行,大棚用50%透光率的遮阳网罩盖,不封闭四周通风。来源于江西省遂川县的180株1年生刨花楠实生苗作为实验苗,实验苗个体初始大小基本相同,平均地径为(4.5±0.11)mm,平均树高为(30±0.04)cm。于2014年7月1日将取自顺昌县造林地的常规山地红壤土进行充分拌匀,并将其装入实验盆内,实验盆是上、下底直径分别为32cm和20cm,高30cm的PVC花盆,装土高度为离上口径2cm处(以便于水分管理),土壤初始养分全碳、全氮、全磷含量分别为(3.747±0.27)mg/g、(0.739±0.14)mg/g和(0.0407±0.06)mg/g。将所选取的苗木移栽到装好土壤的实验盆内,每盆栽植1株,待苗木移入盆内1个月且生长相对稳定后,测定其地径、株高和冠幅等指标,并开始进行不同氮磷比模拟添加实验。实验按照N添加量固定而P添加量根据不同N∶P比确定,N添加量按100kg hm-2a-1纯N计算,盆内土壤施肥面积肥面积按直径30cm计算。共设置5个处理水平,即对照(CK,不施肥)、NP1(按N∶P为8∶1的比例添加)、NP2(按N∶P为10∶1的比例添加)、NP3(按N∶P为12∶1的比例添加)、NP4(按N∶P为15∶1的比例添加),每个处理设置4个重复,每个重复有9盆,5个处理共180盆(即每个处理共36盆)。N肥用NH4NO3,P肥用P2O5,将所计算的NH4NO3与P2O5量均分成6等份,每隔2周施1次,共施了6次。根据不同处理的实验盆总面积(即36个盆的施肥面积),用电子天平称取每次各处理所需的NH4NO3与P2O5质量,并将其完全溶于360mL蒸馏水中。每盆用移液枪吸取10mL(CK处理每盆仅添加10mL蒸馏水),沿盆内侧距盆内沿1cm处均匀滴注1圈。全部实验苗木均进行常规水分管理。
1.3 实验观测、取样
于施肥处理后的第12周对实验苗木进行调查。在对其株高、地径和冠幅等生长特征指标进行调查后,采取全株收获法对其生物量进行收获,挑出直径<2mm的细根,并按照Pregizter 等人提出的根序分级方法[4]进行细根根序分级,把最前端的根尖定义为1级根,1级根的母根定义为2级根,依此类推,确定前4级细根。用EPSON v370扫描仪分别对各根序细根进行扫描,并用WinRHIZO根系图像分析软件分析细根图像,直接得到细根的根长、表面积、体积、平均直径等指标;把不同根序的细根分别用信封包好,置于65℃恒温烘箱中将其烘干至恒重,用电子天平称干重,并按如下公式计算各级根序的比根长、比根面积和组织密度等细根形态指标。
比根长(SRL)=细根根长(m)/细根生物量(g)
比根面积(SRA)=细根根表面积(cm2)/细根生物量(g)
根组织密度(RTD)=细根生物量(g)/细根体积(cm3)
另外分别将各处理每个重复的各盆土壤倒出混合,在去除凋落物、杂草等杂质后,取出400g土样,并将其等分成2份,一份用于测量土壤理化性质,另一份用于测量土壤微生物。
1.4 测定方法
土壤全氮和全碳采用 CN 元素分析仪(Elementar Vario EL III,Elementar,德国) 测定,全磷含量采用硫酸-高氯酸消煮提取后,由连续流动分析仪测定。土壤微生物磷脂脂肪酸(PLFAs)的测定主要是参照Bossio 等人的方法[14],该法以甲酯化后的C19:0为内标,通过气相色谱仪(Agilent 6890 N,美国)进行测定,每种脂肪酸的浓度基于内标C19:0的浓度来计算,单个脂肪酸种类用nmol/g干土来表示。
1.5 数据处理
运用SPSS 21.0软件中的单因素方差分析方法分析细根功能性状和土壤微生物各菌群磷脂脂肪酸量的差异,运用Canoco 5进行细根形态特征与根际土壤微生物的RDA分析,采用Origin9.0软件作图。
2 结果与分析
2.1 氮磷配施对刨花楠细根主要形态特征的影响
1—2级根的SRL在4个施肥处理上均显著高于对照(P<0.05),3级根的SRL除了在NP2处理上差异不显著(P>0.05),在其余施肥处理上均显著高于对照(P<0.05),而4级根的SRL则在NP2处理上显著低于对照(P<0.05),在其余施肥处理上与对照差异不显著(P>0.05)(图1),总体上3—4级根的SRL的响应没有呈现明显的规律性。
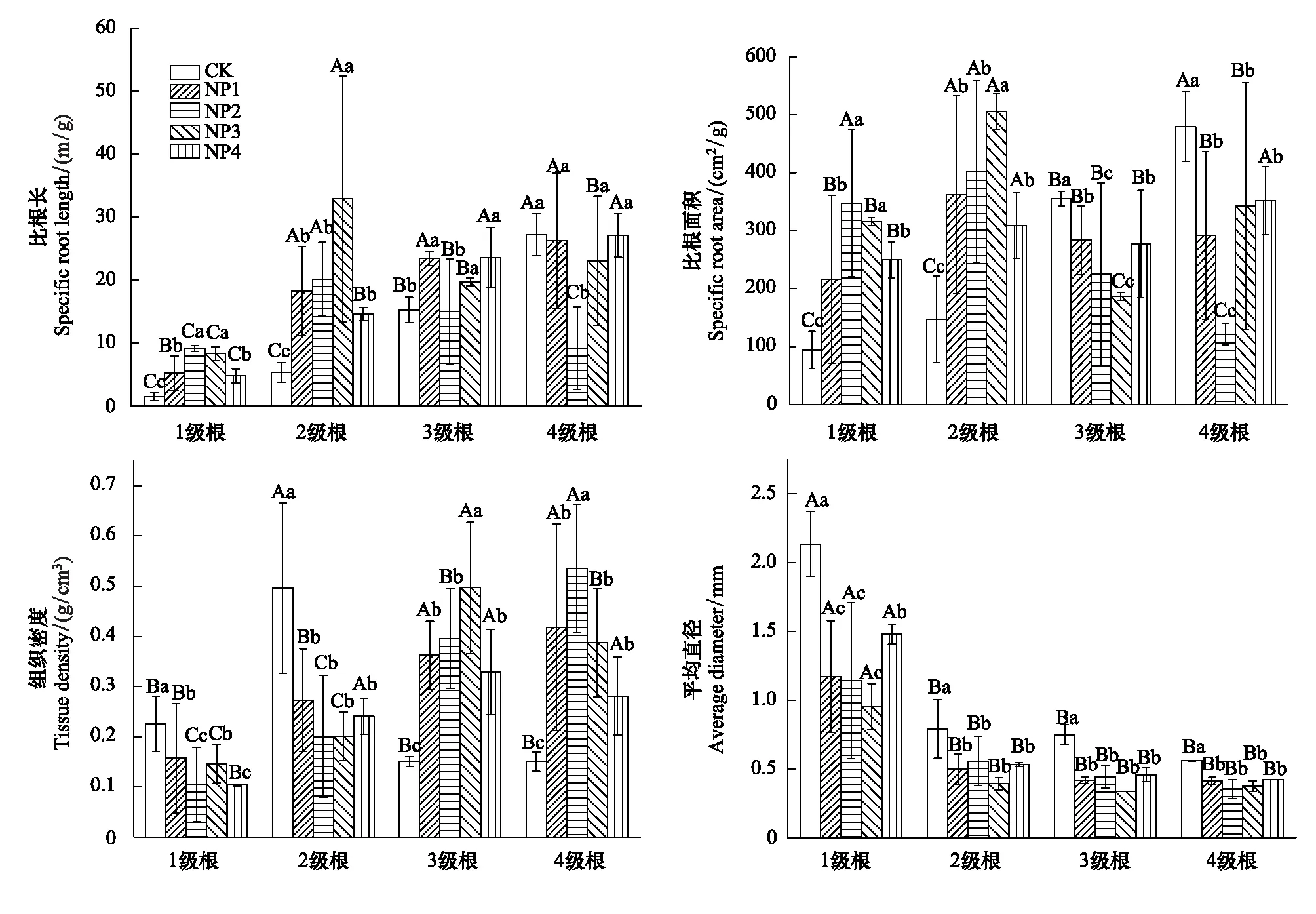
图1 不同处理对各级细根比根长、比根面积、组织密度和平均直径的影响Fig.1 Effect of different treatments on SRL,SRA,RTD and average diameter of different order fine roots不同大写字母表示同一处理不同根序间细根形态特征之间存在显著差异(P<0.05);不同小写字母表示同一根序不同处理之间存在显著差异(P<0.05);CK、NP1、NP2、NP3、NP4分别表示氮磷配施的比例即N∶P分别为0、8∶1、10∶1、12∶1、15∶1
1—2级根的SRA在各施肥处理上均显著高于对照(P<0.05),而3—4级根的SRA则表现为各施肥处理均显著低于对照(P<0.05)(图1)。随着P添加量的减少(即N∶P的增加),3—4级根的SRA呈现先降低后增加的趋势。其中,3级根的SRA以NP3处理为最小,4级根则以NP2处理为最小(图1)。
1—2级根的RTD在4个施肥处理上显著低于对照(P<0.05),而3—4级根的组织密度则显著高于对照(P<0.05),并呈现出先增加后降低的趋势(图1)。
1—4级根的平均直径在各施肥处理上均显著低于对照(P<0.05),且1级根的平均直径降幅最大(图1)。此外,就同一处理而言2—4级细根的平均直径显著低于1级根(P<0.05)。
2.2 氮磷添加对根际土壤微生物的影响
与对照(CK)相比,适量的氮磷添加可促进细菌、革兰氏阳性细菌(G+)和革兰氏阴性细菌(G-)的生长,氮磷配施也不同程度地增加了土壤微生物总量、真菌、放线菌的磷脂脂肪酸含量,且细菌、放线菌、真菌和土壤微生物总量均呈现先增加后降低的趋势,以NP2处理为最大,且其显著高于其余处理(P<0.05)(图2)。
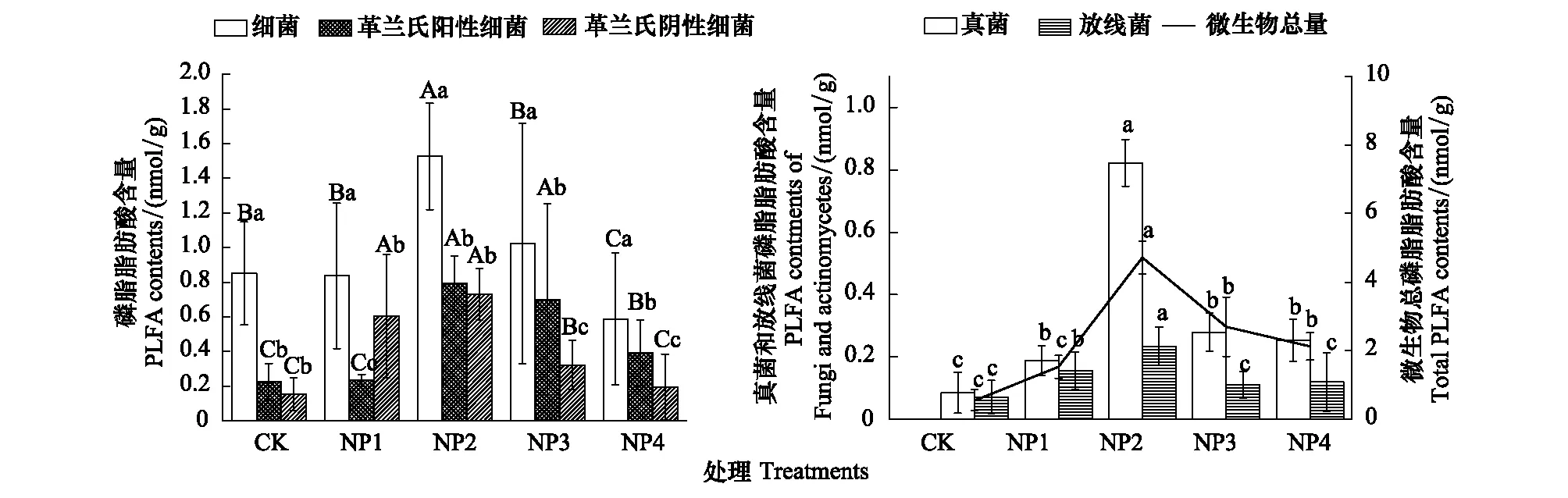
图2 不同处理对细菌、革兰氏阳性细菌、革兰氏阴性细菌、真菌、放线菌和微生物总磷脂脂肪酸含量的影响Fig.2 Effect of different treatments on bateria,G+,G-,Fungi,actinomycetes and total PLFA contents不同小写字母表示不同处理之间存在显著差异(P<0.05)
2.3 刨花楠细根主要形态指标与其土壤微生物菌群间的RDA分析
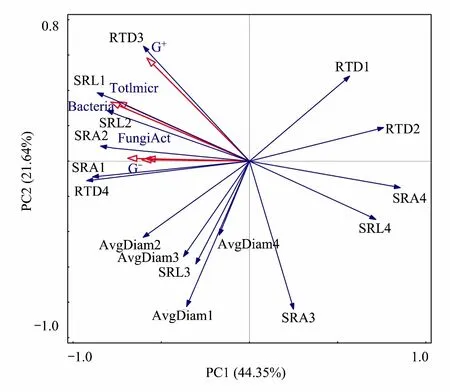
图3 细根4个形态指标与土壤微生物菌群之间的RDA分析 Fig.3 The RDA analysis of morphological indexes of different order fine roots with siol microbial图中1,2,3,4分别表示1,2,3和4级细根;SRL:比根长,Specific root length;SRA:比根面积,Specific root area;RTD: 组织密度,Root tissue density;AvgDiam:平均直径,Root average diameter;TOtIMicr:微生物总量,Total Microbe;细菌:Bacteria;真菌:Fungi;Act:放线菌,Actinomycetes;G-:革兰氏阴性细菌,Gram-negative bacteria;G+:革兰氏阳性细菌,Gram-positive bacteria
将不同根序的细根的SRA、SRL、RTD和平均直径(AvgDiam)等形态指标与微生物总量(Total Microbe)、细菌(Bacteria)、真菌(Fungi)、放线菌(Actinomycetes)、革兰氏阴性细菌(G-)、革兰氏阳性细菌(G+)等土壤微生物指标进行RDA分析(Redundancy Analysis,冗余分析)。RDA分析能够最大程度地精简变量并能有效评价一个(组)变量与另一个(组)变量之间的关系,相较于其他分析而言较简便高效。
结果显示,第一排序轴解释了细根形态指标变化的44.35%,第二排序轴解释了21.64%(图3)。图中指示各细根形态因子的箭头与指示微生物菌群指标的箭头之间夹角的余弦值代表它们之间的相关性,经过RDA分析中的Monte Carlo 置换检验可以看出1—2级根的SRL与细菌和微生物总量呈显著正相关,而4级根的SRL则与细菌和微生物总量呈显著负相关;1—2级根的SRA与真菌、放线菌和G-呈显著正相关,而4级根的SRA则与真菌、放线菌和G-均呈显著负相关;3级根的SRL和SRA与细菌、真菌等微生物各菌群相关关系均不显著(图3)。G+与3级根的RTD之间,以及真菌、放线菌和G-与4级根的RTD之间都呈显著正相关,但均与1—2级根的RTD无显著相关关系。微生物各菌群与各级根的平均直径之间的相关性均不显著,此外除了3级根的RTD,微生物各菌群与3级细根的其他形态指标也均无显著相关关系。
3 讨论
3.1 氮磷配施对细根形态的影响
根系不同的形态指标反映其不同的生理生态功能。SRL是单位细根生物量的根长,表征单位细根生物量的养分吸收利用效率[15],其值越大说明投入相同成本细根养分吸收利用效率越高[16];SRA是单位细根生物量的表面积,其值越大表明投入相同而具有更大的吸收表面积[17]。根系形态一定程度上可以指示土壤养分的状态,并通过调整其形态特征来适应土壤养分有效性的变化。本研究发现4种施肥处理均使1—2级细根的SRL和SRA都显著高于对照(P<0.05),而3—4级根的SRL则没有呈现明显的规律性,说明氮磷配施有利于提高1—2级细根的养分吸收效率,这可能跟细根解剖结构和生理功能有关,1—2级细根皮层组织发达,代谢较快,其主要功能是吸收养分和水分[18],因而受土壤养分有效性影响大,土壤氮磷有效性增加使1—2级细根将吸收的养分大部分用于细根的伸长和表面积的构建以获取更多的养分[19],而3—4级根维管束直径增加,皮层组织退化甚至消失,代谢慢,其主要功能可能是运输和储存养分[18],因而受土壤养分变化的影响相对较小。这与Liu等人的研究结果一致,低级根(1—2级)比高级根(3—5级)对施肥的响应更敏感[20]。此外,1级根与2级根的SRL和SRA分别在NP2、NP3处理条件下达到最大,表明氮磷配施比例在10∶1至12∶1的范围内更利于细根对养分的吸收。
RTD被视为一个反应根功能状况的特征,因为它和根的生理活性具有紧密的联系[21]。在没有施肥的条件下细根的RTD随根序的增加而增加[18],而本研究中随氮磷比的增加,1—2级细根的RTD相对于对照都有不同程度的降低(低于CK),而3—4级细根则呈增加的趋势(高于CK),说明1—2级细根养分吸收能力在加强,以满足植物在氮磷添加后快速生长时对养分的需求。4种施肥处理下低级根(1、2级根)的RTD和高级根(3、4级根)的比根面积总体上降低,而高级根(3、4级根)的RTD和低级根(1、2级根)的SRA总体上增加,一定程度上体现低级根与高级根之间响应于氮磷配施的一种权衡关系。另外,1—2级根的RTD以NP2处理为最小,说明可能NP2处理的刨花楠细根对养分的吸收能力最强。3—4级细根的RTD随氮磷比的增加呈先增加后降低的趋势,并以NP3处理为最大,表明可能NP3处理更利于细根木质部的构建。
直径大小影响植物吸收和运输的功能,也影响细根表面积[22]。在没有施肥的条件下,林木细根的平均直径均随着根序级别的增加而递增[18,23]。但在施肥之后不同根序细根的响应不同,施P肥及施N+P肥对日本落叶松各级根序细根的平均直径影响均不显著[7],施氮肥可显著降低了1—4级根的平均直径[20],本文研究结果也表明4种氮磷配施处理均使1—4级细根平均直径显著降低,其中1级根降幅最大,1级根在根系中生理活动最为活跃旺盛,其根尖细胞分裂速度快[24],而施肥之后可能加速1级细根扩散,数量增多,进而使其直径大幅度减小[25]。此外,施肥可能改变了细根的养分获取策略,有研究发现细根直径越小其生产周转就越快[26],4种氮磷配施处理均使1—4级根平均直径显著降低说明其生产周转速率在加快,并通过归还大量养分促进土壤养分循环以利于植物生长[27]。
3.2 氮磷添加对土壤微生物的影响
氮磷配施处理后,随着氮磷比的增加,微生物总量、细菌、真菌、放线菌、革兰氏阴性细菌、革兰氏阳性细菌磷脂脂肪酸含量均呈现先增加后降低的趋势,并均在NP2处理上达到最大。说明NP1、NP2处理的氮磷添加一定程度上缓解养分限制促进微生物各菌群的生长,并在NP2处理即氮磷比为10:1的时候最适合土壤微生物的生长,随着NP3、NP4处理的氮磷比的增加,磷相对受限,使磷成为土壤微生物的限制因子,因此各微生物菌群磷脂脂肪酸含量有所降低。
3.3 氮磷配施条件下刨花楠细根形态特征与其土壤微生物的相互关系
SRL和SRA是反映细根养分吸收效率的重要指标,真菌、细菌等微生物菌群与1—2级细根的SRL和SRA呈正相关,而与4级根的SRL和SRA则呈负相关,说明微生物对1—2级细根的养分吸收效率有积极影响,而与4级细根的养分吸收效率之间存在负反馈,这可能是由于1—2级细根具有较厚的皮层组织和细胞通道,菌丝侵染率较高[28],而微生物菌丝则可以延申到根周围营养匮乏区之外扩大细根的吸收表面积和空间范围[29],但是4级根没有皮层组织和通道细胞无法为微生物提供良好场所不利于菌丝侵染,其养分吸收能力减弱,同时这也说明随着根序的增加细根的吸收能力逐渐减弱[28]。
革兰氏阳性细菌、真菌等微生物菌群分别与3级和4级细根的RTD呈正相关,而与1—2级根的RTD无显著相关性。这可能是因为细根的RTD主要与木质部特征有关[30],3—4级细根的RTD增大,其维管束发达,纤维素和木质素含量高,这意味着其碳含量也高[31],且其生产周转慢养分消耗小,能使微生物菌群有较多的碳源等养分,因此其与微生物之间存在正相关。除了3级根的RTD外,微生物各菌群与3级细根的其他形态指标无显著相关性,这可能是由于3级根处于由初生生长到次生生长的过渡阶段属于过度根[28],其皮层组织、通道细胞等内部结构也处于一个过渡阶段,较少甚至没有菌丝侵染,因而微生物对3级根的多数形态指标的影响相对较小甚至没有显著影响。各根序细根平均直径与微生物各菌群均无显著相关性,说明微生物并不影响刨花楠细根的径向生长。
4 结论
氮磷配施对不同根序的细根形态结构、功能及其与土壤微生物的关系具有不同的影响,4种氮磷配施处理均显著增加了刨花楠1—2级细根的SRL和SRA,降低了3—4级根的SRA和1—2级细根的RTD,而使3—4级根的RTD显著增加(P<0.05)。此外,氮磷配施也使刨花楠1—4级细根的平均直径显著降低(P<0.05)。4个氮磷配施梯度中以NP2处理最能提高细根的养分吸收效率。在氮磷配施的条件下,真菌等微生物菌群对1—2级细根的SRL和SRA有积极影响,而与4级根的SRL和SRA之间存在负反馈;G+和真菌等微生物菌群与3—4级细根的RTD之间呈正相关,而与1—2级根的RTD无显著相关关系。除了3级根的RTD外,微生物与3级根的其他形态指标不存在显著相关关系,且与各级细根的平均直径也均无显著相关关系。
参考文献(References):
[1] Pinno B D, Wilson S D. Fine root response to soil resource heterogeneity differs between grassland and forest. Plant Ecology, 2013, 214(6): 821- 829.
[2] Pregitzer K S, Deforest J L, Burton A J, Allen M F, Ruess R W, Hendrick R L. Fine root architecture of nine North American trees. Ecological Monographs, 2002, 72(2): 293- 309.
[3] Makita N, HiranoY, Sugimoto T, Tanikawa T, Ishii H. Intraspecific variation in fine root respiration and morphology in response to in situ soil nitrogen fertility in a 100-year-oldChamaecyparisobtusaforest. Oecologia, 2015, 179(4): 959- 967.
[4] 周玮. 磷肥对马尾松苗木生长动态的影响. 湖北农业科学, 2014, 53(17): 4092- 4095.
[5] 于立忠. 施肥对日本落叶松细根形态特征及养分含量的影响[D]. 哈尔滨: 东北林业大学, 2006.
[6] Xu Z W, Yu G R, Zhang X Y, Ge J P, He N P, Wang Q F, Wang D. The variations in soil microbial communities,enzyme activities and their relationships with soil organic matter decomposition along the northern slope of Changbai Mountain. Applied Soil Ecology, 2015, 86: 19- 29.
[7] 施瑶, 王忠强, 张心昱, 孙晓敏, 刘希玉, 何念鹏, 庾强. 氮磷添加对内蒙古温带典型草原土壤微生物群落结构的影响. 生态学报, 2014, 34(17): 4943- 4949.
[8] Huang J S, Hu B, Qi K B, Chen W J, Pang X Y, Bao W K, Tian G L. Effects of phosphorus addition on soil microbial biomass and community composition in a subalpine spruce plantation. European Journal of Soil Biology, 2016, 72: 35- 41.
[9] Liu L, Zhang T, Gilliam F S, Gundersen P, Zhang W, Chen H, Mo J M. Interactive effects of nitrogen and phosphorus on soil microbial communities in a tropical forest. PLoS One, 2013, 8(4): e61188.
[10] Liu Q Y, Qiao N, Xu X L, Xin X P, Han J Y, Tian Y Q, Ouyang H, Kuzyakov Y. Nitrogen acquisition by plants and microorganisms in a temperate grassland. Scientific Reports, 2016, 6: 22642.
[11] 徐朝斌, 钟全林, 程栋梁, 胡松竹, 胡波, 伍伯妍, 孙晓媚, 张佩生. 江西4刨花楠种源苗木叶片表型性状与生物量分配的比较. 安徽农业大学学报, 2012, 39(6): 920- 924.
[12] 胡波, 钟全林, 程栋梁, 苏永堃, 徐朝斌. 刨花楠树高与胸径异速生长的关系. 沈阳大学学报: 自然科学版, 2012, 24(3): 9- 14.
[13] 张蕾蕾, 钟全林, 程栋梁, 张中瑞, 费玲, 徐朝斌, 贺利中, 王卫军. 刨花楠叶片碳氮磷化学计量比与个体大小的关系. 应用生态学报, 2015, 26(7): 1928- 1934.
[14] Bossio D A, Scow K M. Impacts of carbon and flooding on soil microbial communities: phospholipid fatty acid profiles and substrate utilization patterns. Microbial Ecology, 1998, 35(3/4): 265- 278.
[15] Ostonen I, Püttsepp Ü, Biel C, Alberton O, Bakker M R, Lõhmus K, Majdi H, Metcalfe D, Olsthoorn A F M, Pronk A, Vanguelova E, Weih M, Brunner I. Specific root length as an indicator of environmental change. Plant Biosystems-An International Journal Dealing with all Aspects of Plant Biology, 2007, 141(3): 426- 442.
[16] Fitter A H, Stickland T R, Harvey M L, Wilson G W. Architectural analysis of plant root systems 1. Architectural correlates of exploitation efficiency. New Phytologist, 1991, 118(3): 375- 382.
[17] Bauhus J, Khanna P K, Menden N. Aboveground and belowground interactions in mixed plantations ofEucalyptusglobulusandAcaciamearnsii. Canadian Journal of Forest Research, 2000, 30(12): 1886- 1894.
[18] 何琳琳, 吴鹏飞, 张云鹏, 陈智裕, 马祥庆. 杉木人工林细根不同根序形态和碳氮含量的比较. 森林与环境学报, 2015, 35(2): 112- 117.
[19] 黄复兴, 范川, 李晓清, 李贤伟, 张炜, 舒翔, 徐玲玲, 王杰. 施肥对盆栽香樟幼苗细根生长的影响. 西北林学院学报, 2013, 28(5): 103- 108, 114- 114.
[20] Liu Y, Li P, Wang G L, Liu G B, Li Z B. Above- and below-ground biomass distribution and morphological characteristics respond to nitrogen addition inPinustabuliformis. New Zealand Journal of Forestry Science, 2016, 46: 25.
[21] Ostonen I, Lõhmus K, Helmisaari H S, Truu J, Meel S. Fine root morphological adaptations in scots pine, Norway spruce and silver birch along a latitudinal gradient in boreal forests. Tree Physiology, 2007, 27(11): 1627- 1634.
[22] 丁国泉. 连续两年施肥对日本落叶松细根形态和养分含量影响研究[D]. 哈尔滨: 东北林业大学, 2009.
[23] 张腾飞, 李贤伟, 范川, 魏鹏, 刘运科, 苏宇, 杨正菊. 香樟人工林土壤表层细根形态特征、生物量及碳氮含量变化. 西北农林科技大学学报: 自然科学版, 2014, 42(10): 103- 110.
[24] 范川, 黄复兴, 李晓清, 李贤伟, 舒翔, 李平. 施肥对盆栽香樟幼苗不同根序细根养分的影响. 广西植物, 2015, 35(4): 507- 514.
[25] Noguchi K, Nagakura J, Kaneko S. Biomass and morphology of fine roots of sugi (Cryptomeriajaponica) after 3 years of nitrogen fertilization. Frontiers in Plant Science, 2013, 4: 347.
[26] King J S, Albaugh T J, Allen H L, Buford M, Strain B R, Dougherty P. Below-ground carbon input to soil is controlled by nutrient availability and fine root dynamics in loblolly pine. New Phytologist, 2002, 154(2): 389- 398.
[27] 王瑞丽, 程瑞梅, 肖文发, 封晓辉, 刘泽彬, 王晓荣. 森林细根生产和周转的影响因素. 世界林业研究, 2012, 25(1): 19- 24.
[28] 卫星, 刘颖, 陈海波. 黄波罗不同根序的解剖结构及其功能异质性. 植物生态学报, 2008, 32(6): 1238- 1247.
[29] 苗原, 吴会芳, 马承恩, 孔德良. 菌根真菌与吸收根功能性状的关系: 研究进展与评述. 植物生态学报, 2013, 37(11): 1035- 1042.
[30] 王文娜, 王燕, 王韶仲, 王政权, 谷加存. 氮有效性增加对细根解剖、形态特征和菌根侵染的影响. 应用生态学报, 2016, 27(4): 1294- 1302.
[31] 许旸, 谷加存, 董雪云, 刘颖, 王政权. 海南岛4个热带阔叶树种前5级细根的形态、解剖结构和组织碳氮含量. 植物生态学报, 2011, 35(9): 955- 964.
