锐齿栎水力结构和生长对降雨减少的响应
2018-05-16陈志成陆海波刘世荣刘晓静万贤崇
陈志成, 陆海波, 刘世荣, 刘晓静, 刘 畅, 万贤崇,*
1 中国林业科学研究院林业新技术研究所, 北京 100091 2 中国林业科学研究院森林生态环境与保护研究所, 国家林业局森林生态环境重点实验室, 北京 100091 3 河南宝天曼国家级自然保护区管理局, 南阳 474350 4 中国林业科学研究院资源管护处, 北京 100091
气候变化会改变局部地区的降雨格局,未来发生更频繁、更长时间和更极端的干旱事件的可能性增大[1]。近年突然的和大范围的森林死亡、衰败被认为与频繁发生的干旱事件相关[2- 3],而森林和林地植物死亡会导致快速地和大尺度地森林生态系统结构和功能的改变[4],影响森林生态系统产品和服务[5]。即使干旱没有导致森林死亡、衰败,也往往会降低森林的生产力[6]。在干旱时陆生植物要维持从根到叶的水分运输路径的完整性,以维持光合作用和生长;特别是对于高大的树木,因为其长距离的水分运输路径阻力和重力会造成较大的从根到冠层的木质部张力梯度,本身存在木质部栓塞的风险[7- 8]。过度的干旱会加剧不可恢复的木质部栓塞的发生,使树木长距离水分运输受限,因水力失衡而干化死亡[9]。在适应环境变化的过程中,植物进化出了气孔来调节自身的气体交换,很多植物在干旱时易关闭气孔而保水,但这样做的代价是减少了大气中CO2进入叶片的量,降低了光合碳固定,若干旱时间延长,植物非结构性碳(NSC)收支失衡,会引发碳饥饿及其他一系列交互问题而死亡[9,10- 11]。树木的生长依赖于膨压驱动的细胞扩展及分裂,水分减少会减弱细胞膨压甚至使膨压消失,从而使树木生长减弱或停止[12],Deslauriers等证明水分是决定木材形成的最主要的环境因素[13]。而树木生长是森林生态系统功能和服务的基础,所以降雨减少是否会降低树木生长,降低的程度是多少,是十分值得关注的问题。
植物在长期的适应和进化过程中,也具备了一定的对逆境环境的抵抗能力[14],比如在干旱时减少叶面积,增加根和边材面积,调整新生木质部导管结构以增加对栓塞的抵抗等,这些都有利于应对未来更加严重的干旱[15]。但植物自身结构、生理的适应性变化速率能不能赶得上周围环境的变化速率,这也是植物和森林能不能适应全球气候变化的关键问题。2013年4月在河南省西南部的宝天曼锐齿栎(Quercusalienavar.acuteserrata)天然次生林内建立了降雨减少(截雨)样地(减少林内穿透雨),研究降雨减少对锐齿栎天然次生林生态系统的影响。本研究的目的是探讨在森林原位降雨减少对锐齿栎生理和生长的影响,包括明确降雨减少后锐齿栎是否会遭受水力失衡和碳饥饿的危害。研究结果有助于加强理解森林生态系统对气候变化的响应及对未来森林管理决策提供理论依据。
1 材料与方法
1.1 研究地概况
研究地点在河南省西南部的宝天曼森林生态定位研究站,属伏牛山南坡(111°47′—112°04′E,33°20′—33°36′N),大陆性季风气候。研究地海拔约1400m,成土母质主要是花岗岩。年均气温15.1℃,年均降水量900mm,年蒸发量991.6mm,相对湿度68%,极端低温-14.8℃,极端高温41.2℃,年积温4200—4900℃。植被区划属暖温带落叶阔叶林,锐齿栎是宝天曼森林主要优势冠层树种,伴生种有四照花(Dendrobenthamiajaponica)、三桠乌药(Linderaobtusiloba)、水榆花楸(Sorbusalnifolia)等小乔木。研究地林分年龄约60a,样地锐齿栎密度为825株/hm2,生长季叶面积指数为5.4,锐齿栎树高为19—23m,2015年锐齿栎平均胸径为(25.2±7.4)cm。
1.2 截雨样地设计
2013年4月在宝天曼锐齿栎森林原位建立了3块20m×20m的降雨减少(截雨)样地和3块20m×20m的对照样地。截雨样地拦截近地位置约50%的林内穿透雨。每块截雨样地均由约160块(0.5m×3m)透明减水膜组成,薄膜安装在距地面约1.5—2.5m高的不锈钢架上,装置所截雨水由导水槽导出样地之外。每块样地四周均设有约70cm深的防止样地内外土壤水分交换的隔水板。
1.3 测定指标及方法
用Em50 Series数据采集系统(Decagon Devices, Inc., USA)测定样地土壤水分动态(体积含水量),每块样地2个探头,随机布设,采集频率为30min。
用压力室(model 1000; PMS Instruments Co., USA)测定截雨样地和对照样地锐齿栎的枝条凌晨水势和中午水势,采样高度约为15m,凌晨水势测定时间为5:30—6:30,中午水势测定时间为12:30—13:30。
用自然干燥法测定锐齿栎的木质部栓塞脆弱性曲线[16- 17]。为避免人为栓塞先用注入空气法测定最大导管长度[18],锐齿栎最大导管长度约为1.1m。雨后凌晨在生态站周围采集锐齿栎枝条用来测定栓塞脆弱性曲线,所采枝条长度2—4m,剪断后马上带到生态站实验室进行自然干燥取得系列水势梯度。在每次测定栓塞之前黑暗平衡处理2小时,先在空气中剪下两个小枝测定水势,然后选取距离已有切口超过1个最大导管长度的茎段,在水中剪下,用低压液流系统测定栓塞(导水损失率,PLC)。脆弱性曲线用如下模型拟合,其中PLC是栓塞(%),为对应的水势(MPa),a、b为常数参数。栓塞88%所对应的水势值为P88。
PLC=100/(1+exp(a(-b)))
在雨后晴天9:00采集锐齿栎枝条,然后在阳光下测定叶片水势-气孔导度关系曲线。先用Li- 6400XT光合仪测定气孔导度,然后剪下叶片用压力室测定叶片水势。用每个叶片相对应的气孔导度和水势绘制曲线,并用如下模型进行拟合:
Gs=a/(1+exp(-(-x0)/b))
式中,Gs为气孔导度,为水势,a、b、x0为常数参数。求得气孔关闭95%时的水势作为气孔关闭的水势值。
在生长季采集截雨样地和对照样地锐齿栎的枝条,枝条上的所有叶片都用叶面积仪(Li- 3000C; Li-Cor Inc., USA)测定叶面积,枝条末端的边材面积与枝条总叶面积的比值为Huber值,并选取成熟展开叶片计算叶片大小平均值。叶片单叶叶面积与烘干后的干重的比值为比叶面积。剪下小的茎段,制作半薄切片,用Axio Imager A1光学显微镜(Carl Zeiss Inc., Oberkochen, Germany)观察导管并拍照,只测定2013年后生长的年轮内的导管,截雨样地与对照样地的锐齿栎均选取20个以上的观察视野统计导管直径和导管密度。另外剪下小的茎段,去皮去髓,用称重法测定体积,烘干后称重,计算木材密度。
用指甲油印迹法测定叶片的气孔密度和气孔长度。
在2014年6月和8月测定凌晨水势的同时采集叶片和枝条,枝条分为韧皮部和木质部,杀青烘干,研磨过100目筛,用蒽酮-硫酸法[19]测定可溶性糖和淀粉浓度,二者之和为总非结构性碳(NSC)浓度。
在2014年9月连续多日降雨后湿润时的晴天和2015年6月较为干旱时的晴天,用AP4气孔计测定截雨样地和对照样地锐齿栎的气孔导度日变化。
2014年冬季对截雨样地和对照样地所有的锐齿栎树木安装了生长环监测其胸径生长,测定了2016年生长季之后每一棵锐齿栎树木的胸径增量,并计算相对于2015年初的胸径横截面积增量。
1.4 数据统计与分析
用SPSS 17.0软件进行统计分析。各指标均用独立样本t检验分析截雨样地与对照样地的差异显著性,当P<0.05时认为差异显著。文中数据均为平均值±标准误差,每个指标至少6个重复。为去掉树龄对胸径生长的影响,胸径增量分析是以2015年初(春季之前)的胸径作为初始胸径,与2016年末(两个生长季之后)的胸径横截面积增量做散点图,对截雨样地和对照样地分别做线性和非线性拟合,比较拟合关系是否存在显著差异。采用Sigmaplot 12.5软件作图。
2 结果和分析
2.1 降雨减少对锐齿栎水力结构的影响
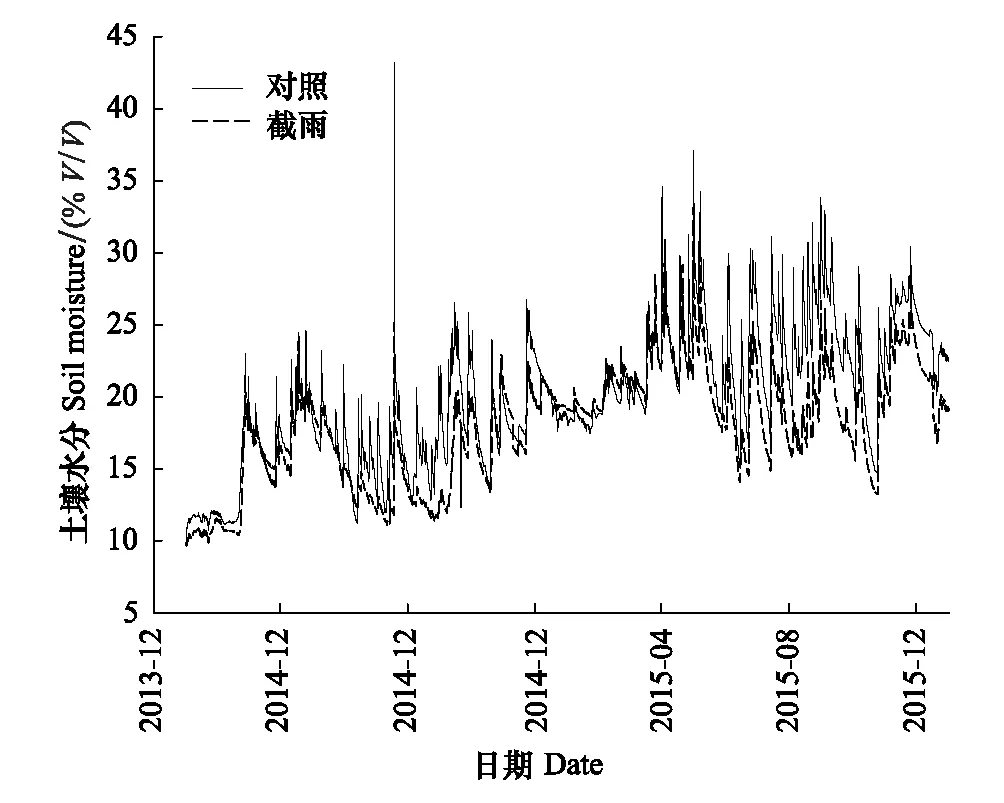
图1 2014年至2015年对照样地和截雨样地土壤水分动态 Fig.1 Soil humidity dynamics of control and rainfall-intercepted plots from 2014 to 2015
由图1可知,两个样地土壤水分的波动都较大,且大部分时间截雨样地的土壤水分明显低于对照样地。随着样地不同测定时间水分环境的变化,两个样地锐齿栎凌晨和中午枝条水势均出现了较大波动,除2014年8月凌晨水势外,其他时间点对照样地的凌晨水势和中午水势均显著大于截雨样地,但两个样地间的水势差异并不大,中午水势平均只相差(0.21±0.031)Mpa(图2)。截雨后,监测到的锐齿栎最低中午枝条水势为(-1.36±0.11)MPa。
锐齿栎作为环孔材,是长导管木本植物,最大导管长度超过了1m,准确测定其木质部栓塞脆弱性只能采用离体枝条自然干燥法。通过模型拟合,锐齿栎的木质部栓塞脆弱性曲线呈典型的“S”型,P50(栓塞50%时的水势)为-1.84MPa,P88(栓塞88%时的水势)为-3.19MPa (图3)。锐齿栎叶片气孔导度也随着水势的降低而降低;通过模型拟合,锐齿栎叶片气孔导度关闭的水势值为-2.5MPa (图4)。
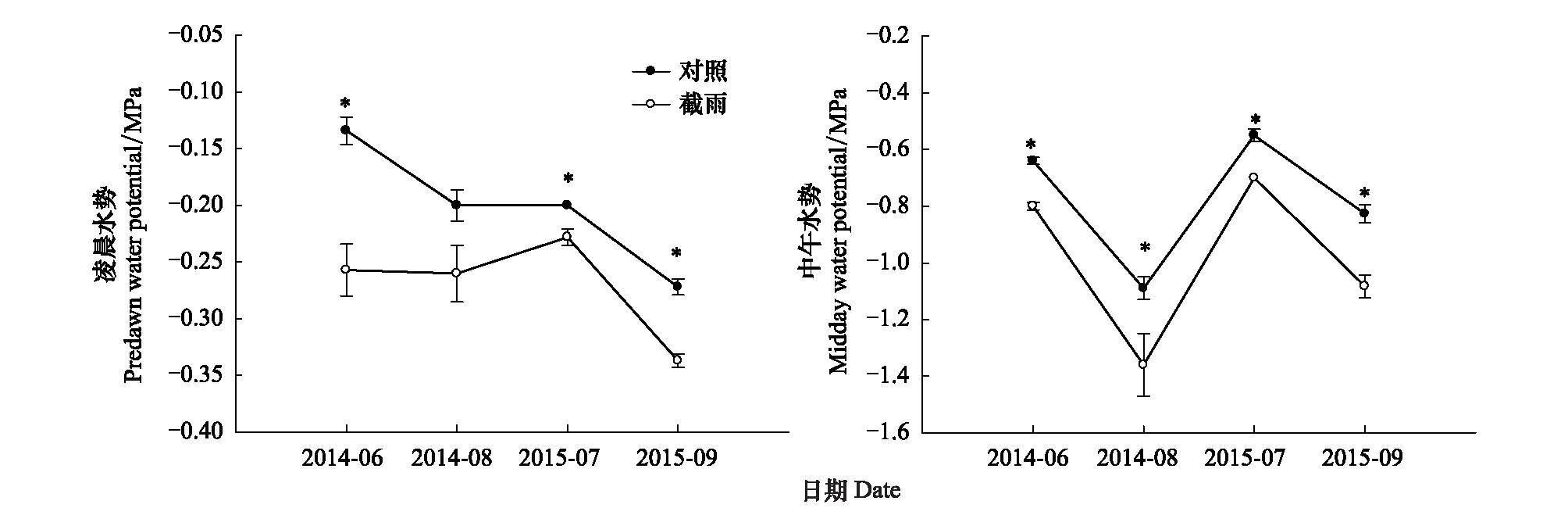
图2 对照样地和截雨样地锐齿栎的凌晨水势和中午水势Fig.2 Predawn water potential and midday water potential of Quercus aliena in control and rainfall-intercepted plots*表示两个样地间水势差异显著(P<0.05);平均值±标准误
由表1可知,降雨减少使锐齿栎的导管密度和气孔密度显著增大,而导管直径和气孔长度显著变小。木材密度和Huber值没有发生显著变化。
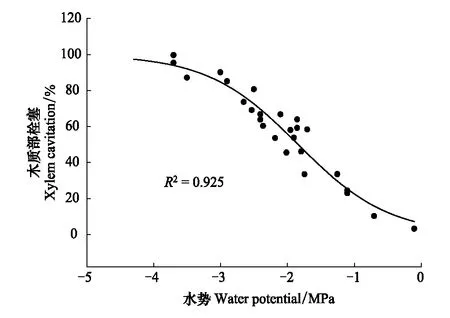
图3 锐齿栎的木质部栓塞脆弱性曲线Fig.3 Curve of xylem vulnerability to cavitation of Quercus aliena
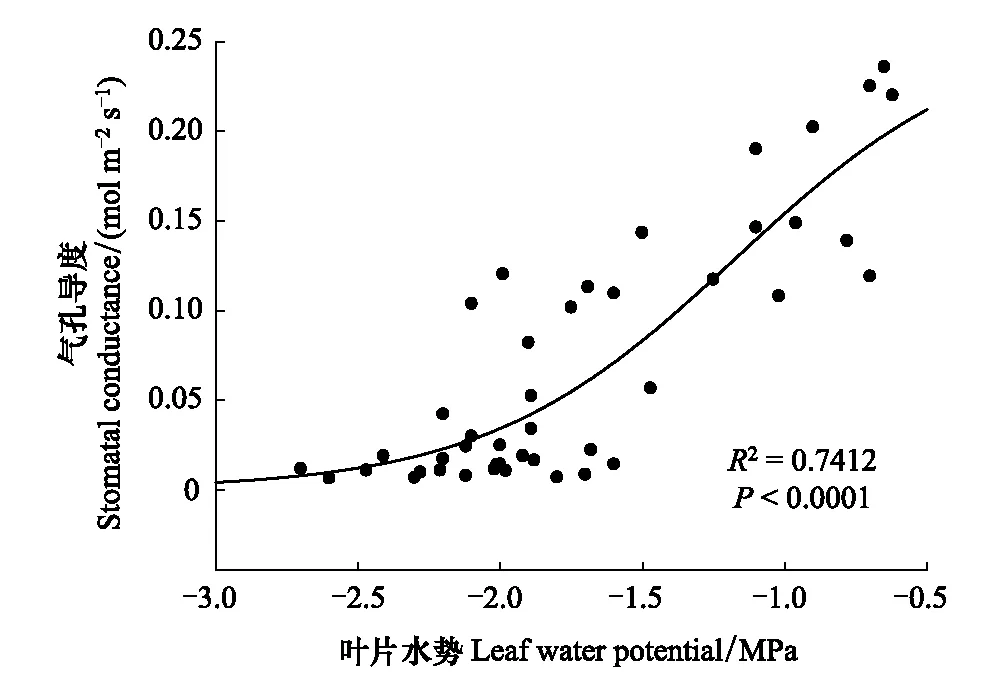
图4 锐齿栎叶片水势-气孔导度关系曲线 Fig.4 Leaf water potential plotted against stomatal conductance of Quercus aliena

处理Treatment导管密度Vesseldensity/(个/mm2)导管直径Vesseldiameter/μm气孔密度Stomataldensity/(个/mm2)气孔长度Stomatallength/μm木材密度Wooddensity/(g/cm2)Huber值Hubervalue/(mm2/cm2)对照Control153.1±7.3b41.5±0.6a956.9±19.8b21.3±0.11a0.516±0.01a0.0115±0.002a截雨Rainfallreduction198.4±14.7a37.4±0.5b1029.2±27.8a19.0±0.13b0.502±0.01a0.0121±0.001a
同列数据后不同小写字母表示处理间差异显著 (P<0.05); 平均值±标准误
2.2 降雨减少对锐齿栎非结构性碳 (NSC)和气孔导度的影响
由图5可知,除2014年6月截雨样地锐齿栎叶片淀粉浓度显著低于对照外,其他测定中的叶片、韧皮部、木质部的可溶性糖、淀粉和总NSC浓度在两个样地间均无显著差异。由图6,在较干旱时期(2015年6月中旬),截雨样地锐齿栎叶片气孔导度日变化呈双峰曲线,中午气孔导度显著低于对照;而雨后湿润时(2014年9月下旬)呈单峰曲线,且湿润时截雨样地锐齿栎气孔导度中午峰值显著高于对照,在8点和16点时也显著高于对照。
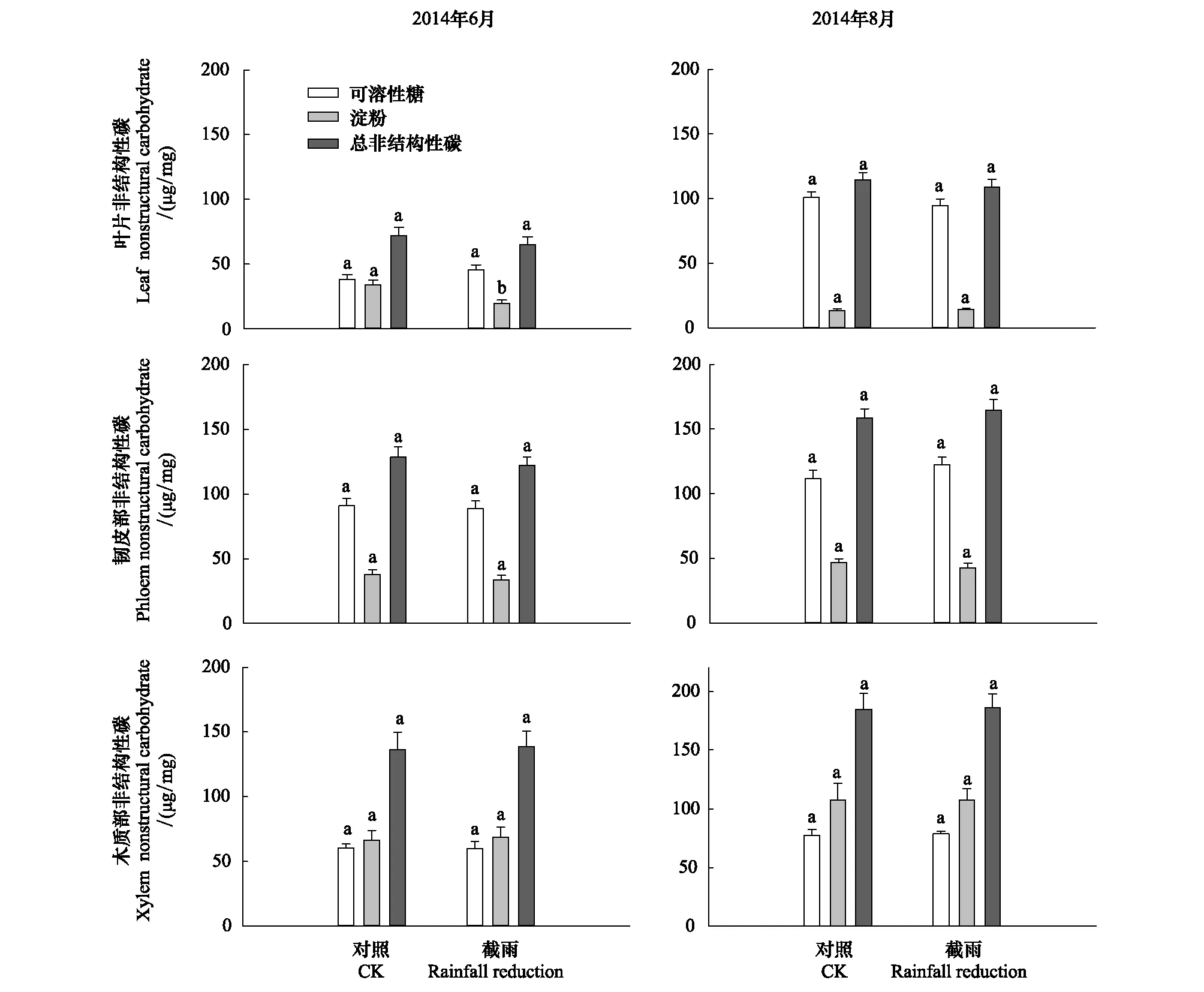
图5 对照样地和截雨样地2014年6月和8月锐齿栎叶片、韧皮部和木质部的非结构性碳Fig.5 The nonstructural carbohydrate of the leaf, phloem and xylem of Quercus aliena in June and August 2014 in control and rainfall-intercepted plots不同小写字母表示处理间差异显著(P<0.05);平均值±标准误
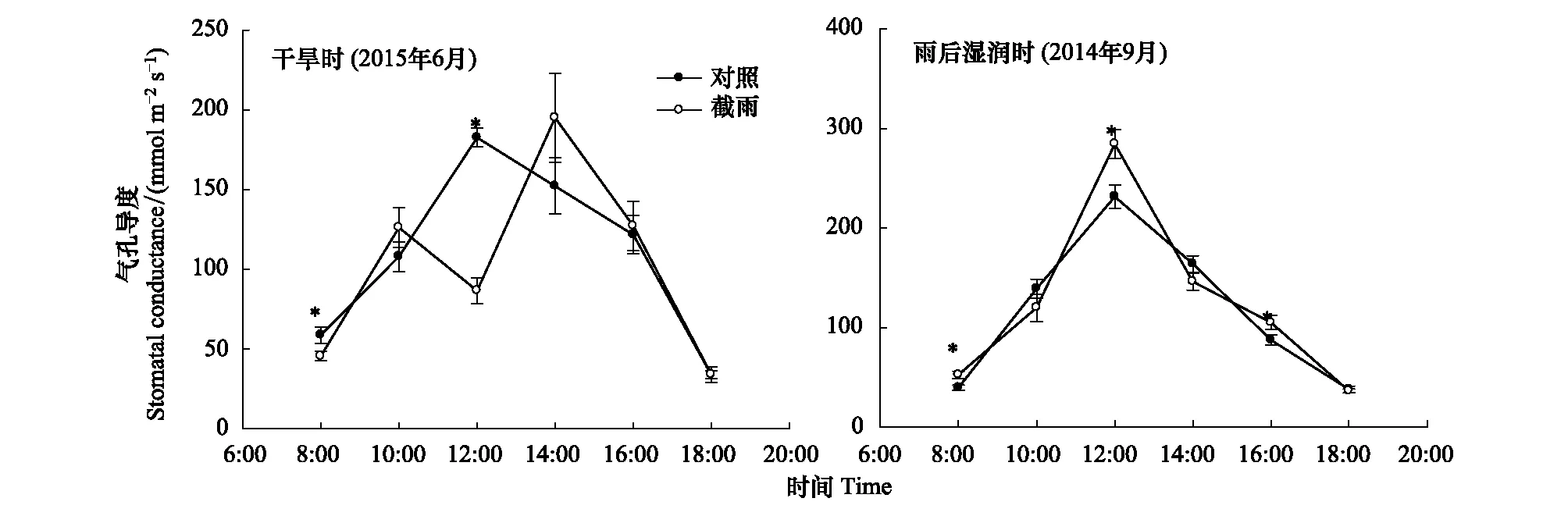
图6 对照样地和截雨样地锐齿栎在干旱和湿润两种情况下的气孔导度日变化Fig.6 Diurnal variation of stomatal conductance of Quercus aliena under drought and moist in control and rainfall-intercepted plots*表示两个样地间差异显著(P<0.05);平均值±标准误
2.3 降雨减少对锐齿栎生长的影响
由图7可知,在4次不同时间点的比叶面积测定中,对照样地和截雨样地之间都没有显著差异。且两个样地间锐齿栎胸径的生长也没有统计上的显著差异(图8)。
3 讨论
宝天曼锐齿栎天然次生林林内穿透雨减少50%后,锐齿栎枝条水势显著降低,但最低水势为(-1.36±0.11)MPa,明显高于P88(-3.19MPa)和气孔关闭时的水势(-2.5MPa),表明锐齿栎既不会出现严重的木质部栓塞阻碍体内长距离水分运输,也不会完全关闭气孔限制碳固定。但木质部导管和叶片气孔出现了变密变小的适应性变化,叶片和枝条的NSC浓度也无显著变化。即降雨减少后锐齿栎没有遭受水力失衡和碳饥饿的危害。这不同于目前进行干旱导致树木水力失衡和碳饥饿研究的“model”系统-美国新墨西哥州的Pinusedulis和Juniperusmonosperma森林生态系统,在干旱的2000—2007年中,97%的P.edulis因碳饥饿死亡,而只有0.4%的J.monosperma死亡[9,20- 21]。干旱时气孔关闭是植物保水的一个重要策略,但代价是限制了气体交换,降低了碳固定;降雨减少处理降低了气孔易于关闭的P.edulis的总NSC和淀粉含量[21],长期干旱使其碳饥饿而发生严重死亡[20- 21]。而宝天曼较为湿润,年均降雨量为900mm,远高于美国P.edulis-J.monosperma森林生态系统所在地年均约400mm的降雨量。且P.edulis、J.monosperma均为针叶树,而锐齿栎为落叶阔叶树,宝天曼地区雨热同期,生长季即雨季,锐齿栎生长时较难出现严重的或长期的干旱,而春、冬季较为干旱时落叶,对水分的需求低。这些可能都是降雨减少后宝天曼锐齿栎没有出现衰败现象的原因。
环境变化后植物会进行一定程度的适应性调整,维持植物体内水分供应、水分需求和新陈代谢的内稳态平衡,这种平衡对处于干旱环境下植物的死活会起到重要作用[22]。植物为了使蒸腾低于临界蒸腾,在长时间尺度上(几年甚至几十年)通过调整自身的结构特征,尽量多的吸水、保水和减少水分丧失;在短时间内(几天内)植物会改变冠层尺度的气孔导度,来适应环境变化[7,16]。降雨减少后,锐齿栎叶片气孔变小,而密度变大;小而密的气孔可以使植物更快的响应光强和水分等环境因子的变化[23],获取更大的气孔导度和光合速率,进而拥有较高的水分利用效率[24]。这也符合植物在长期的适应和进化过程中形成的补偿性作用[25- 26]。在较干旱时段,降雨减少处理的锐齿栎气孔中午出现“午休”现象,但在雨后的湿润期,降雨减少处理的锐齿栎中午气孔导度峰值显著高于对照,即在水分充足时,降雨减少处理的锐齿栎会进行补偿性的光合作用,增强碳固定,以此来适应长期的环境变化。先前的研究也发现木本植物必须利用周期性的降水来获取碳,从而维持生存[27]。这可能也是降雨减少后锐齿栎NSC和生长与对照没有显著差异的原因之一。Hagen-Poiseuille方程表明枝条导水率与导管直径的四次方成正比[28],而与导管数量是累加关系,即导水率主要由导管直径决定,大的导管具有传输水分的高效性;而木质部导管直径与栓塞脆弱性正相关,即同一树种内小径导管比大径导管更不易发生栓塞[29- 30];而降雨减少后锐齿栎木质部导管变小变密,表明了锐齿栎水分输导系统由运输水分的高效性向安全性转变,有利于适应降雨减少后环境的变化。
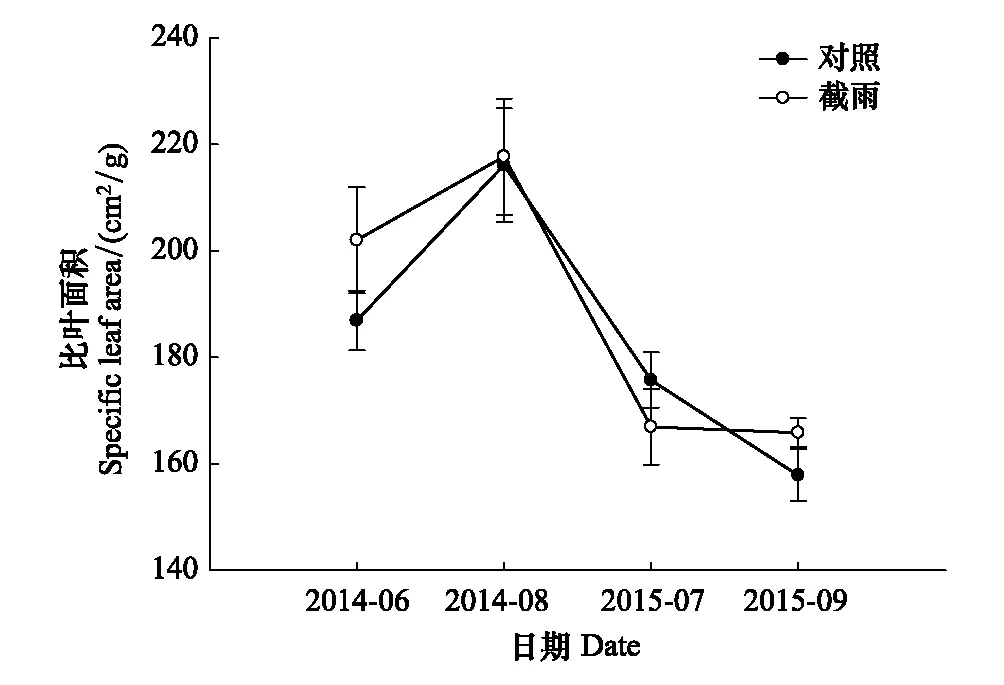
图7 对照样地和截雨样地锐齿栎比叶面积 Fig.7 Specific leaf area of Quercus aliena in control and rainfall-intercepted plots
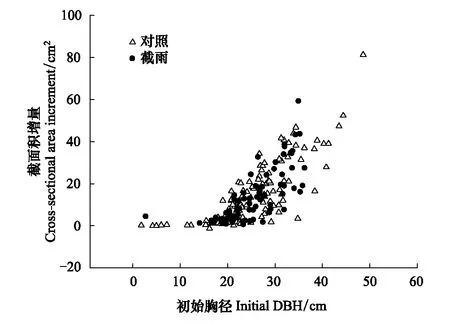
图8 对照样地和截雨样地锐齿栎初始胸径和树干截面积增量散点图Fig.8 Initial diameter at breast height (DBH) of Quercus aliena plotted against trunk cross-sectional area increment in control and rainfall-intercepted plots
在干旱时植物的叶面积常常会下降[31],而降雨减少后锐齿栎的单叶叶面积没有显著变化(未列出数据);Huber值是枝条末端边材面积与枝条总叶面积的比值,降雨减少后锐齿栎Huber值、胸径生长(可认为边材生长)均无显著变化,即可认为降雨减少后锐齿栎的总叶面积也没有受到显著影响。而叶面积是最重要的光合作用器官,叶面积的维持是保证光合固碳的必要条件。降雨减少后,锐齿栎叶面积、比叶面积、木材密度和树干胸径生长均无显著降低,表明锐齿栎的生长并没有降低,这个结果有些出乎意料。因为生长源于细胞分裂,膨压是细胞分裂的驱动力,而膨压对水分非常敏感,所以水分降低往往会限制植物生长[12- 13,32],但是本研究中锐齿栎生长没有降低。植物生长主要与水和碳相关[13],降雨减少后锐齿栎生长并没有降低的原因可能有以下几个:1),驱动细胞分裂的膨压对干旱的敏感性高于光合[12,32],在出现干旱时,往往光合还未降低而生长已经停止,这样的结果就是光合产物(NSC)出现积累,而宝天曼生长季降雨频繁,很难出现长时间干旱,短期干旱积累的NSC在湿润时会被用于生长,从而在一定较长的时间尺度上维持了生长;2),类似于前面提到的降雨减少后锐齿栎自身的结构调整和补偿性的气孔调节,弥补了降雨减少对锐齿栎的负作用,在环境湿润时加强气体交换进行固碳,保证了生长所需的NSC,维持了生长;3),减少50%的林内穿透雨可能还不足以达到使锐齿栎生长降低的阈值,宝天曼湿润的环境保证了剩余的水分仍可维持锐齿栎生长;4),降雨减少的时间还太短(本研究截止到降雨减少后的3a),锐齿栎生长的降低还没有显现出来,可能随着森林原位模拟降雨减少试验的进一步进行,锐齿栎会出现生长降低。
4 结论
宝天曼锐齿栎林在减少50%林内穿透雨3a内,锐齿栎树木没有遭受水力失衡或碳饥饿的危害,生长也没有受到显著影响。但是水力输导系统发生了适应性调节,利于锐齿栎在湿润环境下进行补偿性气体交换,以维持碳素储备和生长。
参考文献(References):
[1] IPCC. Summary for policymakers//Stocker T F, Qin D, Plattner G K, Tignor M, Allen S K, Boschung J, Nauels A, Xia Y, Bex V, Midgley P M, eds. Climate change 2013: the physical basis. Contribution of Working Group I to the fifth assessment report of the Intergovernmental Panel on Climate Change. Cambridge, New York: Cambridge University Press, 2013.
[2] Allen C D, Macalady A K, Chenchouni H, Bachelet D, McDowell N, Vennetier M, Kitzberger T, Rigling A, Breshears D D, Hogg E H, Gonzalez P, Fensham R, Zhang Z, Castro J, Demidova N, Lim J H, Allard G, Running S W, Semerci A, Cobb N. A global overview of drought and heat-induced tree mortality reveals emerging climate change risks for forests. Forest Ecology and Management, 2010, 259(4): 660- 684.
[3] Young D J N, Stevens J T, Earles J M, Moore J, Ellis A, Jirka A L, Latimer A M. Long-term climate and competition explain forest mortality patterns under extreme drought. Ecology Letters, 2017, 20(1): 78- 86.
[4] Breshears D D, Cobb N S, Rich P M, Price K P, Allen C D, Balice R G, Romme W H, Kastens J H, Floyd M L, Belnap J, Anderson J J, Myers O B, Meyer C W. Regional vegetation die-off in response to global-change type drought. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(42): 15144- 15148.
[5] 傅伯杰, 于丹丹, 吕楠. 中国生物多样性与生态系统服务评估指标体系. 生态学报, 2017, 37(2): 341- 348.
[6] Williams A P, Allen C D, Millar C I, Swetnam T W, Michaelsen J, Still C J, Leavitt S W. Forest responses to increasing aridity and warmth in the southwestern United States. Proceedings of the National Academy of Sciences of the United States of America. 2010, 107(50): 21289- 21294.
[7] Tyree M T, Sperry J S. Do woody plants operate near the point of catastrophic xylem dysfunction caused by dynamic water stress? ——Answers from a model. Plant Physiology, 1988, 88(3):574- 580.
[8] 万贤崇, 孟平. 植物体内水分长距离运输的生理生态学机制. 植物生态学报, 2007, 31(5): 804- 813.
[9] McDowell N, Pockman W T, Allen C D, Breshears D D, Cobb N, Kolb T, Plaut J, Sperry J, West A, Williams D G, Yepez E A. Mechanisms of plant survival and mortality during drought: why do some plants survive while others succumb to drought? New phytologist, 2008, 178(4): 719- 739.
[10] Sevanto S, McDowell N G, Dickman L T, Pangle R, Pockman W T. How do trees die? A test of the hydraulic failure and carbon starvation hypotheses. Plant, Cell & Environment, 2014, 37(1): 153- 161.
[11] 陈志成, 万贤崇. 虫害叶损失造成的树木非结构性碳减少与树木生长、死亡的关系研究进展. 植物生态学报, 2016, 40(9): 958- 968.
[12] Woodruff D R, Meinzer F C. Water stress, shoot growth and storage of non-structural carbohydrates along a tree height gradient in a tall conifer. Plant, Cell & Environment, 2011, 34(11): 1920- 1930.
[13] Deslauriers A, Huang J G, Balducci L, Beaulieu M, Rossi S. The contribution of carbon and water in modulating wood formation in black spruce saplings. Plant Physiology, 2016, 170(4): 2072- 2084.
[14] Gullo ML, Nardini A, Salleo S, Tyree M T. Changes in root hydraulic conductance (KR) of Olea oleaster seedlings following drought stress and irrigation. New Phytologist, 1998, 140(1): 25- 31.
[15] Holste E K, Jerke M J, Matzner S L. Long-term acclimatization of hydraulic properties, xylem conduit size, wall strength and cavitation resistance inPhaseolusvulgarisin response to different environmental effects. Plant, Cell & Environment, 2006, 29(5): 836- 843.
[16] Sperry J S, Donnelly J R, Tyree M T. A method for measuring hydraulic conductivity and embolism in xylem. Plant, Cell & Environment, 1988, 11(1): 35- 40.
[17] Cochard H, Badel E, Herbette S, Delzon S, Choat B, Jansen S. Methods for measuring plant vulnerability to cavitation: a critical review. Journal of Experimental Botany, 2013, 64(15): 4779- 4791.
[18] Wang R Q, Zhang L L, Zhang S X, Cai J, Tyree M T. Water relations ofRobiniapseudoacaciaL.: do vessels cavitate and refill diurnally or are R-shaped curves invalid inRobinia? Plant, Cell & Environment, 2014, 37(12): 2667- 2678.
[19] Hanson J, Møller I. Percolation of starch and soluble carbohydrates from plant tissue for quantitative determination with anthrone. Analytical Biochemistry, 1975, 68(1): 87- 94.
[20] Woodruff D R, Meinzer F C, Marias D E, Sevanto S, Jenkins M W, McDowell N G. Linking nonstructural carbohydrate dynamics to gas exchange and leaf hydraulic behavior inPinusedulisandJuniperusmonosperma. New Phytologist, 2015, 206(1): 411- 421.
[21] Dickman L T, McDowell N G, Sevanto S, Pangle R E, Pockman W T. Carbohydrate dynamics and mortality in a pion-juniper woodland under three future precipitation scenarios. Plant, Cell & Environment, 2015, 38(4): 729- 739.
[22] Bréda N, Huc R, Granier A, Dreyer E. Temperate forest trees and stands under severe drought: a review of ecophysiological responses, adaptation processes and long-term consequences. Annals of Forest Science, 2006, 63(6): 625- 644.
[23] Lawson T, Blatt MR. Stomatal size, speed, and responsiveness impact on photosynthesis and water use efficiency. Plant Physiology, 2014, 164(4): 1556- 1570.
[24] Drake P L, Froend R H, Franks P J. Smaller, faster stomata: scaling of stomatal size, rate of response, and stomatal conductance. Journal of Experimental Botany, 2013, 64(2): 495- 505.
[25] Messina F J, Durham S L, Richards J H, McArthur D E. Trade-off between plant growth and defense? A comparison of sagebrush populations. Oecologia, 2002, 131(1): 43- 51.
[26] 胡田田, 康绍忠. 植物抗旱性中的补偿效应及其在农业节水中的应用. 生态学报, 2005, 25(4): 885- 891.
[27] West A G, Hultine K R, Sperry J S, Bush S E, Ehleringer J R. Transpiration and hydraulic strategies in a Pion-Juniper woodland. Ecological Applications, 2008, 18(4): 911- 927.
[28] Tyree M T, Zimmermann M H. Xylem Structure and the Ascent of Sap. Berlin Heidelberg: Springer-Verlag, 2002.
[29] Wheeler J K, Sperry J S, Hacke U G, Hoang N. Inter-vessel pitting and cavitation in woody Rosaceae and other vesselled plants: a basis for a safety versus efficiency trade-off in xylem transport. Plant, Cell & Environment, 2005, 28(6): 800- 812.
[30] Cai J, Tyree M T. The impact of vessel size on vulnerability curves: data and models for within-species variability in saplings of aspen,PopulustremuloidesMichx. Plant, Cell & Environment, 2010, 33(7): 1059- 1069.
[31] Cinnirella S, Magnani F, Saracino A, Borghetti M. Response of a maturePinuslaricioplantation to a three-year restriction of water supply: structural and functional acclimation to drought. Tree Physiology, 2002, 22(1): 21- 30.
[32] McDowell N G. Mechanisms Linking Drought, Hydraulics, Carbon Metabolism, and Vegetation Mortality. Plant physiology, 2011, 155(3): 1051- 1059.
