c-Maf基因在小鼠耳蜗内外毛细胞中的表达及意义
2018-05-16宋青玲曲腾飞张伟于树夔何志洲2龚树生
宋青玲曲腾飞张伟于树夔何志洲,2龚树生
1首都医科大学附属友谊医院耳鼻咽喉头颈外科(北京100050)2 Creighton大学医学院生物医学研究所(美国 奥马哈NE68178)
遗传性耳聋目前是导致新生儿出生缺陷的主要疾病之一,目前已有大约1/3的遗传性耳聋致病基因得到验证,但仍有大约300个疑似致病基因有待进一步发现与确认[1]。我们在前期的研究工作中,通过Microarray基因芯片技术分别对小鼠耳蜗内毛细胞与外毛细胞中可能发挥重要作用的基因的RNA水平进行检测,数据分析后发现:c-Maf蛋白为表达于耳蜗内外毛细胞中的、在二者转录水平均有较高表达(表达量均为8.0左右)的转录因子。据此我们推测:c-Maf基因的突变有可能会导致严重的遗传性耳聋[2]。
c-Maf蛋白是Maf转录因子家族大Maf家族成员之一,其基因片段位于人类第16号染色体长臂23.2位点(16q23.2),共包含27个外显子。c-Maf蛋白的结构域从N端到C端分别为:酸性转录激活结构域,组氨酸/甘氨酸重复结构域,扩展同源区以及碱性亮氨酸拉链结构域[3,4]。c-Maf及其家族成员最具特征性的结构为位于C端的亮氨酸拉链结构域,其在进化上高度保守,能够单独作用或与细胞核内其他含有b-Zip结构的转录因子相结合形成同源二聚体,与DNA上的Maf识别元件以及富含5-AT的Maf半识别元件的结合,从而调控相关基因的转录,调节细胞功能与生长发育[5]。
目前研究显示,c-Maf蛋白在生物体生长发育的过程中对细胞分化与组织器官的形态形成均发挥着重要的调节作用,其在肝脏[6]、肾脏[6]、眼晶状体[7]、T细胞[8]和感觉神经系统[9,10]中广泛表达且均起到了调控发育与功能维持的关键作用,但是其在听神经科学中的表达与功能的研究尚属于空白。在外周感觉神经系统中,c-Maf是一个关键的、能够专门调控皮肤机械感受器(特别是高频感受器)的发育和功能的转录因子,同时,结合c-Maf在内外毛细胞转录组的高表达水平,我们推测,c-Maf可能在毛细胞机械感受的过程中同样也会发挥重要的作用。因此,我们拟针对c-Maf基因在耳蜗内外毛细胞的表达部位以及时间相关性进行更加深入的研究。
本研究中,我们首先分析了Microarray基因芯片的检测数据,对内、外毛细胞中c-Maf基因的转录水平进行分析、比较;随后,通过c-Maf蛋白免疫荧光染色、全耳蜗标记、铺片,我们确定了c-Maf基因在耳蜗内外毛细胞的表达部位,并通过对毛细胞特定区域的荧光强度分析,对成年小鼠内耳毛细胞中c-Maf在不同部位的表达强度进行初步分析。另外,我们对其在各发育时期(P0,P7,P12)的表达与定位进行了染色分析,观察c-Maf蛋白表达与耳蜗发育时间的相关性,为进一步深入研究其在耳蜗内、外毛细胞发育中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级6周龄成年C57BL/6J小鼠3只,P0,P7,P12乳鼠各2只(维通利华,实验动物合格证编号:生产许可SCXK(京)2016-0006)。
1.1.2 实验试剂
兔源c-Maf抗体(美国proteintech公司,55013-1-AP);Alexa Fluorence羊抗鼠抗体(美国Life公司,A-11034);免洗 DAPI(4',6-Diamidino-2-phenylindole,4',6-二脒基-2-苯基吲哚)染液(中杉金桥,ZLI-9557)。
1.2 方法
1.2.1 耳蜗基底膜制备
小鼠深度麻醉后颈椎离断,用剪刀断头后取出双侧颞骨,解剖显微镜下用镊子迅速清除多余的软组织,并用1ml注射器针头蜗尖打孔,并捅破圆窗和卵圆窗,用10%甲醛蜗尖灌流,并置于4℃固定过夜12h。放入10%EDTA溶液中脱钙12h-18h,之后于解剖显微镜下从顶回向底回剥除蜗壳,切除螺旋韧带,并清除前庭膜及盖膜。取出基底膜放于EP管中待染色。
1.2.2 免疫荧光染色
将分离好的基底膜置于0.3%Triton X-100中30 min后,10%山羊血清封闭1h;换用一抗:兔源性c-Maf抗体(1:50)4℃过夜,PBS冲洗3次,15min/次;加二抗,37℃孵育1h,PBS冲洗3次,15min/次。DAPI染色:载玻片上滴加一滴免洗DAPI封片液,解剖显微镜下铺片后,将盖玻片倒扣于载玻片上。1.2.3激光共聚焦显微镜成像
激光共聚焦显微镜:使用63倍油镜,显微镜型号(TCS SP5 II;Leica Microsystems,Wetzlar,Germany)。于显微镜下选择目标区域,选择激发光波长分别为358nm和488nm,对此区域设定层扫的距离及层厚,从上到下依次扫描,层厚0.35μm/层,最后对图片进行叠加,所获取的最终图像在软件Photoshop CS5进行后处理。
1.2.4 免疫荧光强度统计
使用软件Image Pro Plus(IPP)测量荧光强度:①采集图片:控制需要测量荧光强度的图片为同一批标本且为在同一条件下制作,共聚焦显微镜拍照过程中采用统一强度的激发光,按照需求采集图片。②计算荧光强度:选定需要计算荧光强度的图片,点击Invert contrast对图片进行黑白反相处理,应用此处理后即可测量荧光强度。首先,测量图片背景强度,设置背景强度为基础值,之后选定目标区域,测量此处荧光强度并与背景强度进行对比,从而计算出此区域的荧光强度(IOD值),软件同时会计算出此区域的面积(area),依次对每一幅图的目标区域进行测量。最后计算单位面积的荧光强度:单位面积荧光强度=所选区域总荧光强度/区域面积(OD=IOD/area),采用统计学软件对数据进行分析整理。
1.2.5 Microarray基因芯片技术
采用微管吸引技术在显微镜下采集6周龄大小CBA/J小鼠的2000个内毛细胞与2000个外毛细胞,分别提取其总RNA(约3-5ng),经逆转录合成cDNA后经体外扩增合成新的RNA后荧光分子标记,分别分成3组后与2.0基因芯片(GeneChip Mouse Gene 2.0 ST Arrays)进行杂交,待芯片完全干燥后,利用扫描仪进行扫描,扫描后将图像转化为基于荧光强度的数字信号。在芯片实验中,由于影响实验结果的因素较多,无法将几个芯片实验结果进行直接比较,故将每组芯片数据进行归一化处理,对两组样品的检测信号与标准信号进行回归分析并由此得到相对于标准信号的基因表达数值,结果均为相对值(此项工作于美国Creighton大学听觉研究中心完成),最后对结果进行统计分析。c-Maf基因的转录水平为其中的一组数据。
1.2.6 SPSS统计软件,主要统计方法为Student’s t检验。P<0.05时有统计学意义。

图1 单独采集成年小鼠2000个耳蜗内毛细胞与2000个外毛细胞,分别提取细胞内的RNA进行Microarray基因芯片检测(每种分为三组),其中内毛细胞与外毛细胞中的c-Maf表达量相近,均为8左右,表达水平较高。Fig.1 2000 inner hair cells and 2000 outer hair cells from adult mice cochlear were collected individually,and the RNA of two cells was extracted from each of the two cells.GeneChip microarray was used to detect the expression of total RNAs.The expression of c-Maf in inner hair cells and outer hair cells was close to 8,indicating a high level of expression.
2 结果
首先,我们根据Microarray基因芯片技术对2000个内毛细胞与2000个外毛细胞中小鼠各基因转录产生的RNA的量进行分析,发现c-Maf在内外毛细胞中均有较高表达:内毛细胞中的表达量为8.12±0.05,外毛细胞中的表达量为8.15±5.35,其在内外毛细胞的转录水平相近,无明显差别(P>0.05)(图1)。
在此基础上,我们开展了c-Maf蛋白在内耳毛细胞中的表达的研究,成年C57BL/6J小鼠耳蜗基底膜铺片可见:c-Maf蛋白信号分布于成年小鼠耳蜗内外毛细胞胞质中(图2,图3,图4),经荧光度值计算后发现:c-Maf的荧光信号在内毛细胞的核下区强于核上区(图2);其在外毛细胞中的荧光强度与内毛细胞相差并不大,无统计学差异(图3)。
在小鼠出生后各时间点(P0,P7,P12)的耳蜗基底膜铺片中可以观察到:c-Maf蛋白从P0开始即表达耳蜗于内外毛细胞胞质中,并在P7、P12持续表达,各时间点中c-Maf蛋白随着内外毛细胞形态的生长变化持续分布于细胞质中(图5)。
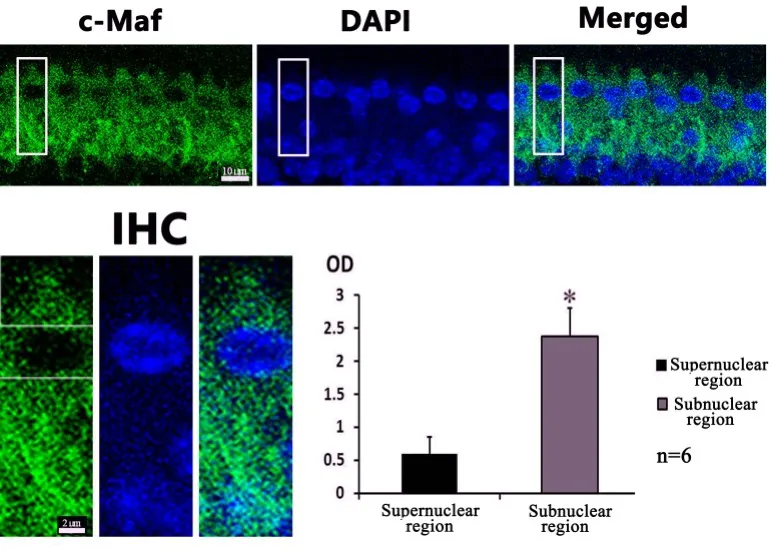
图2 c-Maf在内毛细胞的表达情况,由图可知:c-Maf表达于内毛细胞胞质,在细胞核上区域与核下区域均有表达,经荧光强度分析可见:核下区荧光强度强于核上区(核下区2.298±0.694,核上区0.643±0.372),有统计学意义P<0.05。Fig.2 The expression of c-Maf in the inner hair cells:c-Maf was expressed in the cytoplasm of inner hair cells,and it was distributed in both supernuclear region and the subnuclear region.By fluorescence intensity analysis,the fluorescence intensity in the subnuclear region 2.298 ± 0.694 was stronger than that in the supernuclear region 0.643±0.372,which was statistically significant,P<0.05.
3 讨论
感音神经性聋是最常见的感觉障碍,全球大约有3亿人受感音神经性聋的困扰。感音神经性聋的原因很多,内耳感觉细胞或者神经元的损伤最重要的原因,其中包括:环境因素(感染,耳毒性药物,以及噪音暴露等)、年龄因素及遗传因素等。由于成年哺乳动物的内耳缺乏自我修复的能力,所以毛细胞的损伤是永久、不可逆转的[11]。目前,除了获得性听力损失,已经有超过300个基因位点可能与听力损失相关,其中70多个致病基因已经被证明可导致遗传性聋[1]。此外,约80%的遗传性耳聋是隐性遗传,其余为显性遗传[1]。遗传性聋的致病基因研究及基因治疗均是目前耳神经科学领域的研究热点[12]。
c-Maf基因在全身各器官广泛表达,并在多种器官的形态发育与功能维持中发挥重要的调节作用,为重要的转录因子。Hagen Wende等在外周神经系统研究中发现,携带显性c-Maf基因突变的人类对对高频震动的感受功能存在一定程度的减退,相应地,c-Maf基因敲除小鼠的多种皮肤快适应感受器的发育和功能均受损——触觉产生过程中对压力刺激的反应能力下降、时限变长。因此,c-Maf是一个能够调控皮肤触觉感受器的发育和功能的关键的转录因子。听神经系统同样作为外周神经系统的的一部分,听神经电信号的产生依赖于内毛细胞纤毛感受机械振动,并通过突触与神经向中枢传递,从而产生听觉。毛细胞的机械感受功能与皮肤机械感受功能存在一定的相似性,且c-Maf在耳蜗内外毛细胞中均存在较高的转录水平,因此,c-Maf基因在耳蜗内外毛细胞中的表达与功能成为了我们的研究对象。

图3 c-Maf在三排外毛细胞的表达情况,由图可知:c-Maf表达于耳蜗三排外毛细胞胞质,其荧光强度与内毛细胞相近(外毛细胞的荧光强度为2.626±0.435,内毛细胞荧光强度为2.162±0.647),无统计学意义P>0.05.Fig.3 The expression of c-Maf in the outer of the hair cells is illustrated:c-Maf is expressed in the cytoplasm of outer hair cells of the cochlea,and its fluorescence intensity(2.626±0.435)is similar to the inner hair cells(2.162±0.647),with no statistical significance.P>0.05.

图4 耳蜗基底膜内外毛细胞侧面扫描图,c-Maf表达于内毛细胞与外毛细胞的胞质Fig.4 The lateral map of the inner and outer hair cells of the cochlear basement membrane.c-Maf is expressed in the cytoplasm of the inner hair cells and the outer hair cells.
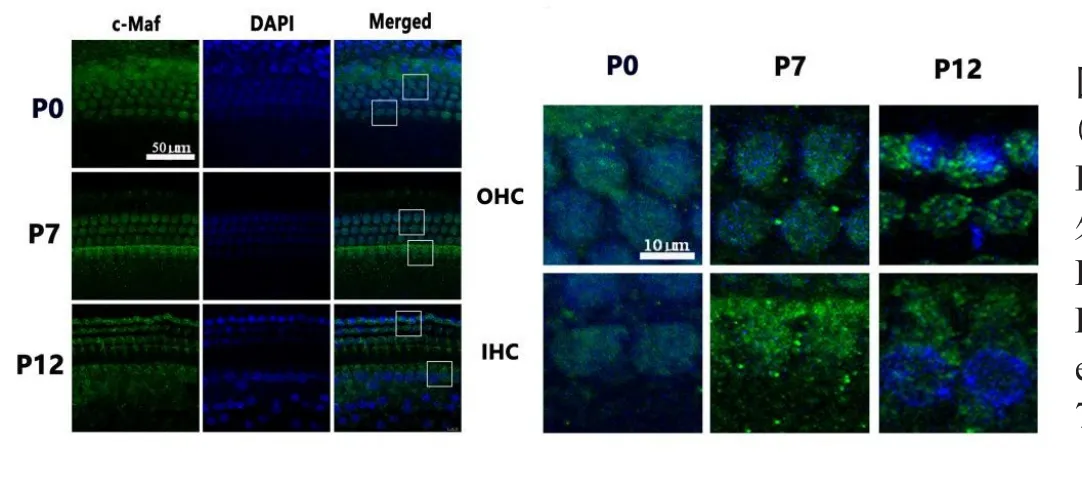
图5 c-Maf蛋白在小鼠耳蜗内外毛细胞各个时间点(P0,P7,P12)的表达情况,局部放大的图片显示:在P0,P7,P12这三个时间点,c-Maf均稳定表达于内毛细胞与外毛细胞的胞质。Fig.5 The expression of c-Maf of different stages(P0,P7,P12)in inner and outer hair cells.c-Maf protein was stably expressed in the inner and outer hair cells of the cochlea 0,7 and 12 days after the birth of the mice.
本研究结果显示,c-Maf基因在成年C57BL/6J小鼠耳蜗内外毛细胞中均有较高的转录,且二者转录水平相近。c-Maf蛋白在耳蜗内外毛细胞胞质内均有较强的表达,通过对内毛细胞与外毛细胞各区域免疫荧光强度分析比较,可发现二者强度相近,此结果与Microarray基因芯片测量数据一致。另外,通过单独对内毛细胞不同区域的荧光强度进行分析后发现:将内毛细胞按照细胞核上区域与细胞核下区域进行划分后,分别统计两区域蛋白信号的荧光强度,我们发现核下区的荧光明显强于核下区,表明此蛋白在内毛细胞核下区较核上区富集。c-Maf蛋白在内毛细胞的这种分布情况可能与蛋白的功能密切相关,例如c-Maf的表达可能与内毛细胞的囊泡转运[13]、突触功能[14-16]、内毛细胞底部离子通道或核下区的细胞器等功能的维持与调节相关。但是,在我们研究中,目前仅对c-Maf在耳蜗内外毛细胞中的表达较明确,其在螺旋神经节、耳蜗核及听皮层的表达尚不清楚,需要进一步深入的研究,以明确其在整个听神经系统的表达与分布。另外,本实验通过对耳蜗各发育时间点(P0,P7,P12)的染色铺片发现:c-Maf蛋白在C57小鼠在出生时的内、外毛细胞上即有较明显的表达,分布于毛细胞的胞质,随着小鼠的年龄增大,在耳蜗的发育中该信号在内、外毛细胞胞质中持续存在,c-Maf可能对耳蜗毛细胞的发育起调控作用。Brian等在研究c-Maf蛋白对小鼠视觉系统发育的影响中发现:c-Maf基因敲除的小鼠胚胎期晶状体发育畸形,初级和次级视神经元细胞轴突不延长,此蛋白在视觉系统的发育中非常关键[17]。那在听觉系统的发育中c-Maf是否也发挥着重要作用呢?由于目前已知的c-Maf全基因片段敲除小鼠的纯合子为胚胎致死性,因此,实验中需要制作条件性c-Maf基因敲除小鼠,或者可以采用将携带能够干扰c-Maf表达的质粒的病毒导入内耳[18],在小鼠的不同发育阶段进行基因敲除或病毒干扰,比较小鼠的耳蜗形态及听觉功能的变化。
综上所述,我们首次对c-Maf基因在小鼠耳蜗内、外毛细胞中的表达、分布特点进行观察,发现c-Maf蛋白在耳蜗内、外毛细胞中均有较高表达,且在这两种细胞中表达量相近,其在内毛细胞核下区的分布明显强于核上区,此分布情况可能与蛋白的功能相关。在小鼠耳蜗的发育过程中,c-Maf蛋白稳定地表达于内、外毛细胞中,可能在毛细胞的发育中起调控作用。有关该基因在听觉系统中所发挥的的作用有待于进一步研究来证实。
参考文献
1 Géléoc GS,Holt JR.Sound Strategies for Hearing Restoration[J].Science,2014,344(6184):1241062.
2 Liu H,Pecka JL,Zhang Q,et al.Characterization of Transcriptomes of Cochlear Inner and Outer Hair Cells[J].J Neurosci,2014,34(33):11085-11095.
3 Yang Y,Cvekl A.Large Maf Transcription Factors:Cousins of AP-1 Proteins and Important Regulators of Cellular Differentiation[J].Einstein J Biol Med,2007,23(1):2-11.
4 Katsuoka F,Yamamoto M.Small Maf Proteins(MafF,MafG,MafK):History,Structure and Function[J].Gene,2016,586(2):197-205.
5 Yoshida T,Ohkumo T,Ishibashi S,et al.The 5'-AT-rich Half-site of Maf Recognition Element:a Functional Target for bZIP Transcription Factor Maf[J].Nucleic Acids Res,2005,33(11):3465-3478.
6 Imaki J,Tsuchiya K,Mishima T,et al.Developmental Contribution of C-maf in the Kidney:Distribution and Developmental Study of c-maf mRNA in Normal Mice Kidney and Histological Study of C-maf Knockout Mice Kidney and Liver[J].Biochem Biophys Res Commun,2004,320(4):1323-1327.
7 Cvekl A,Zhang X.Signaling and Gene Regulatory Networks in Mammalian Lens Development[J].Trends Genet,2017,33(10):677-702.
8 Chien CH,Yu HC,Chen SY,et al.Characterization of c-Maf+Foxp3-Regulatory T Cells Induced by Repeated Stimulation of Antigen-Presenting B Cells[J].Sci Rep,2017,7:46348.
9 Wende H,Lechner SG,Cheret C,et al.The Transcription Factor c-Maf Controls Touch Receptor Development and Function[J].Science,2012,335(6074):1373-1376.
10 Wende H,Lechner SG,Birchmeier C.The Transcription Factor c-Maf in Sensory Neuron Development[J].Transcription,2012,3(6):285-289.
11 Sun W,Yang S,Liu K,et al.Hearing Loss and Auditory Plasticity[J].Hear Res,2017,347:1-2.
12 张昊昱,张宁,张华等.耳聋基因检测在遗传性耳聋诊断及遗传咨询中的应用[J].中华耳科学杂志2016,14(5):639-643.Zhang HY,Zhang N1,Zhang H et al.The Application of Genetic Testing of Deafness Genes in Hereditary Deafness Diagnosis and Genetic Counseling[J],Chinese Journal of Otology,2016,14(5):639-643.
13 Peng Z,Wang GP,Zeng R,et al.Temporospatial Expression and Cellular Localization of VGLUT3 in the Rat Cochlea[J].Brain Res,2013,1537:100-110.
14 Liu K,Jiang X,Shi C,et al.Cochlear Inner Hair Cell Ribbon Synapse is the Primary Target of Ototoxic Aminoglycoside Stimuli[J].Mol Neurobiol,2013,48(3):647-654.
15 Roux I,Safieddine S,Nouvian R,et al.Otoferlin,Defective in a Human Deafness Form,is Essential for Exocytosis at the Auditory Ribbon Synapse[J].Cell,2006,127(2):277-289.
16 杨乐,柳柯,杨仕明等.C57小鼠毛细胞突触带的发育观察[J].中华耳科学杂志2017,15(2):234-238.Yang L,Liu K,Yang SM,et al.Observation of Developmental Changes of Hair Cell Synaptic Ribbons in C57 Mice[J].Chinese Journal of Otology,2017,15(2):234-238.
17 Ring BZ,Cordes SP,Overbeek PA,et al.Regulation of Mouse Lens Fiber Cell Development and Differentiation by the Maf Gene[J].Development,2000,127(2):307-317.
18 史珣贝,吴南,郭维维等.腺相关病毒在耳聋基因治疗上的应用[J].中华耳科学杂志2016,14(1):37-41.Shi XB,Wu N,Guo WW et al.Application of Adeno-Associated Virus Gene Vectors in Hereditary Non-Syndromic Sensorineural Hearing Loss[J].Chinese Journal of Otology,2016,14(1):37-41.
