小鼠耳蜗血管纹血-迷路屏障免疫组织化学研究
2018-05-16塞娜张桐吴军韩维举
塞娜 张桐 吴军 韩维举
解放军总医院耳鼻咽喉头颈外科(北京100853)
血管纹是耳蜗外侧壁的重要组成部分,位于蜗管外侧壁,是一种血管化了的上皮组织。由与内淋巴直接接触的边缘细胞(marginal cell)、靠近螺旋韧带的基底细胞(basal cell)、位于二者之间的中间细胞(intermediate cell)以及毛细血管网等成分组成。血管纹在维持耳蜗内稳态、产生耳蜗内电位(EP)、参与内淋巴液形成以及K+的分泌与循环等方面有着重要作用。近几年,有关血管纹上血-迷路屏障(blood-labyrinth barrier,BLB)的功能及病理生理学研究得到越来越多的关注[1,2],我们利用免疫组织化学、免疫荧光染色技术对血管纹的细胞及结构进行标记,详细观察血管纹三层细胞的形态学特征,特别关注血-迷路屏障各组成部分的结构特征,为今后的相关研究提供全面的形态学基础。
1 材料与方法
1.1 实验动物
年龄在6-8周的C57BL/6J小鼠15只,出生后0-2天(P0-2)小鼠5只,出生后4-5天(P4-5)小鼠5只,雌雄不限,由解放军总医院实验动物中心提供。
1.2 血管纹解剖分离
耳蜗标本事先用4%多聚甲醛灌流处理,4℃冰箱内固定过夜;取出耳蜗后,于室温0.01M的PBS溶液中进行操作,在解剖显微镜观察下用刀片自圆窗和卵圆窗外缘连线下方切开,使耳蜗与前庭分开;用镊子自耳蜗背侧小心去除骨质直至底转完整暴露,可看到骨壁内侧血管网状结构——血管纹;轻轻分离并取出整个蜗轴,找到底转勾突部分,将游丝镊插入螺旋韧带与血管纹之间,沿耳蜗螺旋走向轻抬游丝镊尖将整个血管纹剔除下来,最后用细钩针小心撕除附着于血管纹边缘的前庭膜。
1.3 血管纹细胞骨架蛋白F-actin的荧光染色
将用无水乙醇配制好的罗丹明标记鬼笔环肽(phalloidin)贮存液与0.01M的PBS按照1:20配制成工作液。(1)固定好的标本使用PBS洗3遍。(2)使用10%羊血清室温下封闭30min。(3)倾去羊血清,使用配制好的phalloidin工作液避光染色30min。(4)室温下用PBS漂洗10min×3次。(5)用含DAPI(标记细胞核)的荧光封片剂封片,制备组织铺片。
1.4 细胞紧密连接免疫荧光染色
(1)固定好的标本用PBS洗3遍。(2)用0.25%的Triton通透30min后,PBS洗涤5min×3遍。(3)10%羊血清室温下封闭30min。(4)倾去羊血清,使用PBS按1:50稀释的抗ZO-1兔多克隆抗体(阴性对照以等量PBS代替一抗),放入4℃冰箱孵育过夜。(5)PBS洗涤5min×3遍。(6)将标本移至1:200稀释的Alexa Fluor 568羊抗兔IgG抗体中,室温条件下避光孵育1小时后,PBS洗涤15min×3遍。(8)用含DAPI(标记细胞核)的荧光封片剂封片,制备组织铺片。
1.5 中间细胞层免疫荧光染色
步骤(1)-(3)同上。(4)倾去羊血清,使用兔抗-Desmin抗体(1:100)、兔抗F4/80单克隆抗体(1:200)(阴性对照以等量PBS代替一抗),放入4℃冰箱孵育过夜。(5)PBS洗涤5min×3遍。(6)将标本移至1:100稀释的Alexa Fluor 568羊抗兔IgG抗体、Alexa Fluor 488羊抗小鼠IgG抗体、Alexa Fluor 647 GS-IB4中,室温条件下避光孵育1小时后,PBS洗涤15min×3遍。(7)用含DAPI(标记细胞核)的荧光封片剂封片,制备组织铺片。
1.6 激光扫描共聚焦显微镜观察
激光共聚焦扫描OLYMPUS FV1000-光谱扫描型-(倒置显微镜IX81)设置荧光标本的激发光波长(DAPI、488nm、568nm、647nm),选择放大倍数20倍或60倍的物镜,逐层扫描标本。
2 结果
出生后4天内的小鼠外侧壁血管纹和螺旋韧带无法分开,4天后可将两层组织分离,完整剥离的小鼠血管纹组织呈自然弯曲状态、有一定韧性(图1),底转的勾突(hook)区域宽大呈勺状,勾突稍向上与底转相接处稍缩窄(图5,6)。未经心内灌流动物的血管纹由于毛细血管内血液存在,呈淡红半透明状,边缘界限清晰,自底转到顶转宽度逐渐变窄。
2.1 边缘细胞及基底细胞形态
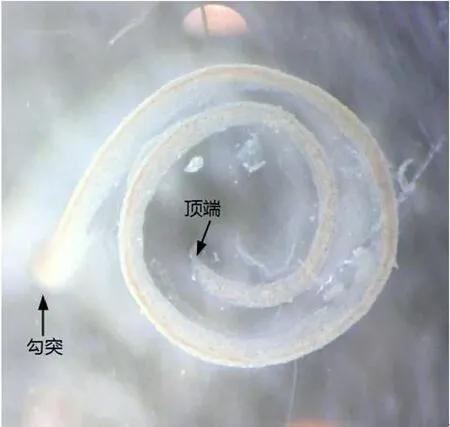
图1 光学显微镜下完整小鼠血管纹Fig.1 Intact mouse stria vascularis under microscope
phalloidin染色细胞骨架F-actin以及ZO-1染色紧密连接蛋白,观察到血管纹边缘细胞呈近圆球形,细胞间紧密相接如城墙状致密排列,层扫观察其剖面呈近圆形的多边形,形状较规则,耳蜗各转的边缘细胞大小基本一致。近螺旋凸处的细胞形态与其余部位明显不同,该处细胞呈细长不规则多边形。
基底细胞与螺旋韧带相接,位于血管纹的基底部,形态相对不规则,多为扁平长形呈近似纺锤状,细胞之间排列紧密。
2.2 中间细胞形态及毛细血管网
致密的毛细血管网贯穿血管纹全程(图5A),底转与顶转毛细血管管径基本一致,顶转较底转血管密度稍稀疏(图5B、C)。毛细血管周围的周细胞(PC),是一类环绕在内皮细胞表面的可收缩细胞,与血管外壁紧密接触,与内皮细胞由基底膜共同包被,如剑鞘样结构伴随毛细血管走形,一起构成了微血管和组织间隙的屏障(图6)。
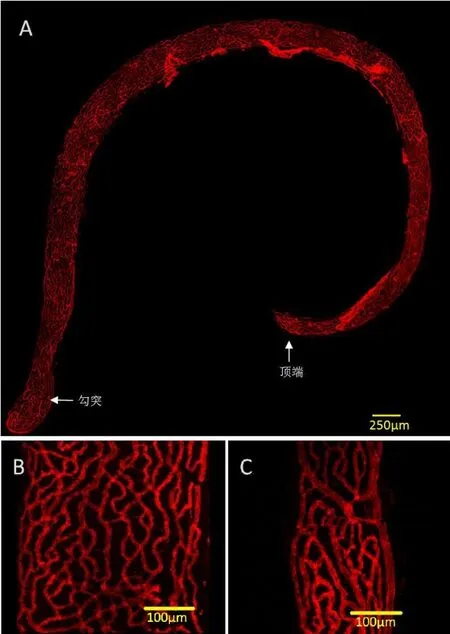
图5 血管纹毛细血管网形态观察。GS-IB4标记毛细血管内皮细胞(红色)。(A)完整血管纹毛细血管网,宽度自顶转至底转逐渐变窄。比例尺:250μm。(B)和(C)分别为底转和顶转毛细血管,可见底转宽度可为顶转2-3倍左右,底转血管密度稍低于顶转。Fig.5 Morphological observation of capillary network of stria vascularis.GS-IB4 marked capillary endothelial cells(red).(A)An intact stria vascular capillary network with a gradually narrowing width from top to bottom.(B)and(C),respectively,for the bottom and apical capillaries,showing that the bottom section can be about 2-3 times the apical turn,the capillary density in bottom turn is slightly lower than the apical turn.

图2 边缘细胞骨架形态结构。(A)细胞骨架由phalloidin标记(红色)。(B)细胞核由DAPI标记(蓝色)。可见边缘细胞形状较规则、排列紧密、大小基本一致,核呈近圆形,而近螺旋凸处的细胞移行区(白色箭头),其形态与其他区域完全不同,呈细长的多边形。比例尺:30μm。Fig.2 Morphology of the Marginal cells.(A)The cytoskeleton F-actin is marked by phalloidin(red).(B)Nuclei labeled by DAPI(blue).It can be seen that the shape of the marginal cells is regular,closely arranged,and the size is similar,the nucleus is nearly round,and the cells transition zone(white arrow)are completely different from other regions.

图3 紧密连接蛋白标记边缘细胞观察细胞形态。(A)紧密连接由ZO-1标记(红色),(B)细胞核由DAPI标记(蓝色)。紧密连接呈连续线性表达,形态与细胞骨架类似。Fig.3 Tight junction protein labeled marginal cells to observe cell morphology.(A)Tight junctions are labeled with ZO-1(red),(B)Nuclei are labeled with DAPI(blue).The tight junctions are continuous and linear and their morphology is similar to which of the cytoskeleton.
基底细胞层位于血管纹最外侧,紧邻螺旋韧带,该层细胞呈扁平长型,连成一片,细胞间连接以紧密连接蛋白(图4)。

图4 紧密连接标记观察基底细胞形态。(A)紧密连接由ZO-1标记(红色),(B)细胞核由DAPI标记(蓝色)。基底细胞呈扁平型,核呈椭圆形,紧密连接蛋白表达较弥散。Fig.4 The basal cell morphology was observed by a tight junction marker.(A)Tight junctions are labeled with ZO-1(red),(B)Nuclei are labeled with DAPI(blue).The basal cells are flat and the nucleus is oval.The expression of tight junction proteins is more diffuse.

图6 毛细血管网及周细胞形态。(A)Desmin标记周细胞(绿色)。(B)GS-IB4标记毛细血管。周细胞呈扁长椭圆形紧贴于血管壁上,包裹血管。Fig.6 Capillary network and pericyte morphology.(A)Desmin labeled pericytes(green).(B)GS-IB4 marker capillaries.Pericytes are oval in shape and cling to blood vessel wall and enclose blood vessels.
中间细胞位于边缘细胞和基底细胞之间,目前认为其主要的成分是毛细血管周黑色素样巨噬细胞(Perivascular-residentmelanocyte-like macrophage,PVM/Ms)。PVM/Ms是在毛细血管周围的一种兼具巨噬细胞和黑色素细胞特征的细胞。形态上类似星形胶质细胞和视网膜神经胶质细胞,推测其应有类似星形胶质细胞之于血-脑屏障,神经胶质细胞之于血-视网膜屏障的作用。该细胞伴随毛细血管周围分布于血管纹全程(图7),其形态大多为树枝状,胞体不与毛细血管直接接触,通过胞体伸出的多个胞浆突触(图7,8)与毛细血管壁接触,将毛细血管包裹起来(图8,9)。Fig.8 Capillary network and PVM/Ms morphology.(A)F4/80 marks PVM/Ms(green).(B)GS-IB4 marker capillaries(red).PVM/Ms are distributed around the capillaries in dendritic shape with a certain distance from the vessels,and contact with the capillaries by the process.
2.3 血-迷路屏障的组成
血-迷路屏障(BLB)由血管纹毛细血管血管内皮细胞、周细胞(PC)、血管周巨噬细胞(PVMs)等组成。周细胞位于两层基膜之间紧贴毛细血管壁伴行(图6,9),PVMs从胞体伸出突起与血管壁紧密接触将血管包裹起来(图7,8,9),这些结构以细胞间的紧密连接为基础,共同构成能够选择性阻挡大分子物质自由出入耳蜗的血-迷路屏障。
3 讨论
3.1 小鼠血管纹解剖特点

图7 完整血管纹中间细胞形态。F4/80标记PVM/Ms细胞Fig.7 Intermediate cells in an intact stria vascularis.F4/80 labeled PVM/Ms cells.

图8 毛细血管网及PVM/Ms细胞形态。(A)F4/80标记PVM/Ms(绿色)。(B)GS-IB4标记毛细血管(红色)。PVM/Ms呈树枝状分布于毛细血管周围,胞体与血管有一定距离,通过突起与毛细血管壁接触。
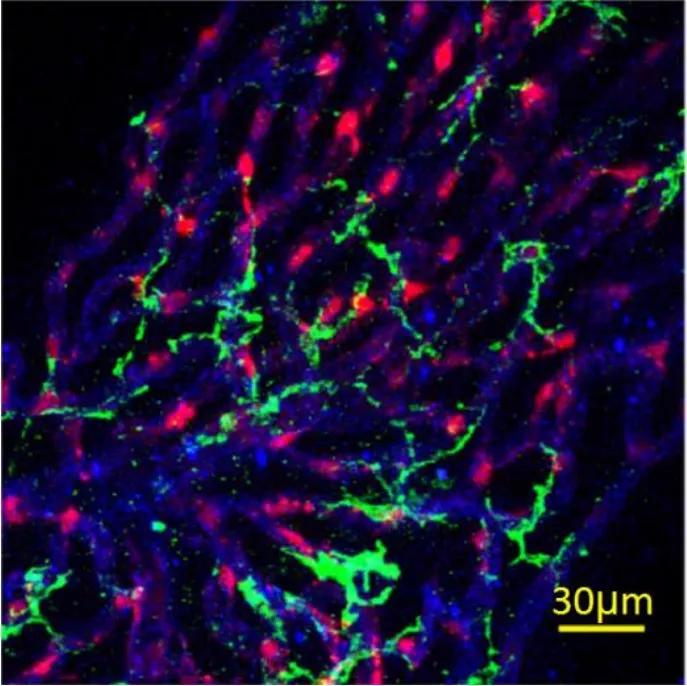
图9 毛细血管、周细胞及PVM/Ms形态观察。F4/80标记PVM/Ms(绿色),GS-IB4标记毛细血管(蓝色),Desmin标记周细胞(红色)。周细胞紧贴毛细血管壁伴行,PVM通过胞质突起与血管壁紧密接触使得血管被包裹在突触套中。Fig.9 Morphological observation of capillaries,pericytes,and PVM/Ms.F4/80 labeled PVM/Ms(green),GS-IB4 labeled capillaries(blue),Desmin labeled pericytes(red).The pericytes are closely attached to the wall of the capillaries.The PVMs are in close contact with the vessel wall through the process so that the vessels are wrapped in the synaptic sleeves.
小鼠血管纹形态结构与人类基本相同,但其发育与人类不同,据Bibas报道,人类胚胎发育至17-18周时血管纹开始出现典型的三层细胞结构,21周后形态既接近成人的结构[3],即人类在出生前血管纹的形态功能就已基本成熟,而小鼠在出生时底转才可以辨别出血管纹的三层细胞[4]。我们解剖P0-P2小鼠的外侧壁,可在显微镜下观察到外侧壁上已有淡红色的血管网状结构,但血管纹和螺旋韧带之间难以分离;P4-5小鼠的血管纹可完整与螺旋韧带分离。表明刚出生的小鼠血管纹虽已具有血管网状结构,但其形态、功能仍不成熟,需要进一步发育成熟。解剖观察5只小鼠发现,出生4天后的小鼠血管纹均可完整与螺旋韧带分离,形态结构与成年鼠基本一致。研究者在对沙鼠耳蜗外侧壁毛细血管网发育的研究中发现,出生后0天的沙鼠螺旋韧带处的毛细血管网已经形成,之后3-9天毛细血管网逐渐发展分化为螺旋韧带和血管纹两层,出生后第9天血管纹处的毛细血管网和螺旋韧带分开,耳蜗外侧壁两层毛细血管网结构趋于成熟[5],这与小鼠血管纹解剖结果类似,都是出生后才发育成熟。
3.2 血管纹边缘细胞和基底细胞特点
边缘细胞与中阶内淋巴液直接接触,本研究观察到边缘细胞(除近螺旋凸处细胞移行区外)细胞呈近圆形的多边形,细胞间排列紧密,由紧密连接蛋白相互结合,膜表面其结构类似城墙,而这种圆球形的表面的排列方式被认为可在一定面积下容纳最大的细胞数量[6],使得内淋巴液与血管纹內液体、血液分隔开来。边缘细胞可将纹内间隙的K+转移至胞浆内,K+再通过钾离子通道(KCNQ1,KCNE1)进入内淋巴,以此维持内淋巴液中高K+浓度(平均145-157mM)。
基底细胞层位于血管纹最外侧,紧邻螺旋韧带,与螺旋韧带间无基底膜相隔,该层细胞呈扁平型,连成一片,细胞间连接以紧密连接蛋白,其作用主要是构成血管纹与螺旋韧带间的屏障。有研究表明,紧密连接蛋白Claudin-11是基底细胞上构成屏障结构的重要成分,Claudin-11缺陷小鼠具有先天性听力缺失[7]。
3.3 血管纹中间细胞及血-迷路屏障特点
内耳的稳态对于维持内耳功能和正常的听功能十分重要。内耳液体稳态的维持依赖于稳定的血液供应、离子转运系统和完整的血-迷路屏障[8]。血管纹的毛细血管网平行于边缘细胞和基底细胞,穿行于中间细胞的间隙,毛细血管被边缘细胞和基底细胞的突起所包围,紧密连接,在血液循环和血管纹内空间之间存在一个严格的、不允许扩散活动发生的屏障,类似于血-脑屏障,故称血-迷路屏障。传统的观点认为血-迷路屏障由内皮细胞和其周围的基底膜组成,内皮细胞之间通过紧密连接彼此相连,形成了一个滤过屏障,该屏障能够选择性地阻止大部分血源性物质进入耳内,保护听觉器官免受系统性影响。而在近期的研究中发现,血管纹中间细胞层还含有大量的周细胞(PC)和血管周围巨噬细胞(PVMs),它们和内皮细胞(EC)相互靠近并互相作用,共同构成了血-迷路屏障。血管纹毛细血管由内皮细胞和基膜组成,自外辐射动脉分支后相互吻合、形成网状结构走行于血管纹中部,被中间细胞及周细胞包围(图7,8,9),最终汇合流入后螺旋静脉。由血管内皮细胞、基底膜、周细胞、PVM/Ms(胞浆突起)等构成血-迷路屏障(blood-labyrinth barrier,BLB)[9],多种听功能障碍性疾病与该屏障的破坏有关,如老年性聋,噪声性聋[2,10],自身免疫性聋等。
PVMs是一种兼具巨噬细胞和黑色素细胞性质的细胞,存在于中枢神经系统及视网膜等多种组织中,我们发现耳蜗血管纹中间层也存在这种细胞,显微镜明场可观察到细胞内黑色素颗粒存在,而白化的动物该细胞内不含黑色素颗粒[6]。因此,PVM/Ms既表达巨噬细胞的表面标志如F4/80、CD68、CD11b、CD45等,又可表达Kir4.1、GST等黑素细胞的表面标志[9]。而内耳其他部位,如螺旋韧带、基底膜,并未观察到这种兼性细胞,仅存在单纯的巨噬细胞。PVM/Ms形态上类似星形胶质细胞和视网膜神经胶质细胞,其足突含有丰富的线粒体和囊泡,与内皮细胞、周细胞交织在一起,并与毛细血管壁相接触(图7,8,9),提示其应有类似星形胶质细胞之于血-脑屏障(blood-brain barrier,BBB)、神经胶质细胞之于血-视网膜屏障的作用,PVM/Ms缺失后导致紧密连接破坏、屏障发生渗漏,引起组织水肿[9]。研究认为中间细胞层承担维持EP和分泌K+的主要作用,哺乳动物正常耳蜗内电位80-100mV,由内淋巴中K+产生,是感受器电流最主要的驱动力[11]。mitf基因缺陷动物由于血管纹中间细胞缺失,EP可降至0-18mV,并引起继发的毛细胞损伤和缺失[12],此时内淋巴液中K+浓度从145mV降低至5mV[13];反之,毛细胞的损伤或死亡则不会引起血管纹结构和功能的破坏。
周细胞(PC)广泛分布于微血管,是一类环绕在内皮细胞表面的可收缩细胞,电镜观察发现周细胞镶嵌于血管基底膜上,周细胞与内皮细胞由基底膜共同包被,一起构成了微血管和组织间隙的屏障,是维持内环境稳定的重要因素[14]。周细胞和内皮细胞在微血管的基底膜上相互靠近,通过一系列的信号通路互相作用,进行信号整合,促进细胞的增殖、分化、成熟,缺乏周细胞可导致毛细血管管径异常增大、通透性增加[14]。在中枢神经系统的研究中发现周细胞是神经血管单元(NVUs)的重要细胞成分,具有多种功能,在脑-血流屏障的发育成熟和维持方面具有重要作用[15]。Bell等[16]报道周细胞随年龄增长进行性丢失,损害脑灌注,干扰血管活动,导致病理性血脑屏障渗漏增加,引起神经元损害、学习障碍、神经系统退化和神经炎。我们发现耳蜗外侧壁毛细血管网含有数量众多的周细胞(图6,9),与血管纹毛细血管紧密接触,伴随着血管全程走行。透射电镜显示在中间细胞层基底膜缺如的区域,周细胞和通过缝隙连接与内皮细胞相接触[6]。目前的研究发现在血管纹和螺旋韧带微血管网中的周细胞存在形态学差异,螺旋韧带上的周细胞表达相关蛋白标志物包括α-SMA、结蛋白Desmin、原肌球蛋白等,而血管纹上的周细胞中只显示结蛋白Desmin阳性,不含有收缩性蛋白α-SMA和原肌球蛋白[17],研究者认为周细胞在螺旋韧带的微血管中可能有控制局部血流的作用,而血管纹处的周细胞对维持血-迷路屏障的结构和功能具有重要作用。但由于周细胞具有形态、生化和生理上的异质性,对于耳蜗外侧壁上周细胞的大部分生理功能及其在耳蜗损伤中的作用都有待进一步研究。
血管内皮细胞之间,边缘细胞之间和基底细胞之间均为紧密连接(tight junction,TJs)。TJs中最重要的是跨膜蛋白Occludin与胞质附着蛋白ZO家族(zonula Occludens protein)及细胞内与其相连的细胞骨架蛋白。occludin及ZO-1相互连接共同调节细胞间通透性[18],其表达和分布上调可使血管通透性降低,ZO-1、Occludin是检测细胞及血管屏障结构和功能的良好指标[19,20]。有研究表明,噪声暴露后内耳中基质金属蛋白酶升高,破坏细胞间紧密连接蛋白,ZO-1、Occludin表达下调使得毛细血管通透性增加、血-迷路屏障破坏,是声损伤引起听力下降的重要机制之一[1,21,22]。
研究表明,BLB的通透性要低于BBB,静脉注射示踪剂TMPA 90分钟后,在脑脊液中测得药物浓度为14.3%,而在前庭阶和鼓阶的外淋巴中测得其浓度分别是6.3%和3.7%[23]。但庆大霉素等药物可穿过BLB却不能穿过BBB[24],因此可见,血-迷路屏障对液体通透的限制比血-脑屏障更大,因为血管纹内的饮液小泡的密度要低一些,并且血-迷路屏障对Na+、Cl-和Ca2+的通透性较其他组织屏障更低[25]。同血脑屏障一样,BLB的存在对于维持内耳正常功能方面起到重要作用,同时,也为药物治疗内耳疾病带来了障碍。耳蜗局部的给药,如圆窗膜药物注射、耳蜗中阶药物注射等,还均处于动物模型研究阶段,也由于其操作难度大、操作本身会造成听力损伤等,目前很难应用于临床。而静脉药物注射,如若能够研究出突破血-迷路屏障、靶向将大分子药物递送到内耳的技术,将大大提高目前治疗内耳疾病的效果。
参考文献
1 Wu J,Han W,Chen XR,et al.MMP-2 and MMP-9 Contribute to Functional Integrity and Noise-induced Damage to Blood-Labyrinth Barrier[J].Molecular Medicine Reports.2017,16:1731-1738.
2 张桐,韩维举.耳蜗血管纹血-迷路屏障病理生理学研究进展[J].中华耳科学杂志.2017,15(2):257-262.Zhang T,Han WJ.Advances in Pathophysiological Studies of Cochlear Blood-Labyrinth Barrier[J].Chinese Journal of Otology.2017,15(2):257-262.
3 Bibas A,Liang J,Michaels L,et al.The Development of the Stria Vascularis in the Human Foetus[J].Clin Otolaryngol Allied Sci.2000,25(2):126-129.
4 Kikuchi K,Hilding DA.The Development of the Stria Vascularis in the Mouse[J].Acta Otolaryngol.1966,62(4):277-291.
5 Ando M,Takeuchi S.Postnatal Vascular Development in the Lateral Wall of the Cochlear Duct of Gerbils:Quantitative Analysis by Electron Microscopy and Confocal Laser Microscopy[J].Hear Res.1998,123:48-156.
6 林琳,孙建和,黄德亮.胎儿耳蜗血管纹的扫描电镜观察[J].临床耳鼻咽喉科杂志.2005,4:157-159.Lin L,Sun JH,Huang DL.Scanning Electron Microscopic Observation of the Fetal Stria Vasculari[J].J Clin Otorhinolarygol(China).2005,4:157-159.
7 Wu YX.Noise Alters Guinea Pig's Blood-labyrinth Barrier Ultrastructure and Permeability along with a Decrease of Cochlear Claudin-5 and Occludin[J].BMC Neurosci.2014,15:136.
8 Juhn SK,Hunter BA,Odland RM.Blood-labyrinth Barrier and Fluid Dynamics of the Inner Ear[J].Int Tinnitus J.2001,7(2):72-83.
9 Zhang W,Dai M,Fridberger A,et al.Perivascular-resident Macrophage-like Melanocytes in the Inner Ear are Essential for the Integrity of the Intrastrial Fluid-blood Barrier[J].Proc Natl Acad Sci U.S.A.2012,109(26):10388-93.
10 张纪帅,陈星睿,吴军,等.白噪声暴露前后豚鼠听觉功能检测[J].中华耳科学杂志.2015,13(1):141-144.Zhang JS,Wu J,Chen XR,et al.Detection of Guinea Pigs’Hearing Functions before and after White Noise Exposure[J].Chinese Journal of Otology.2015,13(1):141-144.
11 Davis H.Biophysics and Physiology of the Inner Ear[J].Physiol Rev.1957,37(1):1-49.
12 Liu H,Li Y,Chen L,et al.Organ of Corti and Stria Vascularis:Is there an Interdependence for Survival?[J].PLoS One.2016.11(12):1-21.
13 Chen L,Guo W,Ren L,et al.A de novo Silencer Causes Elimination of MITF-M Expression and Profound Hearing Loss in Pigs[J].BMC Biol.2016,14:52.
14 Armulik A,Genové G,Betsholtz C.Pericytes:Developmental,Physiological,and Pathological Perspectives,Problems,and Promises[J].Dev Cel.2011,21(1):193-215.
15 Armulik A,Genové G,Mäe M,et al.Pericytes Regulate the Blood-brain Barrier[J].Nature,2010.468(7323):557-61.
16 Bell RD,Winkler EA,Sagare AP,et al.Pericytes Control Key Neurovascular Functions and Neuronal Phenotype in the Adult Brain and during Brain Aging[J].Neuron.2010,68(3):409-27.
17 Shi X,Han WJ,Yamamoto H,et al.The Cochlear Pericytes[J].Microcirculation.2008,15(6):515-29.
18 Kniesel U,Wolburg H.Tight Junctions of the Blood-brain Barrier[J].Cell Mol Neurobiol.2000,20(1):57-76.
19 Hawkins BT,Davis TP.The Blood-brain Barrier/Neurovascular Unit in Health and Disease[J].Pharmacol Rev.2005,57(2):173-185.
20 Lee HS,Namkoong K,Kim DH.Hydrogen Peroxide-induced Alterations of Tight Junction Proteins in Bovine Brain Microvascular Endothelial Cells[J].Microvasc Res.2004,68(3):231-238.
21 Hu BH,Cai QF,Hu ZH.Metalloproteinases and their Associated Genes Contribute to the Functional Integrity and Noise-induced Damage in the Cochlear Sensory Epithelium[J].J Neurosci.2012,32(43):14927-14941.
22 吴军,韩维举.耳蜗血-迷路屏障与噪声性听力损伤[J].听力学及言语疾病杂志.2015,23(4):427-430.Wu J,Han WJ.Damage of Blood-Labyrinth Barrier and Noise-induced Hearing Loss[J].Journal of Audiology and Speech Pathology.2015,23(4):427-430.
23 Inamura N,Salt AN.Permeability Changes of the Blood-labyrinth Barrie Measured in vivo during Experimental Treatments[J].Hear Res.1992,61:12-18.
24 Neuwelt EA,Baker DE,Pagel MA.Cerebrovascular Permeability and Delivery of Gentamicin to Normal Brain and Experimental Brain Abscess in Rats[J].Neurosurg.1984,61:430-439.
25 Juhn SK,Rybak LP,Prado S.Nature of Blood-labyrinth Barrier in Experimental Conditions[J].Ann Otol Rhinol Laryngol.1981,90:135-141.
