Dot1l在正常豚鼠耳蜗中的表达
2018-05-16章碧云秦丽罗小莉钟时勋
章碧云 秦丽 罗小莉 钟时勋
重庆医科大学附属第一医院,耳鼻咽喉科(重庆400016)
梅尼埃病(Meniere’s disease,MD)是以眩晕、耳鸣、进行性波动性听力下降和耳胀满感为表现的常见内耳病,其病理基础为膜迷路积水。内淋巴液中高钾低钠的环境由Na+、K+转运维持,Na+、K+代谢失衡常导致内淋巴水肿,从而导致膜迷路积水。
上皮钠通道(Epithelial Na+Channel,ENaC)作为高选择性Na+通道,是Na+吸收的限速步骤,主要分布肾小管、结肠、分泌腺管道、呼吸道上皮。我们前期研究表明,ENaC在内耳中也有表达[1],且参与内淋巴水肿的形成[2]。近年通过对肾脏的研究表明,ENaC表达受组蛋白H3K79甲基化转移酶Dot1l(Disruptor of telomeric silencing 1-like)的调控[3],然而内耳是否也通过表达Dot1l、调控ENaC从而调节内淋巴代谢仍不清楚。本实验期望通过研究Dot1l在内耳中的表达,为进一步研究内淋巴代谢、梅尼埃病发病机制奠定基础。
1 材料和方法
1.1 试剂
兔抗鼠Dot1l单克隆抗体(Abcam,ab64077),SABC免疫组化试剂盒(博士德,SA1022),过氧化物酶阻断剂(博士德,AR1108),DAB显色液(博士德,AR1022)。
1.2 实验动物的选择和取材
选取耳廓反射灵敏、听性脑干反应(ABR)检测听阈不超过30dB SPL的健康红目豚鼠6只,体重200-300g,由重庆医科大学动物实验中心提供,。豚鼠按40mg/kg 1%戊巴比妥钠腹腔注射深度麻醉,予以生理盐水心脏灌注至口唇苍白后换为4%多聚甲醛继续灌注,待颈僵直后迅速断头、游离颞骨取出耳蜗,同时取出肾组织。将耳蜗浸于4%多聚甲醛中,在手术显微镜下以精细镊戳破圆窗膜,蜗顶钻小孔后由蜗顶缓慢吹入液体,至圆窗流出液清亮后置入新的4%多聚甲醛液中固定48小时,10%乙二胺四乙酸(EDTA)中脱钙1月,期间隔天更换脱钙液。将已脱钙的耳蜗于各梯度酒精脱水,二甲苯透明,石蜡包埋,以4um的厚度沿蜗轴切片。
1.3 SABC法免疫组化
65℃烤箱烤片2小时,二甲苯脱蜡2小时,梯度酒精(100%、95%、80%、75%)至水各1次,每次5分钟,流水冲洗15分钟。切片以内源性过氧化物酶阻断剂室温孵育20分钟,磷酸盐缓冲液(PBS)洗3次,每次5分钟,0.12%胰酶37℃孵育30分钟,磷酸盐缓冲液(PBS)洗3次,每次5分钟,BSA 37℃孵育20分钟,甩去血清,加入滴度为1:100的兔抗小鼠Dot1l抗体,4℃过夜后37℃复温1小时,PBS洗3次,每次5分钟,SABC室温孵育20分钟,PBS洗3次,每次5分钟,山羊抗兔二抗37℃30分钟,PBS洗3次,每次5分钟。DAB显色后苏木素复染90秒,盐酸分化2秒,饱和碳酸锂返蓝2分钟,脱水,封片。肾脏做阳性对照,PBS代替Dot1l抗体做空白对照。镜下组织出现黄色或棕色颗粒为阳性。采用Image-Pro Plus 6.0计算三转免疫组化阳性各部位平均光密度值(OD值)。
1.4 统计分析
所有数据以SPSS 20.0软件处理,资料以均数±标准差(± s)进行统计描述。三转间的光密度(optical density,OD)值比较采用单因素方差分析,以P<0.05为有差异,Graphpad Prism 6.0作图。
2 结果
2.1 ABR豚鼠听阈19.58±4.50dB SPL,符合实验动物要求。
2.2 免疫组化
以Dot1l在肾脏的表达作为阳性对照,Dot1l主要表达于肾小管细胞质(图1)。以生理盐水代替Dot1l一抗作为实验的阴性对照,见耳蜗各部位无显色(图2)。Dot1l在豚鼠耳蜗中广泛表达于血管纹(stria vascularis,StV)、螺旋韧带(spiral ligament,SPL)、前庭膜(Reissner’s membrane,RM)、Corti器(organ of Corti,OC)、螺旋缘(spiral limbus,SLM)(图3、图4),螺旋神经节(spiral ganglion,SG)(图5)、外螺旋沟根细胞(Root Cell,RC)(图6)。Dot1l在螺旋神经节中的表达由底转向顶转逐渐增强(图5、图7),OD值分别为0.100±0.019、0.121±0.008、0.149±0.0060,F=6.22,P=0.0201;在螺旋韧带中的表达由底转向中转、顶转逐渐减少(图4、图7),OD值分别为0.151±0.006、0.121±0.006、0.106±0.023,F=8.29,P=0.0091。Dot1l在各转血管纹、前庭膜、Corti器、螺旋缘中的表达无显著差异。因部分标本切片时根细胞处破损,三转根细胞未能做灰度值统计分析。

图1 Dot1l在豚鼠肾脏远端集合小管的表达。Fig.1 Dot1l expresses in renal collecting duct cells as positive control.图2 以生理盐水代替Dot1l抗体作为阴性对照,免疫组化无阳性显色。Fig.2 No positive area was detected when anti-Dot1l was replaced by saline.图3 Dot1l在豚鼠耳蜗各转螺旋器、螺旋神经节中均有表达。Fig.3 Dot1l was found in in spiral organ and spiral ganglion in allturns.图4 Dot1l表达于血管纹(StV)、螺旋韧带(SPL)、前庭膜(RM)、Corti器(OC)、螺旋缘(SLM),在螺旋韧带中由底转(4a)向中转(4b)、顶转(4c)表达逐渐降低、分布逐渐集中于近血管纹侧。Fig.4 Dot1l exists in the stria vascularis(StV),Reissner’s membrane(RM),spiral ligament(SPL),organ of Corti(OC),spiral limbus(SLM)and spiral ganglion.From basal turn to apical turn,Dot1l expression in spiral ligament decreased.图5 Dot1l在螺旋神经节中的表达由底转(5a)向中转(5b)、顶转(5c)增强。Fig.5 Dot1l expression in spiral ganglion increased from basal turn to apical turn.图6 Dot1l在根细胞(RC)处呈现强阳性表达。Fig.6 Dot1l has a strong expression root cell(RC).
3 讨论
Na+、K+离子代谢紊乱是导致膜迷路积水的基础。1997年Dunnebier首次通过手术破坏单侧内淋巴囊或内淋巴管后全身应用醛固酮,未手术侧仍出现膜迷路积水[4],随后蒋子栋[5,6]通过单纯腹腔注射醛固酮也成功诱导出膜迷路积水,推测醛固酮可能通过调节水钠平衡引起膜迷路积水。Zhang等通过对肾脏的研究表明,醛固酮抑制Dot1l的可变剪切体Dot1a与Af9的作用[7,8]解除Dot1a-Af9对α-ENaC启动子区组蛋白H3K79的甲基化,增强α-ENaC表达,从而调节水钠代谢[3]。我们前期研究证实ENaC在豚鼠耳蜗中表达于血管纹、螺旋韧带、前庭膜、螺旋神经节、Corti器、螺旋缘等部位[1],且ENaC也参与内淋巴积水的形成[2],醛固酮作用后AF9蛋白在豚鼠耳蜗中表达减弱[9]本次研究表明Dot1l表达于豚鼠耳蜗的血管纹、螺旋韧带、前庭膜、螺旋神经节、Corti器、螺旋缘等ENaC表达的部位,因此我们推测可能与肾脏类似,ENaC在豚鼠耳蜗中对内淋巴循环的调控也与Dot1l-Af9的表达有关。
Ten Cate WJ等认为,Na+,K+-ATP酶在血管纹的活性由底转向顶转增加[10],蒋子栋等认为其可能与醛固酮引起膜迷路积水的发生机制有关[4]。离子通道的转运能力除与活性相关以外,还与表达量和分布有关,我们研究发现,Dot1l在螺旋韧带中的表达由底转(图4c)向中转(图4b)、顶转(图4a)逐渐降低,且表达逐渐集中于靠近血管纹侧。由于醛固酮可通过抑制Dot1l来增强ENaC的表达[6,7],因此我们推测Dot1l在各转螺旋韧带中的表达差异可能导致ENaC的表达或活性由底转向顶转逐渐增强,从而使各转的内淋巴代谢能力不同,但还需要进一步研究来证实。
梅尼埃病患者有逐渐加重的波动性听力下降,耳蜗电图多有异常,既往观点认为其听力下降是内淋巴液生化代谢紊乱使毛细胞、传入神经纤维、螺旋神经节细胞发生退行性变导致,但无法解释听力损失呈早期低频型、晚期平坦型的频率特点。Zhang W[7]等证实醛固酮可下调Dot1l表达,刘抗寒等通过对肾脏的研究表明下调Dot1l-AF9表达可增加 ET-1 的表达[12,13]。ET-1可促进细胞内Ca2+的释放,增加Ca2+受体的敏感性,造成细胞内Ca2+超载从而损伤细胞,在感音神经性耳聋的发生上有一定作用[11][14,15]。我们推测:醛固酮作用后螺旋神经节Dot1l表达减弱、ET-1表达增强,引起血管收缩、钙超载等损伤螺旋神经节细胞,从而影响听力。Dot1l在顶转螺旋神经节(图5c)中的表达强于中转(图5b)、底转(图5a),因此我们进一步推测:醛固酮在顶转螺旋神经节下调Dot1l表达的作用可能比在中转、底转更明显,使得顶转的ET-1表达增加进而损伤螺旋神经节的效应作用更强,因而低频听力更易受到损害。然而梅尼埃病患者及膜迷路积水动物模型内耳中是否确有ET-1表达的增加,仍待进一步研究证实。
本研究显示,Dot1l在外螺旋沟的根细胞呈强阳性表达(图6)。根细胞是位于Claudius细胞深层的根状细胞,是外螺旋沟从内淋巴液中重吸收Na+、分泌K+、维持内淋巴液低钠高钾的重要部位16-18]Dot1l在根细胞的强阳性表达可能对维持根细胞的正常内淋巴液代谢有重要作用。根细胞在耳蜗各转的形态、数量有差异[16],这也可能导致各转耳蜗的离子代谢能力不同。
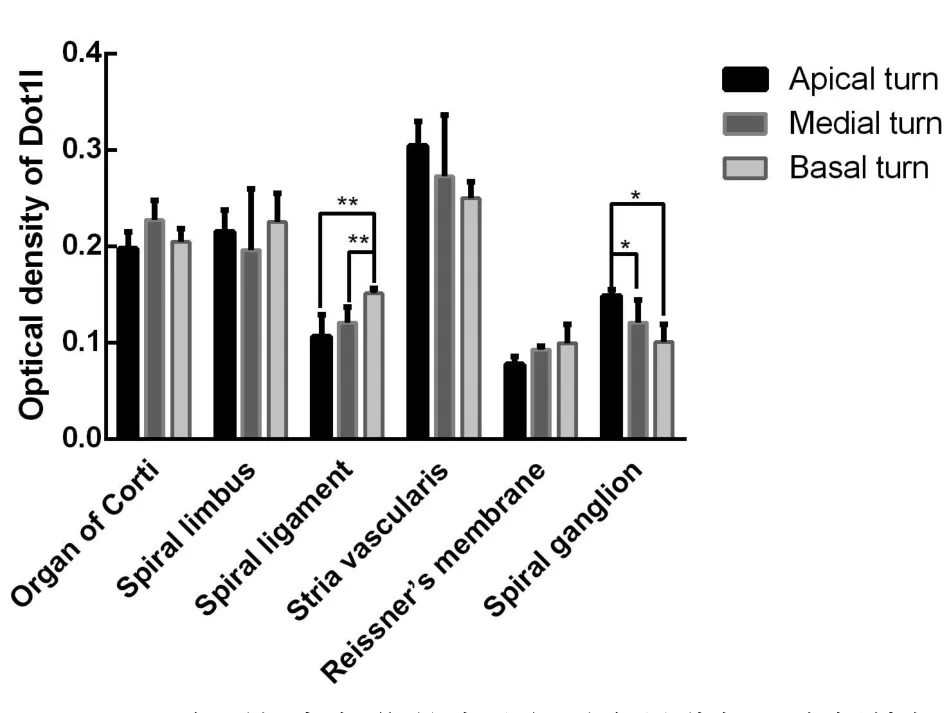
图7 Dot1l在耳蜗各部位的表达相对定量分析。在螺旋韧带中,Dot1l由底转向顶转减弱(F=8.29,P=0.0091),在螺旋神经节中由底转向底转增强(F=6.22,P=0.0201)。*P<0.05。**P<0.01。Fig.7 The relative analysis of Dot1l expression in each position.From basal turn to apical turn,Dot1l expression in spiral ligament decreased(F=8.29,P=0.0091),while that in spiral ganglion increased(F=6.22,P=0.0201).*P<0.05.**P<0.01.
本实验首次研究了Dot1l在豚鼠耳蜗中的表达,发现Dot1l表达于豚鼠耳蜗中Na+代谢的关键部位,结合我们前期对Af9的研究[8],我们推测Dot1l-Af9可能参与维持内淋巴循环。
参考文献
1 Zhong SX,Hu GH,Liu ZH.Expression of ENaC,SGK1 and Nedd4 Isoforms in the Cochlea of Guinea Pig[J].Folia Histochemica et Cytobiologica,2014,52(2):144-148.
2 温雅,钟时勋.去氨加压素对耳蜗功能及上皮钠通道表达的调节作用[J].中华耳科学杂志.2014,12(3):498-502.Wen Y,Zhong SX.Regulation of Epithelial Sodium Channels and Cochlear Function by Desmopressin[J].Chinese Journal of Otology,2013,11(3):329-334.
3 Zhang W,Xia X,Reisenauer M R,et al.Dot1a-AF9 Complex Mediates Histone H3 Lys-79 Hypermethylation and Repression of α-ENaC in an Aldosterone-sensitive Manner[J].Journal of Biological Chemistry,2006,281(26):18059-18068.
4 Dunnebier EA,Segenhout JM,Wit HP,et al.Two-phase Endolymphatic Hydrops:A new Dynamic Guinea Pig Model[J].Acta oto-laryngologica,1997,117(1):13-19.
5 蒋子栋,张连山.醛固酮诱发豚鼠双耳膜迷路积水[J].中国医学科学院学报.2002,24(5):501-504.Jiang ZD,Zhang LS.Endolymphatic Hydrops of Both Ears of Guinea Pigs Produced by Aldosterone[J].Acta Academiea Medicinae Sinicae,2002,24(5):501-504.
6 蒋子栋,高帆,孙程成.不同方法构建豚鼠膜迷路积水模型的对比研究[J].中华耳科学杂志.2015,13(4):734-737.Jiang ZD,Gao F,Sun CC.A Comparative Study of Guinea Pig Models of Endolymphatic Hydrops[J].Chinese Journal of Otology,2015,13(4):734-737.
7 Reisenauer MR,Wang SW,Xia Y,et al.Dot1a Contains Three Nuclear Localization Signals and Regulates the Epithelial Na+Channel(ENaC)at Multiple Levels.Am J Physiol Renal Physiol,2010,299:F63-F76.
8 Zhang W,Yu Z,Wu H,et al.An Af9 Cis-element Directly Targets Dot1a to Mediate Transcriptional Repression of the αENaC gene.Am J Physiol Renal Physiol,2013,304:F367-F375.
9 秦丽,章碧云,钟时勋.醛固酮对豚鼠耳蜗功能及AF9蛋白表达的调节作用[J].中华耳科学杂志.2016,14(6):788-792.Qin L,Zhang BY,Zhong SX.Regulation of AF9 Protein Expression and Cochlear Function by Aldosterone in Guinea pigs[J].Chinese Journal of Otology,2016,14(6):788-792.
10 Ten Cate WJ,Rarey KE.Density of Marginal Cell Basolateral Membranes in Basal,Middle,and Apical Turns of the Rat Cochlea[J].Am J Otol,1994,15(3):389-393.
11 Zhou Q,Liu K,Wu H,et al.Spironolactone Rescues Dot1a-Af9-Mediated Repression of Endothelin-1 and Improves Kidney Injury in Streptozotocin-Induced Diabetic Rats[J].PLoS One,2012,7(10):e47360.
12 Jinnouchi K1,Tomiyama S,Pawankar R,et al.Distribution of Endothelin-1-like Activity in the Cochlea of Normal Guinea Pigs[J].Acta Otolaryngol,1997,117(1):41-45.
13 Franz Pl,Hauser-Kronberger C,Egerbacher M,et al.Localization of Endothelin-1 and Endothelin-3 in the Cochlea[J].Acta Otolaryngol,1997,117(3):358-62.
14 李波波,吴剑,陈婧等.盐酸椒苯酮胺对庆大霉素所致豚鼠听力损伤的保护作用[J].南方医科大学学报.2016,36(4):557-561.Li BB,Wu J,Chen J,et al.Protective Effect of Peperphentonamine Injection through the Otocyst Against Gentamicin Induced Cochlear Damage in Guinea Pigs.J South Med Univ,2016,36(4):557-561.
15 Ahmed M,Rghigh A.Polymorphism in Endothelin-1 Gene:An Overview[J].Curr Clin Pharmacol,2016,11(3):191-210.
16 Marcus DC,Chiba T.K+and Na+Absorption by Outer Sulcus Epithelial Cells[J].Hearing Research,1999,134(1-2):48-56.
17 Jagger DJ,Forge A.The Enigmatic Root Cell-Emerging Roles Contributing to Fluid Homeostasis within the Cochlear Outer Sulcus[J].Hearing Research,2013,303(9):1-11.
18 许庆庆,郭维维,翟所强.耳蜗血管纹细胞离子转运的研究进展[J].中华耳科学杂志.2015,13(15):30-35.Xu QQ,Guo WW,Zhai SQ.A Review of Research on Ionic Transport in Cochlear Stria Vascularis[J].Chinese Journal of Otology,2015,13(15):30-35.
