银杏叶及其提取物中银杏黄酮的HPLC测定方法研究
2018-05-15王亚杨清山徐猛胡燕金桑少阳
王亚,杨清山,2,*,徐猛,胡燕金,桑少阳
(1.晨光生物科技集团股份有限公司,河北邯郸057250;2.河北省植物天然色素产业技术研究院,河北邯郸057250)
银杏(Ginkgo biloba L.)为银杏科属植物,化学成分为黄酮醇苷、双黄酮、原花青素、银杏内酯、聚戊烯醇、有机酸等[1-2]。其中黄酮醇苷类化合物具有降低血清胆固醇、抑制血栓形成、改善血液循环、保护神经细胞、改善心脑等功效[3-5],具有很高的药用价值。因此,对银杏叶的药用、保健、化妆品等综合价值的研究日益受到国内外的重视。
目前,银杏叶及其提取物(Ginkgobilobaextract,EGB)中总黄酮含量的测定方法主要包括分光光度法、比色法、衍生法-气相色谱法、高效液相色谱法(high performance liquid chromatography,HPLC)等[6-8]。采用分光光度法测定时由于样品未经分离纯化,样品中总黄酮含量的测定会受到样品中原花青素等酚类物质的干扰,造成检测不准确;比色法仅能粗略测定总黄酮含量,且由于受到原花青苷元类化合物的影响,导致该法的重现性较差;衍生法-气相色谱法由于装置较贵,操作繁琐,应用不普遍;高效液相色谱法(HPLC)[9-12]由于其操作简单、灵敏度高、准确度高等特点成为国内外使用最为广泛的方法。
本研究以中国药典(CP)和美国药典(USP)中银杏叶提取物和银杏叶总黄酮含量的HPLC测定方法为基础,通过对检测色谱条件进行优化,建立一种能同时使用中国药典和美国药典方法检测样品中各成分及总黄酮含量的方法,并对两种方法进行系统的方法学验证。
1 材料与方法
1.1 试验材料
槲皮素、山奈酚、异鼠李素标准品:Sigma公司,纯度分别为96%、98.6%和95.7%;银杏叶粉末3批(用FW100型万能粉碎机粉碎,过40目筛备用)分别为原料1、原料2、原料3;银杏叶提取物3批,分别为提取物1、提取物2、提取物3。甲醇、磷酸,色谱纯;其余试剂均为分析纯。
Waters E2695型高效液相色谱仪(配备Waters2489紫外检测器):美国沃特世公司;DK-98-IIA型电热恒温水浴锅(配备冷凝回流系统)、FW100型万能粉碎机:天津市泰斯特仪器有限公司;SHB-Ⅲ型循环水式多用真空泵、RW12型旋转蒸发器:上海申生科技有限公司;TH-600型超声清洗机:济宁天华超声电子仪器有限公司。
1.2 试验方法
1.2.1 美国药典方法
1.2.1.1 色谱条件
流动相为甲醇:0.5%磷酸水=1∶1,波长为370 nm,流速为1.5mL/min,进样量为20μL。
1.2.1.2 样品前处理
银杏叶提取物:称取0.30 g(精确至0.000 1 g)样品,放入带有冷凝管的250mL长颈烧瓶中。加入78mL的酸解液 A(乙醇 ∶盐酸 ∶水=25∶4∶10,体积比),在热水浴(85℃)中回流135min。冷却至室温,转移到100mL容量瓶中,用水定容,混匀。
银杏叶粉末:称取1.00 g样品,放入带有冷凝管的250mL烧瓶中。加入78mL的酸解液A,在热水中回流135min。冷却至室温,转移到100mL容量瓶中。添加20mL甲醇至250mL烧瓶中,超声30min。过滤,用100mL容量瓶收集滤液,用甲醇洗去滤纸上残留物,用同一100mL容量瓶收集滤液,定容,混匀。
1.2.1.3 总黄酮醇苷含量的计算
黄酮醇苷元的含量按公式(1)计算:

式中:fi分别对应于槲皮素、山奈素和异鼠李素3种黄酮醇苷元的含量(i=1、2、3),%;rv为样品溶液中相关化合物的峰面积;rs为标准溶液中相关化合物的峰面积;Cs为标准溶液中相关化合物的浓度,mg/mL;W为样品溶液中银杏叶提取物样品的称样质量,g。
总黄酮醇苷的含量按公式(2)计算:
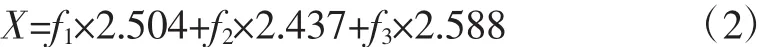
式中:X为总黄酮醇苷的含量,%;f1为槲皮素黄酮醇苷元含量,%;f2为山奈素黄酮醇苷元含量,%;f3为异鼠李素黄酮醇苷元含量,%;2.504、2.437、2.588为分别为槲皮素、山奈素、异鼠李素对应的转化系数。
1.2.2 中国药典方法
1.2.2.1 色谱条件
流动相为甲醇:0.4%磷酸水=1∶1,波长为360 nm,流速为1.0mL/min,进样量为10μL。
1.2.2.2 样品前处理
银杏叶提取物:称样0.03 g,使用25mL酸解液B(甲醇-25%盐酸=4∶1)水回流30min,最后转移到50mL容量瓶中,用甲醇定容,摇匀。
银杏叶粉末:称样1.00 g,先用三氯甲烷索氏抽提2 h,挥干后再用甲醇回流4 h,蒸干后加入25mL酸解液B在热水浴(80℃)中回流30min,最后转移到50mL容量瓶中,用甲醇定容,摇匀。
1.2.2.3 总黄酮醇苷的计算
该方法以槲皮素作为对照品,分别按照相对应的校正因子计算槲皮素、山奈素和异鼠李素的含量,黄酮醇苷元的含量按公式(3)计算:
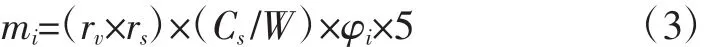
式中:mi分别对应于槲皮素、山奈素和异鼠李素3种黄酮醇苷元的含量(i=1、2、3),%;rv为样品溶液中相关化合物的峰面积;rs为标准溶液中槲皮素的峰面积;Cs为标准溶液中槲皮素的浓度,mg/mL;W为样品溶液中银杏叶提取物样品的称样质量,g;φi为对应于槲皮素、山奈素和异鼠李素的校正因子(i=1、2、3),分别为 1.000 0、1.002 0 和 1.089 0。
总黄酮醇苷的含量按公式(4)计算:
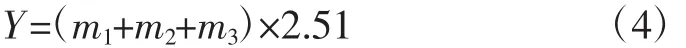
式中:Y为总黄酮醇苷的含量,%;m1为槲皮素黄酮醇苷元含量,%;m2为山奈素黄酮醇苷元含量,%;m3为异鼠李素黄酮醇苷元含量,%;2.51为各个化合物的平均转化系数。
1.2.3 标准储备液的配制
分别称取槲皮素、山奈素、异鼠李素标准品10、10、2mg(精确到 0.000 1)于同一 25mL 容量瓶中,用色谱甲醇定容,充分摇匀保证其完全溶解后,作为储备液,4℃冰箱保存,有效期1年。
1.3 数据处理
所有试验数据结果均采用两次平行试验的“平均值±标准偏差”表示,采用SPSS数据处理软件进行分析,P<0.05表示具有显著性差异。
2 结果与分析
2.1 液相检测条件的选择
考虑到美国药典和中国药典方法条件的差异性,优化后的液相检测色谱条件可合并为一个,设置双波长检测(美国药典370 nm,中国药典360 nm),满足同时进行两种检测方法的需求。
2.1.1 流速的选择
流速为1.5 L/min时,系统压力较大,不利于色谱柱的维护,故调整流速为1.0mL/min。
2.1.2 流动相的选择
由于两种方法的流动相中磷酸水的浓度有微小的差异,理论上流动相的极性发生细微的变化仅会影响目标物质的出峰时间,而对其含量的测定影响不大,因此将流动相条件选为甲醇:0.4%磷酸水=1∶1。流动相为甲醇:0.4%磷酸水=1∶1时,样品液中各成分出峰时间均在5min以内,出峰时间较早,不能满足试验要求,把流动相调整为甲醇:0.4%磷酸水=2∶3,能够满足试验要求。
2.1.3 色谱柱的选择
采用甲醇:0.4%磷酸水=2∶3为流动相,等度洗脱,考察了1#色谱柱:型号为MG IIC18,规格为4.6mm×150 mm,5 μm;2#色谱柱:型号为 LP-C18,规格为4.6 mm×250mm,5μm;3#色谱柱:型号为 Eclipse Plus C18,规格为 4.6mm×100mm,3.5μm;4#色谱柱:型号为ZORBAXSB-C18,规格为 4.6mm×150mm,5μm。综合样品液中各目标成分的出峰时间、峰形、分离度等情况,发现3#色谱柱检测3种成分的峰形和分离度均较好,并且可将检测时间控制在20min以内,保证了检测效率。
2.1.4 进样量的选择
考察进样量分别在10μL和20μL条件下(如图1所示)仪器检测的精密度时发现,当进样量为20μL时,由于进样量过大,会在色谱柱中产生溶剂效应,导致各成分的分离度和峰形较差,因此进样量应选为10μL。
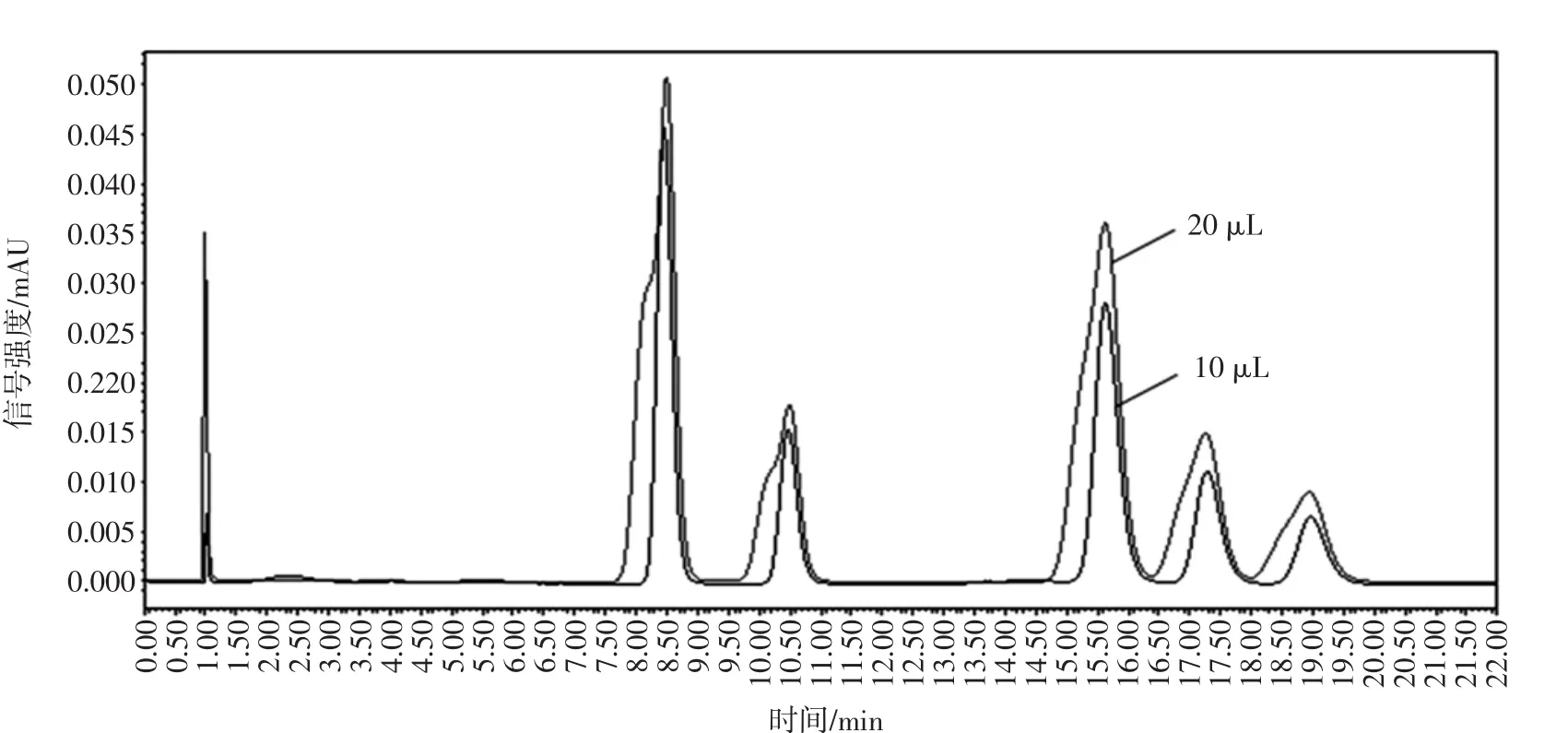
图1 样品液分别在10μL和20μL下的叠加HPLC色谱图Fig.1 The HPLC chromatogram sof samplesolution at10μL and 20μL
2.1.5 柱温的选择
在确定流动相、色谱柱及进样量的情况下,分别考察了25、35、40℃柱温,发现柱温为40℃时3种成分的峰形和分离度均较好。
2.2 检测方法的方法学验证
2.2.1 标准曲线和检出限
将储备液使用色谱甲醇进行等倍稀释,稀释成6个浓度水平,做标准曲线,确定各成分的线性范围(如表1所示)。
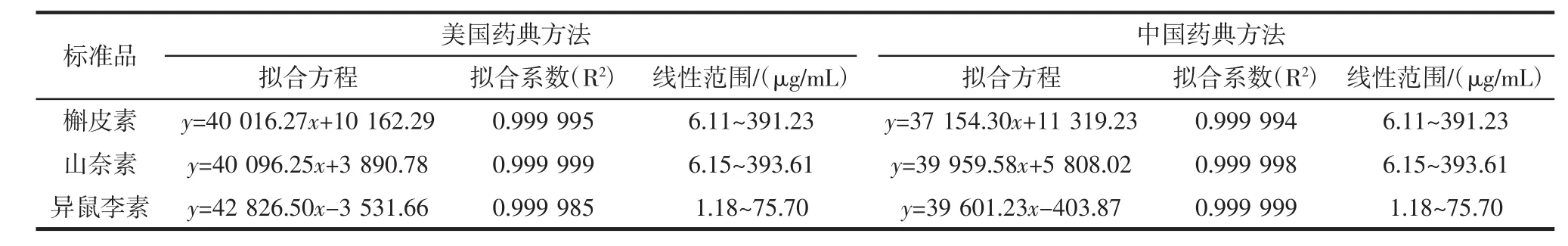
表1 3种成分在不同测定方法下的标准曲线及线性范围情况Table1 Thestandard curvesand the linear rangesof threecom ponentsin differentdeterm inationmethods
由表1中数据可知,中国药典和美国药典测定方法所得银杏黄铜中各成分的标准曲线均满足R2>0.999 9,因此3种成分在各自范围内均线性良好。两种测定方法下各成分的线性范围均为:槲皮素6.11μg/mL~391.23μg/mL,山奈素 6.15μg/mL~393.61μg/mL,异鼠李素1.18μg/mL~75.70μg/mL。按S/N=3确定各成分的检出限,分别为:槲皮素0.07μg/mL,山奈素0.06μg/mL,异鼠李素0.06μg/mL。
2.2.2 测定方法的回收率试验
吸取己知含量的槲皮素、山奈素和异鼠李素混标储备液分析方法的回收率试验,结果表明两种测定方法对3种成分的平均回收率分别是100.34%、96.17%和98.39%,说明该方法的回收率较好。
2.2.3 中国药典方法学验证
2.2.3.1 精密度验证
分别选取1批银杏叶提取物和1批银杏叶粉末,采用中国药典前处理方法,每天做3个平行样,连续检测3 d,以考察样品中各成分及总黄酮的日间精密度情况,如表2和表3所示。
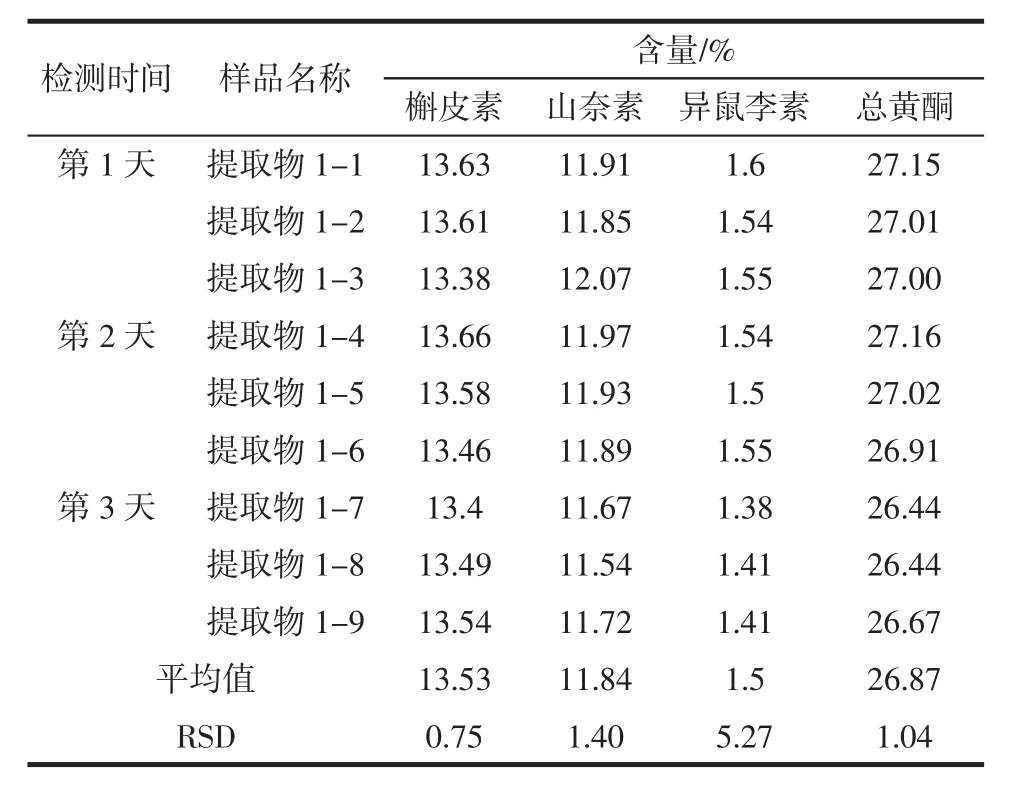
表2 银杏叶提取物中国药典方法检测精密度试验Table2 Thep recision testof EGB by CPm ethod
由表2和表3中数据可知,银杏叶提取物中槲皮素、山奈素、异鼠李素及总黄酮含量的RSD分别是0.75%、1.40%、5.27%和1.04%。银杏叶粉末槲皮素、山奈素、异鼠李素及总黄酮含量的RSD分别是1.83%、2.22%、3.97%、2.20%,说明银杏叶提取物和银杏叶原料中各成分及总黄酮含量的中国药典方法的日间稳定性较好,仪器检测的日间精密度较高。
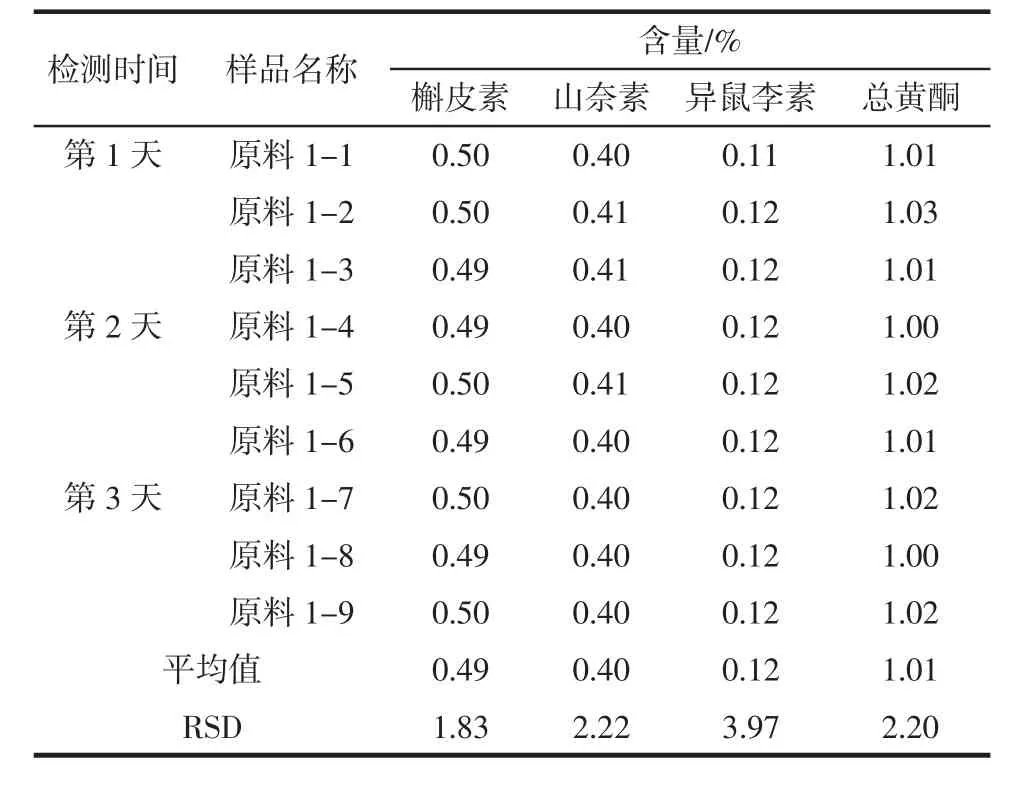
表3 银杏叶粉末中国药典方法检测精密度试验Table3 The precision testof ginkgo leavesby CPm ethod
2.2.3.2 不同酸解时间的验证
分别选取1批银杏叶提取物和1批银杏叶粉末,使用中国药典方法(温度 80 ℃)进行 10、20、30、60、90min酸解时间验证,如表4所示。

表4 样品中总黄酮含量随中国药典方法中酸解时间的变化情况Table4 The contentof total flavonoids in sam plesvaried with the hydrolysis tim eof CP
由表4中数据可知,银杏叶提取物和银杏叶粉末中总黄酮含量会随着酸解时间的延长呈先增大后稳定的趋势。酸解时间10min~30min时,银杏叶提取物和银杏叶粉末中总黄酮含量显著增大(P<0.05),分别从27.08%增大至27.55%和从0.93%增大至1.08%。样品量一定时,随着酸解时间的延长,样品的酸解程度会越来越大,所测得总黄酮的量增加。酸解时间30min~90min时,样品中总黄酮的量无显著性变化(P>0.05)。该结论与杜安全等[13]报道的银杏叶提取物中总黄酮的含量随水解时间的变化规律一致。综上,最佳的酸解时间为30min,即中国药典方法的酸解时间30min参数设置是准确的。
2.2.4 美国药典方法学验证
2.2.4.1 精密度验证
分别选取1批银杏叶提取物和1批银杏叶粉末,采用美国药典前处理方法,每天做3个平行样,连续检测3 d,以考察样品中各成分及总黄酮的日间精密度情况,如表5和表6所示。
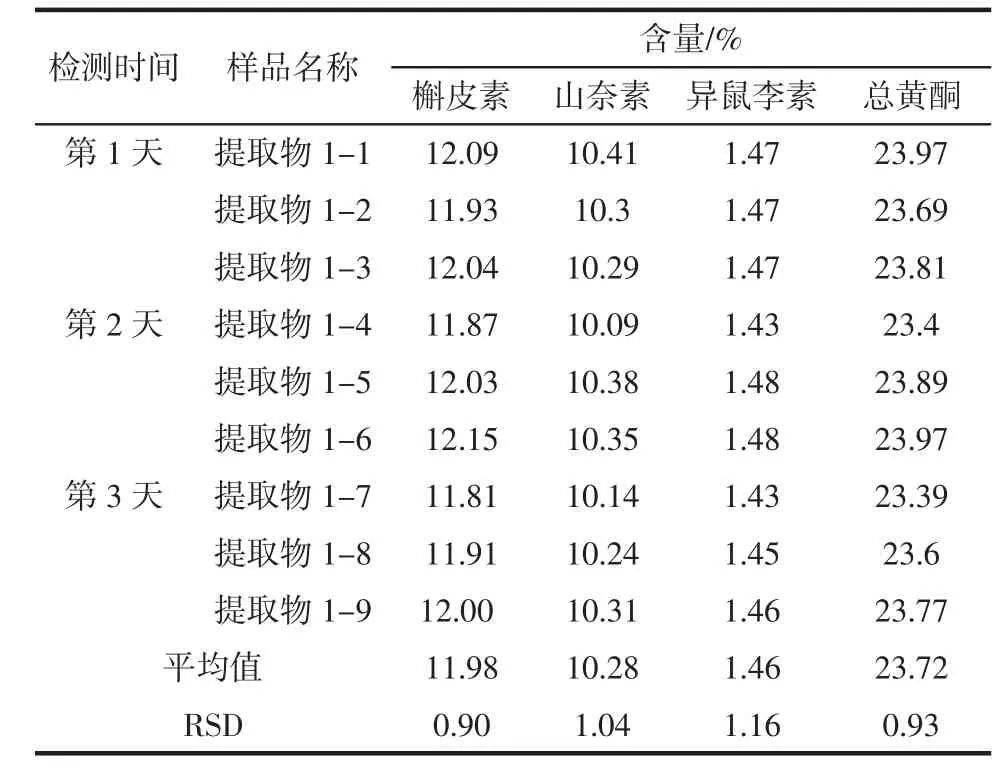
表5 银杏叶提取物美国药典方法检测精密度试验Table5 The precision testof EGB by USPmethod

表6 银杏叶粉末美国药典方法检测精密度试验Table6 The precision testof ginkgo leavesby USPm ethod
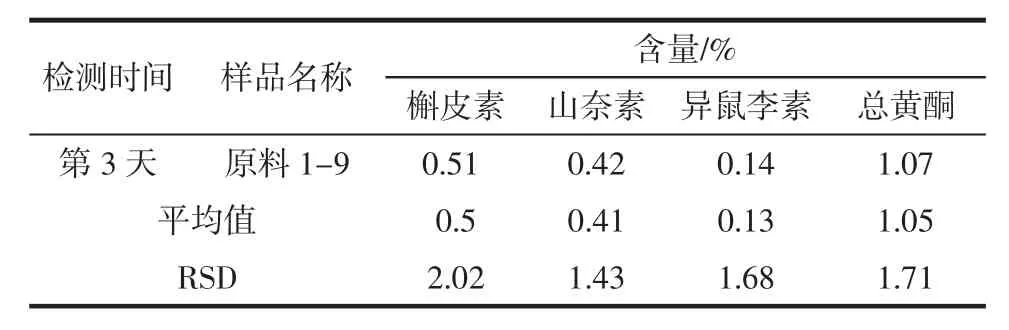
续表6 银杏叶粉末美国药典方法检测精密度试验Continue table6 Thep recision testof ginkgo leavesby USP m ethod
由表5和表6中数据可知,银杏叶提取物中槲皮素、山奈素、异鼠李素及总黄酮含量的RSD分别是0.90%、1.04%、1.16%和0.93%,银杏叶粉末中槲皮素、山奈素、异鼠李素及总黄酮含量的RSD分别是2.02%、1.43%、1.68%和1.71%,说明银杏叶提取物和银杏叶原料中各成分及总黄酮含量的美国药典方法的日间稳定性较好,仪器检测的日间精密度较高。
2.2.4.2 不同酸解时间的验证
分别选取1批银杏叶提取物和1批银杏叶粉末,使用美国药典方法(温度 85℃)进行 30、60、90、120、135、150min酸解时间验证,如表7所示。

表7 样品中总黄酮含量随美国药典方法中酸解时间的变化情况Table7 The contentof total flavonoids in samp lesvaried w ith the hydrolysis timeof USP
由表7中数据可知,银杏叶提取物和银杏叶粉末中总黄酮含量会随着酸解时间的延长呈先增大后稳定的趋势。银杏叶提取物的酸解时间为30min~60min时,银杏叶粉末的酸解时间为30min~90min时,银杏叶提取物和银杏叶粉末中总黄酮含量显著增大(P<0.05),分别从23.67%增大至24.36%和从0.87%增大至1.05%。与中国药典方法所得规律一致,即样品量一定时,随着酸解时间的延长,样品的酸解程度会越来越大,所测得总黄酮的量增加。银杏叶提取物的酸解时间为60min~150min时,银杏叶粉末的酸解时间为90min~150min时,样品中总黄酮的量无显著性变化(P>0.05)。综上,美国药典的酸解时间135min参数设置是准确的,但从检测效率考虑,最佳酸解时间为90min。
2.3 不同检测方法的对比
分别使用美国药典和中国药典检测方法对3批银杏叶提取物和3批银杏叶粉末进行检测,以考察两种检测方法的差异情况,如表8和表9所示。
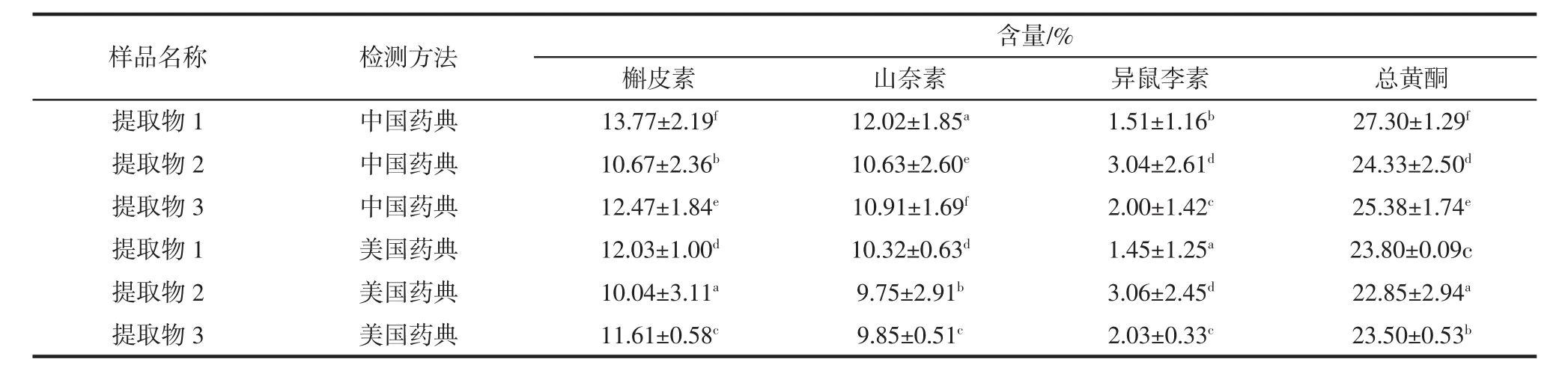
表8 不同检测方法下3批银杏叶提取物中各成分及总黄酮含量Table8 The contentsof each componentand total flavonoids in EGB under different detectionmethods
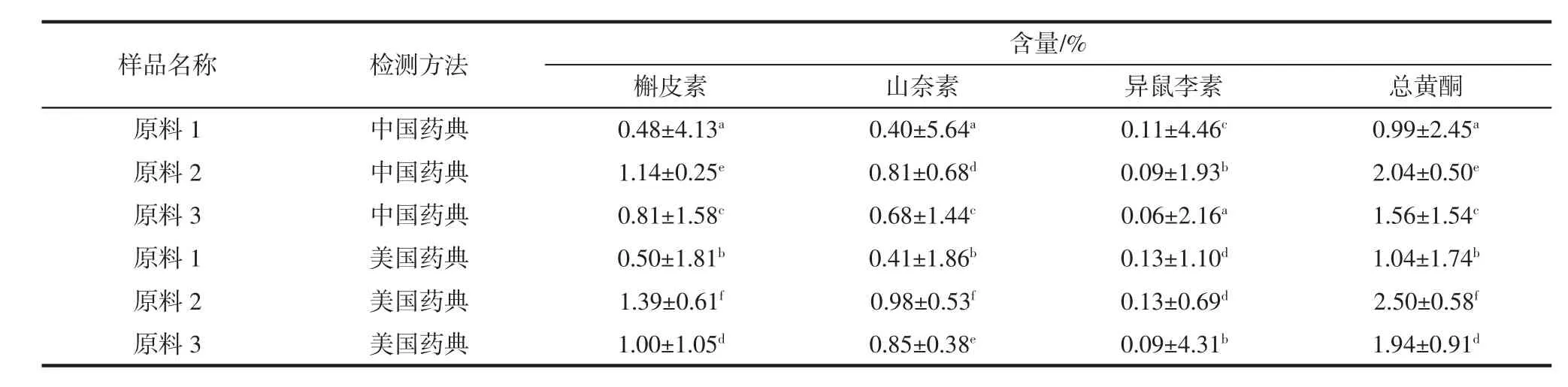
表9 不同检测方法下3批银杏叶粉末中各成分及总黄酮含量Table9 The contentsof each componentand total flavonoids in ginkgo leavesunder different detectionmethods
由表8和表9中数据可知,同一银杏叶提取物采用不同检测方法时,样品中各成分及其总黄酮含量间均存在显著性差异(P<0.05),且中国药典的检测值>美国药典的检测值。例如,提取物1使用中国药典和美国药典方法检测时,其各成分及总黄酮的含量分别为13.77%、1.85%、1.51%、27.30%和 12.03%、10.32%、1.45%、23.80%。同一原料采用不同检测方法时,样品中各成分及其总黄酮含量间均存在显著性差异(P<0.05),且美国药典的检测值>中国药典的检测值。例如,原料1使用中国药典和美国药典方法检测时,其各成分及总黄酮的含量分别为0.48%、0.40%、0.11%、0.99%和0.50%、0.41%、0.13%、1.04%。造成银杏提取物和原料中各成分及总黄酮含量使用不同方法检测结果出现差异性的原因可能是由于样品本身的性质和样品酸解的条件(包括酸解剂、酸解时间、酸解温度等)。
3 结论
本研究通过对HPLC检测色谱条件进行优化,建立了同时使用中国药典和美国药典方法测定银杏叶及其提取物中各成分、总黄酮含量的方法,可较为全面的评价不同测定方法下样品中黄酮类各成分的信息,能有效的减少工作量、指导生产。试验结果表明优化后色谱条件为双波长检测:370 nm和360 nm;流速:1.0mL/min;流动相:甲醇-0.4%磷酸水=2 ∶3;色谱柱:Eclipse Plus C18(4.6mm×100mm,3.5μm);进样量:10μL;柱温:40℃。对测定方法进行了系统的方法学验证,考察了测定方法的标准曲线、检出限和回收率,结果显示银杏黄酮中各成分在各自线性范围内均线性良好,各成分的检出限分别为槲皮素0.07μg/mL、山奈素0.06μg/mL、异鼠李素0.06μg/mL,平均回收率分别为槲皮素100.34%、山奈素96.17%、异鼠李素98.39%;研究了测定方法的精密度,可将银杏叶提取物和银杏叶原料中总黄酮含量的RSD分别控制在1.0%和2.2%水平以内;验证了测定方法酸解时间设定的准确性,并得出了最佳的酸解时间为中国药典30 min,美国药典90min。对两种测定方法进行对比,发现银杏叶提取物中总黄酮含量的检测值:中国药典>美国药典;银杏叶粉末中总黄酮含量的检测值:美国药典>中国药典。
参考文献:
[1]Beek T A,Montoro P.Chemical analysis and quality control of Ginkgobiloba leaves,extracts,and phytopharmaceuticals[J].Journal ofChromatography A,2009,1216(11):2002-2032
[2]Maitra I,Marcocci L,Droy-Lefaix M T,etal.Peroxyl radical scavenging activity of Ginkgo biloba extract EGb 761[J].Biochemical Pharmacology,1995,49(11):1649
[3]陈维洲,张培智.银杏叶提取物的药理和临床研究进展(下)[J].中国新药与临床杂志,1999,18(5):315-317
[4]Singh B,Kaur P,Gopichand,etal.Biology and chemistry of Ginkgo biloba[J].Fitoterapia,2008,79(6):401-418
[5]汪素娟,康安,狄留庆,等.银杏叶提取物主要活性成分药动学研究进展[J].中草药,2013,44(5):626-631
[6]熊冬梅,邓泽元,刘蓉,等.高效液相色谱法测定银杏保健品中总黄酮[J].食品科学,2009,30(22):256-259
[7]Mesbah M K,Khalifa SI,El-Gindy A,etal.HPLC determination of certain flavonoidsand terpene lactones in selected Ginkgo biloba L.phytopharmaceuticals[J]ILFarmaco,2005,60(6/7):583-590
[8]田紫平,喻微,何贵州,等.HPLC测定银杏叶中总银杏酸的含量[J].微量元素与健康研究,2015,32(2):36-37
[9]LiW,Fitzloff JF.HPLC determination of flavonoids and terpene lactones in commercial ginkgo biloba products[J].Journalof Liquid Chromatography&Related Technologies,2002,25(16):2501-2514[10]王靖,邹雨佳,唐华澄,等.高效液相色谱法(HPLC)测定银杏黄酮含量[J].食品工业科技,2006(3):184-185
[11]秦燕,何新英,庄慧娣,等.HPLC测定银杏提取物中主要黄酮和萜内酯含量的优化方法[J].上海交通大学学报(医学版),2003,23(3):234-236
[12]祝连彩,王伯初,刘火安,等.高效液相色谱法测定银杏叶提取物中黄酮含量[J].重庆大学学报(自然科学版),2006,29(1):117-119
[13]杜安全,王先荣,周正华,等.银杏叶总黄酮苷的HPLC法分析水解条件[J].安徽医药,2001,5(3):164-165
