结直肠癌组织间隙连接蛋白29表达变化及其与患者临床病理参数的关系
2018-05-15张永盟张姗姗袁明赵卫星鲍永华杨万才
张永盟,张姗姗,袁明,赵卫星,鲍永华,杨万才
(1 新乡医学院基础医学院,河南新乡453003;2 济宁医学院精准医学研究院)
细胞间隙连接是普遍存在于细胞间的膜通道结构,由相邻细胞膜上的两个连接子相互连接而成。每个连接子由6个相同的连接蛋白亚单位构成,每个亚单位即为细胞间隙连接蛋白(Cx)。Cx是一类同源四次跨膜结构蛋白家族,具有传递细胞信息、协调新陈代谢、控制细胞增殖和分化以及维持内环境稳定等多种生理功能[1];其功能在不同的器官或组织具有特异性。Cx29是Cx家族成员之一,我们通过对大数据统计分析发现,其可能与结直肠癌的发生、发展有一定相关性,但具体机制尚不清楚。本研究观察了结直肠癌组织Cx29表达变化,现分析其与患者临床病理参数的关系。
1 材料与方法
1.1 材料 选择济宁医学院精准医学研究院标本库收集的2012~2014年结直肠组织蜡块标本48例份,其中43例份包含结直肠癌组织、癌旁正常组织和转移淋巴结组织,5例份包含结直肠癌组织和癌旁正常组织。标本来源患者男22例、女26例,年龄39~85岁、中位年龄68岁,结肠癌22例、直肠癌26例;肿瘤形态:隆起型5例,溃疡型41例,浸润型2例;浸润深度:未浸透浆膜层20例,浸透浆膜层28例;组织分化程度:高中分化38例,低未分化10例;有淋巴结转移43例,无淋巴结转移5例。
1.2 Cx29表达检测
1.2.1 组织芯片构建 将48例份组织蜡块切成厚度为4 μm切片。切片经60 ℃烘箱烤片1 h,行HE染色。显微镜下标出每张切片对应的结直肠癌组织、癌旁正常组织或转移淋巴结组织,同时在蜡块上圈出其对应位置。将组织蜡块送武汉谷歌生物科技有限公司制成组织芯片蜡块,然后对其切片,再将切片转移至载玻片上制成组织芯片。为方便统计分析,将同一患者结直肠癌组织、癌旁正常组织或转移淋巴结组织依次标记位置。
1.2.2 免疫组化染色 采用SABC法。将上述制作的组织芯片于60 ℃烘箱中烤片1 h,经二甲苯和梯度乙醇脱蜡水化,蒸锅中加热0.01 mol枸橼酸钠缓冲液至95 ℃左右,放入组织芯片加热5 min进行抗原热修复,自然冷却至室温;PBS漂洗5 min×3次,滴加3%过氧化氢室温孵育30 min;PBS漂洗5 min×3次,山羊血清室温封闭30 min,加入兔抗人Cx29单克隆抗体(1∶100),4 ℃孵育过夜;取出保湿盒晾至室温,PBS漂洗5 min×3次,加入生物素标记的山羊抗兔二抗(1∶200)室温孵育60 min;PBS漂洗5 min×3次,加入SABC室温孵育60 min;PBS漂洗5 min×3次,DAB显色,苏木素复染,PBS返蓝,梯度乙醇脱水,二甲苯透明,中性树脂封固。免疫组化染色过程中癌旁正常组织6例份、转移淋巴结组织2例份丢失,共获取结直肠癌组织48例份、癌旁正常组织42例份、转移淋巴结组织41例份。
1.2.3 Cx29表达判定 Cx29阳性染色定位于细胞膜和细胞质,呈淡黄色、黄色或棕褐色。根据染色强度对Cx29表达进行判定:淡黄色为1分,低表达;黄色为2分,中表达;棕褐色为3分,高表达。
1.3 统计学方法 采用SPSS19.0统计软件。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌组织、癌旁正常组织和转移淋巴结组织Cx29表达比较 见表1。
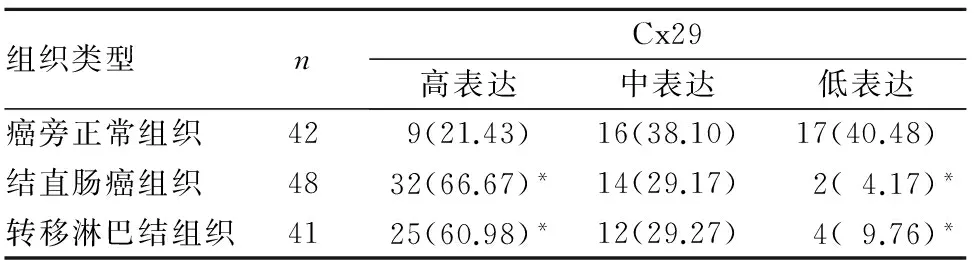
表1 不同组织类型Cx29表达比较[例(%)]
注:与癌旁正常组织比较,*P<0.05。
2.2 结直肠癌组织Cx29表达与患者临床病理参数的关系 见表2。
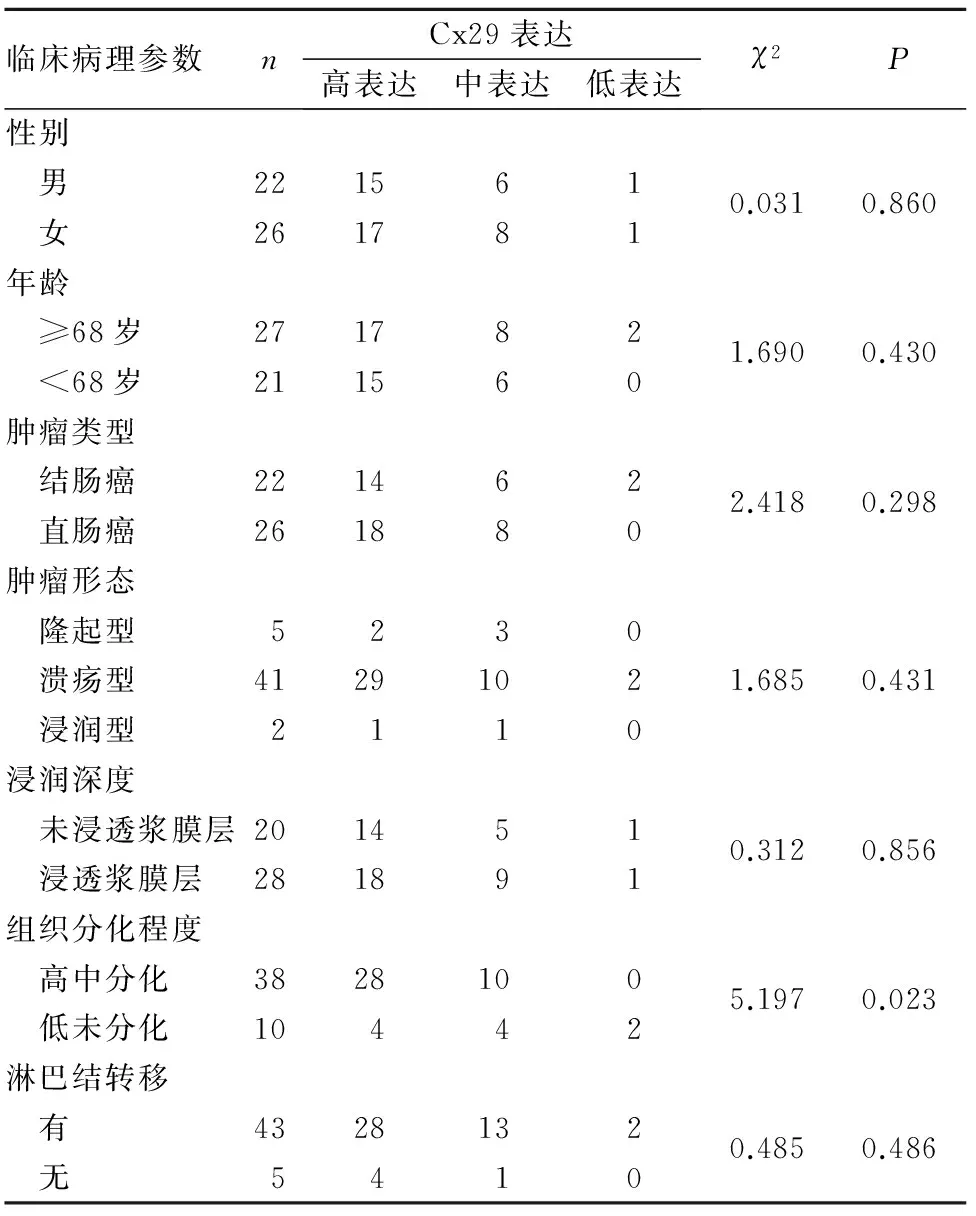
表2 结直肠癌组织Cx29表达与患者临床病理参数的关系
3 讨论
结直肠癌是最常见的、严重威胁人类健康的恶性肿瘤之一。据2015年中国癌症统计数据显示,我国结直肠癌的发病率和病死率均居所有恶性肿瘤的第五位[2]。随着经济的发展,人们生活方式以及饮食结构的改变,结直肠癌的发病率和病死率均有显著上升趋势。肿瘤形成是一个长期的过程,需要经历多个阶段,涉及多种基因。近年来通过人类基因组计划研究了解人类基因组后,能够从基因水平上认识疾病,继而从根本上治疗或预防人类疾病。故肿瘤发生、发展的分子机制及靶向治疗备受关注。为了提高结直肠癌患者的临床治疗效果和生存期,探寻特异的分子靶标指导临床决策就显得尤为重要。
Cx几乎存在于哺乳动物的所有组织和细胞中,现已知其家族中至少有21位成员,其基因序列具有高度同源性,通常以不同的组合方式或不同的组合存在于不同组织和细胞中[3]。有研究发现,6个多方形的Cx组成1个半通道,2个半通道相互对接形成1个亲水性孔道;而形成的半通道可以是相同的,也可以是不同的,2个半通道对接到一起,形成相同的通道(同质连接)或不同的通道(异质连接)[4]。这些通道能直接参与细胞内外信息传递,如细胞内代谢产物、第二信使以及电信号等[5]。目前已证实,在肿瘤和转化细胞中普遍存在细胞间隙连接功能缺陷和Cx表达异常。Cx在内质网膜上可聚集合成功能型六聚连接小体[6]。亚细胞分离研究和免疫定位研究表明,Cx通过高尔基体到达细胞膜[7~9]。除此之外,Cx在内质网合成,高尔基体加工修饰后进入细胞质中,经转运小体到达细胞膜[10]。目前关于Cx家族成员Cx26、Cx32、Cx43等与肿瘤的关系已有较深入研究[11]。Cx43在前列腺癌进展的不同时期作用不同,前列腺癌早期Cx43表达缺失可促进肿瘤进展,而在晚期骨转移过程中Cx43表达可增强肿瘤细胞的侵袭力和附着力,这种现象在体内外实验均得到验证[12]。在乳腺癌中同样发现Cx43表达可促进肿瘤细胞迁移[13]。而在肝细胞癌中Cx32可通过Snail介导的EMT信号通路来抑制肝癌细胞侵袭[14]。现已证实,Cx43与结直肠癌、乳腺癌及前列腺癌的发生、发展和患者预后有关[15~19]。Cx29定位于人类染色体7q22.1,由279个氨基酸组成,分子量为31.299 kD。有研究发现,Cx29基因突变可导致Cx在细胞质内质网中表达增高,从而促进非综合征型耳聋的发生[20]。亦有报道,Cx29蛋白并没有形成功能性间隙蛋白通道,而是增强HeLa细胞中能量释放[21]。但Cx29与肿瘤的关系,特别是与结直肠癌发生、发展的关系,国内外鲜见报道。
本研究结果发现,结直肠癌组织及转移淋巴结组织Cx29高表达明显高于癌旁正常组织,结直肠癌组织Cx29高表达与肿瘤组织分化程度有关,提示Cx29高表达可能促进结直肠癌的发生、发展。本研究同期分析了人类蛋白图谱数据库、美国癌症基因图谱TCGA中438例结直肠癌患者临床资料,其中Cx29低表达者138例、Cx29高表达者300例,在长达12年的随访中,Cx29高表达者生存时间明显短于Cx29低表达者,说明Cx29表达变化有可能作为结直肠癌患者预后判断的生物学标志物。但由于本研究未对患者进行随访观察,这个结论尚需进一步验证。
综上所述,结直肠癌组织Cx29高表达,其表达变化与肿瘤组织分化程度有关。但目前对Cx29的具体作用机制尚不清楚,今后还需要进一步深入研究。
参考文献:
[1] Spicer SS, Schulte BA. The fine structure of spiral ligament cells relates to ion return to the stria and varies with place-frequency[J]. Hear Res, 1996,100(1-2):80-100.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[3] Haefliger JA, Bruzzone R, Jenkins NA, et al. Four novel members of the connexin family of gap junction proteins. Molecular cloning, expression, and chromosome mapping[J]. J Biol Chem, 1992,267(3):2057-2064.
[4] Willecke K, Eiberger J, Degen J, et al. Structural and functional diversity of connexin genes in the mouse and human genome[J]. Biol Chem, 2002,383(5):725-737.
[5] Spicer SS, Schulte BA. Evidence for a medial K+recycling pathway from inner hair cells[J]. Hear Res, 1998,118(1-2):1-12.
[6] Falk MM, Buehler LK, Kumar NM, et al. Cell-free synthesis and assembly of connexins into functional gap junction membrane channels[J]. EMBO J, 1997,16(10):2703-2716.
[7] Musil LS, Goodenough DA. Biochemical analysis of connexin43 intracellular transport, phosphorylation, and assembly into gap junctional plaques[J]. J Cell Biol, 1991,115(5):1357-1374.
[8] Falk MM, Kumar NM, Gilula NB. Membrane insertion of gap junction connexins: polytopic channel forming membrane proteins[J]. J Cell Biol, 1994,127(2):343-355.
[9] Laird DW, Castillo M, Kasprzak L. Gap junction turnover, intracellular trafficking, and phosphorylation of connexin43 in brefeldin A-treated rat mammary tumor cells[J]. J Cell Biol, 1995,131(5):1193-1203.
[10] Naus CC, Laird DW. Implications and challenges of connexin connections to cancer[J]. Nat Rev Cancer, 2010,10(6):435-441.
[11] Radic' J, Krušlin B,amija M, et al. Connexin 43 expression in primary colorectal carcinomas in patients with stage Ⅲ and Ⅳ Disease[J]. Anticancer Res, 2016,36(5):2189-2196.
[12] Lamiche C, Clarhaut J, Strale PO, et al. The gap junction protein Cx43 is involved in the bone-targeted metastatic behaviour of human prostate cancer cells[J]. Clin Exp Metastasis, 2012,29(2):111-122.
[13] Tsai CF, Cheng YK, Lu DY, et al. Inhibition of estrogen receptor reduces connexin 43 expression in breast cancers[J]. Toxicol Appl Pharmacol, 2018(338):182-190.
[14] Yang Y, Zhang N, Zhu J, et al. Downregulated connexin32 promotes EMT through the Wnt/β-catenin pathway by targeting Snail expression in hepatocellular carcinoma[J]. Int J Oncol, 2017,50(6):1977-1988.
[15] Wang S, Zhang S, Zhao Z, et al. Connexin 43 enhances paclitaxel cytotoxicity in colorectal cancer cell lines[J]. Exp Ther Med, 2017,14(2):1212-1218.
[16] Wang Y, Zhang C, Zhang S, et al. Kanglaite sensitizes colorectal cancer cells to Taxol via NF-κΒ inhibition and connexin 43 upregulation[J]. Sci Rep, 2017,7(1):1280.
[17] Kańczuga-Koda L, Sulkowska M, Koda M, et al. Expression of connexin 43 in breast cancer in comparison with mammary dysplasia and the normal mammary gland[J]. Folia Morphol (Warsz), 2003,62(4):439-442.
[18] Xu N, Chen HJ, Chen SH, et al. Reduced Connexin 43 expression is associated with tumor malignant behaviors and biochemical recurrence-free survival of prostate cancer[J]. Oncotarget, 2016,7(41):67476-67484.
[19] Piwowarczyk K, Paw M, Ryszawy D, et al. Connexin43 high prostate cancer cells induce endothelial connexin43 up-regulation through the activation of intercellular ERK1/2-dependent signaling axis[J]. Eur J Cell Biol, 2017,96(4):337-346.
[20] Hong HM, Yang JJ, Su CC, et al. A novel mutation in the connexin 29 gene may contribute to nonsyndromic hearing loss[J]. Hum Genet, 2010,127(2):191-199.
[21] Liang WG, Su CC, Nian JH, et al. Human connexin30.2/31.3 (GJC3) does not form functional gap junction channels but causes enhanced ATP release in HeLa cells[J]. Cell Biochem Biophys, 2011,61(1):189-197.
