前列腺癌组织GLTSCR2蛋白表达变化及其临床意义
2018-05-15刘涛张璐张凡
刘涛,张璐,张凡
(江汉大学附属医院,武汉430015)
胶质瘤抑癌候选基因2(GLTSCR2)是一种抑癌基因,主要定位于细胞核,可通过p53依赖性信号通路抑制细胞增殖并对细胞周期进行调控[1~4]。研究发现,在胶质母细胞瘤、成神经细胞瘤和结肠癌等恶性肿瘤细胞中GLTSCR2低表达,其低表达与患者预后不良有关[5]。本研究探讨GLTSCR2在前列腺癌发生、发展中的作用。
1 资料与方法
1.1 临床资料 选择2011年7月~2012年7月江汉大学附属医院收治的前列腺癌患者45例。所有患者符合《前列腺癌诊断标准》[6],并经术后组织病
理检查明确诊断。排除标准:①既往行外科手术、化疗或放疗等抗肿瘤治疗;②有前列腺炎病史,术前1周发生急性尿潴留;③术前2周接受前列腺按摩或直肠指检,术前1个月接受前列腺穿刺。患者年龄(64.3±7.1)岁,Gleason评分(4.7±0.7)分,血清前列腺特异性抗原(PSA)水平(29.4±3.1)ng/mL,吸烟29例;TNM分期:Ⅰ、Ⅱ期25例,Ⅲ、Ⅳ期20例;组织分化程度:高中分化31例,低未分化14例;有淋巴结转移6例,无淋巴结转移39例。同期选择该院收治的前列腺增生患者40例,年龄(65.1±7.8)岁。所有患者经术后组织病理检查明确诊断。
排除标准:①慢性前列腺炎;②合并恶性肿瘤、全身严重感染;③术前2周接受前列腺按摩或直肠指检,术前1个月接受前列腺穿刺。本研究经江汉大学附属医院医学伦理委员会批准,患者或其家属知情同意。
1.2 前列腺组织GLTSCR2蛋白表达检测 采用免疫组化法。取手术切除的前列腺癌组织及其配对的癌旁正常组织以及手术切除的前列腺增生组织,液氮中保存。实验前取部分组织,石蜡包埋,4 μm厚连续切片。将切片置于60 ℃烤箱烤片2 h,二甲苯脱腊,梯度乙醇脱水;3% H2O2室温孵育15 min,消除内源性过氧化物酶活性;微波加热抗原修复;加入山羊血清封闭液室温孵育20 min,再加入GLTSCR2一抗4 ℃孵育过夜;次日PBS冲洗3次,加入生物素标记的羊抗小鼠IgM二抗,37 ℃孵育15 min;DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。GLTSCR2蛋白阳性染色主要定位于细胞质或细胞核,呈褐色或棕褐色颗粒。随机选择5个400倍视野,计数阳性细胞数。根据染色强度和阳性细胞所占比例综合判定GLTSCR2蛋白表达。染色强度:-为0分,+为1分,++为2分,+++为3分。阳性细胞所占比例:≤25%为1分,>25%~≤75%为2分,>75%为3分。二者乘积为0~9分,其中0~2分为低表达、3~9分为高表达。
1.3 随访 前列腺癌患者从术后开始,每3个月随访1次,随访方式包括门诊及住院复查、电话随访等,随访截至2017年3月31日。比较不同GLTSCR2蛋白表达者预后情况。
1.4 统计学方法 采用SPSS21.0统计软件。计数资料比较采用χ2检验或Fishers确切概率法。生存分析采用Kaplan-Meier法及Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同前列腺组织GLTSCR2蛋白表达比较 前列腺癌组织GLTSCR2蛋白低表达34例份(75.6%)、癌旁正常组织为23例份(51.1%)、前列腺增生组织为13例份(32.5%)。前列腺癌组织GLTSCR2蛋白低达率明显高于癌旁正常组织和前列腺增生组织(χ2分别为5.789、15.881,P均<0.05),而癌旁正常组织与前列腺增生组织比较差异无统计学意义(χ2=3.004,P>0.05)。
2.2 前列腺癌组织GLTSCR2蛋白表达与患者临床病理参数的关系 见表1。
2.3 前列腺癌组织不同GLTSCR2蛋白表达者生存时间比较 34例前列腺癌组织GLTSCR2蛋白低表达者平均生存时间为31.4个月,11例前列腺癌组织GLTSCR2蛋白高表达者平均生存时间为61.2个月。前列腺癌组织GLTSCR2蛋白低表达者平均生存时间明显短于GLTSCR2蛋白高表达者(χ2=5.081,P<0.05)。见图1。
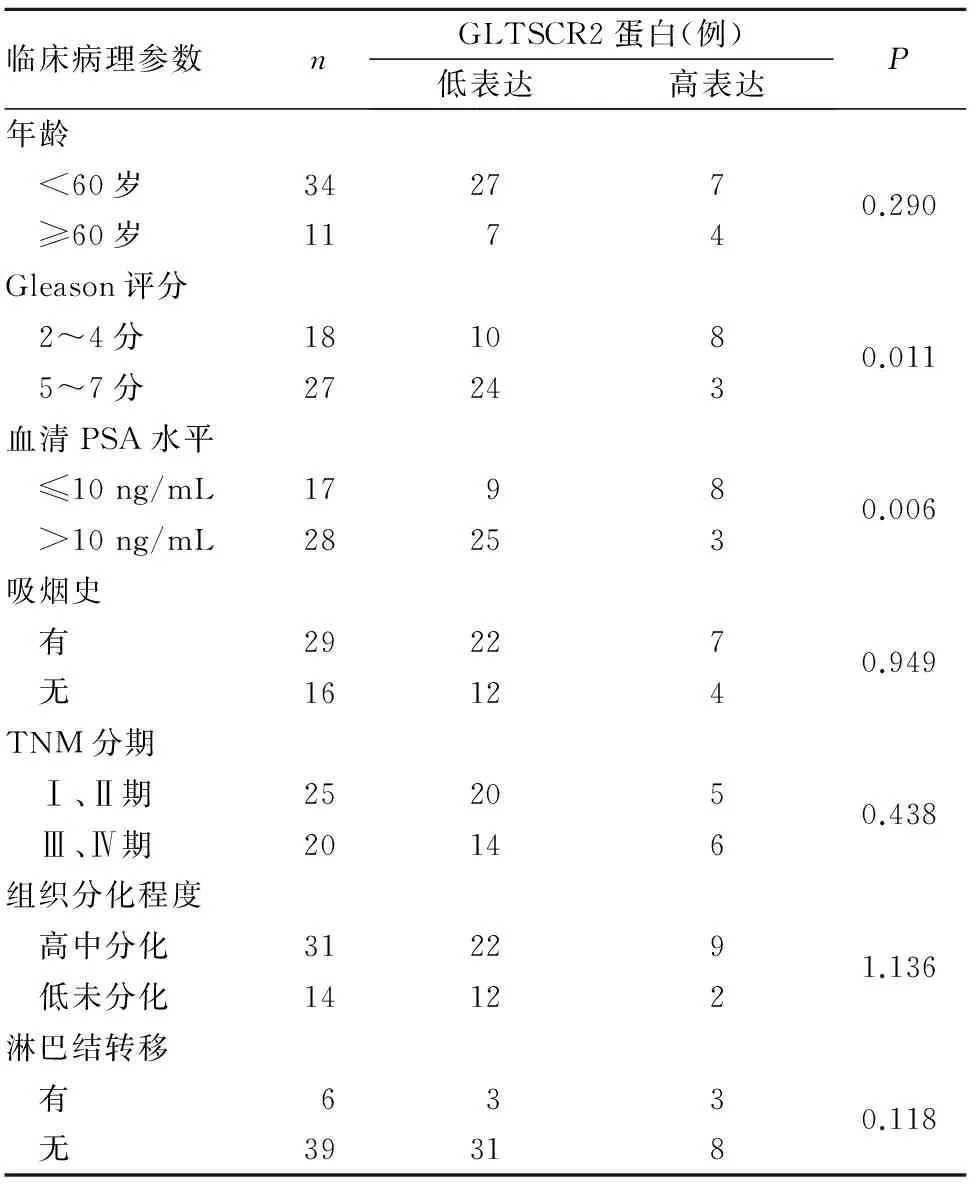
表1 前列腺癌组织GLTSCR2蛋白表达与患者临床病理参数的关系
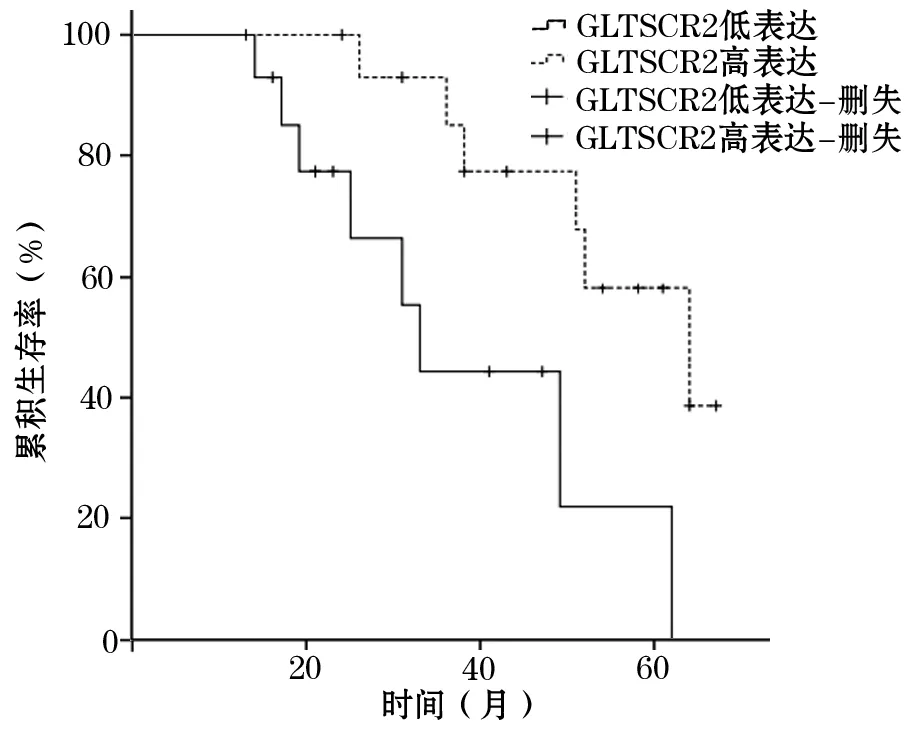
图1 前列腺癌组织不同GLTSCR2蛋白表达者生存曲线
3 讨论
PSA是前列腺癌较敏感的血清肿瘤标志物,可用于前列腺癌的早期筛查,但仍有部分患者确诊前就错过了根治性手术的最佳时机,只能采取药物或手术去势治疗。药物或手术去势治疗虽然可以明显延缓前列腺癌进展,但接近90%患者经过15~30个月的雄激素治疗后出现雄激素抵抗,引起前列腺癌复发[7]。因此,探讨前列腺癌的发病机制并进行干预,对改善患者预后具有重要意义。
GLTSCR2是最新发现的一种细胞核蛋白,可参与细胞增殖、分化、凋亡等多种生物学过程[8,9]。Lee等[10]研究发现,GLTSCR2可抑制细胞周期进展并诱导细胞凋亡,可能作为一种抑癌基因参与肿瘤的发生、发展。Kim等[11]研究发现,敲除小鼠GLTSCR2基因能促进结肠癌细胞增殖。Moon等[12]报道,GLTSCR2低表达与乳腺癌患者瘤体体积和预后不良密切相关。Kim等[13]研究证实,上调GLTSCR2表达可抑制脑胶质瘤细胞侵袭和迁移。但亦有报道认为,下调肺癌A549细胞GLTSCR2表达,可抑制MDM2介导的p53降解途径,并阻断细胞周期进展[14]。Zhang等[15]研究亦认为,在不同组织中GLTSCR2参与的信号通路不同,从而使GLTSCR2表现出抑癌和促癌双重作用。以上研究表明GLTSCR2可能具有组织特异性,对不同组织来源的肿瘤细胞具有不同的生物学功能。既往有研究报道,正常前列腺组织p53蛋白低表达,而前列腺癌组织p53蛋白过表达,其表达变化与肿瘤的侵袭和转移有关[16]。p53是GLTSCR2调控的重要靶基因,细胞质内GLTSCR2能够通过抑制MDM2介导的降解途径促进p53表达,进而参与调控细胞周期阻滞和细胞凋亡等生物学过程[17]。Kalt等[18]研究表明,GLTSCR2能够通过抑制肿瘤细胞代谢,阻断肿瘤的发生、发展。然而关于GLTSCR2在前列腺癌组织中的表达及其作用机制相关研究较少。
本研究结果发现,前列腺癌组织GLTSCR2蛋白低表达率明显高于癌旁正常组织和前列腺增生组织,而癌旁正常组织与前列腺增生组织比较差异无统计学意义,说明GLTSCR2蛋白在前列腺癌组织中可能具有抑癌基因作用。本研究还发现,GLTSCR2蛋白低表达与Gleason评分和血清PSA水平有关,提示GLTSCR2蛋白低表达可能参与前列腺癌的发生、发展过程。本研究前列腺癌组织GLTSCR2蛋白低表达者生存时间明显短于GLTSCR2蛋白高表达者,提示GLTSCR2蛋白表达变化可能有助于评估前列腺癌患者预后。
综上所述,GLTSCR2蛋白在前列腺癌的发生、发展过程中具有抑癌基因作用;前列腺癌组织GLTSCR2蛋白表达越低,患者预后越差。
参考文献:
[1] Vermassen T, Van Praet C, Vanderschaeghe D, et al. Capillary electrophoresis of urinary prostate glycoproteins assists in the diagnosis of prostate cancer[J]. Electrophoresis, 2014,35(7):1017-1024.
[2] 阚秀芳,赵丽晶,李倩,等.前列腺癌诊断模式与发病率的研究进展[J].中国老年学杂志,2013,33(23):6069-6071.
[3] 韩苏军,张思维,陈万青,等.中国前列腺癌发病现状和流行趋势分析[J].临床肿瘤学杂志,2013,18(4):330-334.
[4] Borodianskiy-Shteinberg T, Kalt I, Kipper S, et al. The nucleolar PICT-1/GLTSCR2 protein forms homo-oligomers[J]. J Mol Biol, 2014,426(12):2363-2378.
[5] Kim JY, Cho YE, Park JH. The nucleolar protein GLTSCR2 is an upstream negative regulator of the oncogenic nucleophosmin-MYC axis[J]. Am J Pathol, 2015,185(7):2061-2068.
[6] 王行环,刘同族.提高认识规范诊疗——《前列腺癌诊断标准》解读[J].中国卫生标准管理,2011,2(4):25-27.
[7] 曹达龙,叶定伟.去势抵抗性前列腺癌免疫治疗的研究进展[J].中华泌尿外科杂志,2017,38(10):798-800.
[8] Kim JY, Cho YE, Park JH, et al. Expression of GLTSCR2/Pict-1 in squamous cell carcinomas of the skin[J]. Arch Dermatol Res, 2013,305(9):797-804.
[9] Kim JY, Cho YE, Kim GY, et al. Down-regulation and aberrant cytoplasmic expression of GLTSCR2 in prostatic adenocarcinomas[J]. Cancer Lett, 2013,340(1):134-140.
[10] Lee S, Kim JY, Kim YJ, et al. Nucleolar protein GLTSCR2 stabilizes p53 in response to ribosomal stresses[J]. Cell Death Differ, 2012,19(10):1613-1622.
[11] Kim JY, Park JH, Lee S. GLTSCR2 contributes to the death resistance and invasiveness of hypoxia-selected cancer cells[J]. FEBS Lett, 2012,586(19):3435-3440.
[12] Moon A, Lim SJ, Jo YH, et al. Downregulation of GLTSCR2 expression is correlated with breast cancer progression[J]. Pathol Res Pract, 2013,209(11):700-704.
[13] Kim YJ, Cho YE, Kim YW, et al. Suppression of putative tumour suppressor gene GLTSCR2 expression in human glioblastomas[J]. J Pathol, 2008,216(2):218-224.
[14] Yim JH, Kim YJ, Ko JH, et al. The putative tumor suppressor gene GLTSCR2 induces PTEN-modulated cell death[J]. Cell Death Differ, 2007,14(11):1872-1879.
[15] Zhang J, Wang Q, Liu Y, et al. The expression of GLTSCR2 in cervical intra-epithelial lesion and cancer[J]. Arch Gynecol Obstet, 2015,291(2):413-418.
[16] 梁婷婷,王永坤,王尧,等.拓扑异构酶2α受抑癌基因p53的调控并调节前列腺癌细胞的增殖能力[J].中国实验诊断学,2017,21(7):1261-1264.
[17] 李道旺,王红群,王庆梅,等.p16及p53蛋白在前列腺癌中的表达及意义[J].山东医药,2014,54(17)43-45.
[18] Kalt I, Borodianskiy-Shteinberg T, Schachor A, et al. GLTSCR2/PICT-1, a putative tumor suppressor gene product, induces the nucleolar targeting of the Kaposi′s sarcoma-associated herpesvirus KS-Bcl-2 protein[J]. J Virol, 2010,84(6):2935-2945.
