瑞舒伐他汀对同型半胱氨酸诱导的小鼠血管平滑肌细胞去分化和内质网应激的影响及其机制研究*
2018-05-15周昌钻潘孙雷孟立平池菊芳郭航远
周昌钻,潘孙雷,林 辉,孟立平,季 政,池菊芳,郭航远△
(1.绍兴市人民医院心内科,浙江 绍兴312000;2.温州中西医结合医院,浙江 温州325000)
高同型半胱氨酸(homocysteine,Hcy)血症是动脉粥样硬化性冠心病的独立危险因素。但是,降Hcy治疗能否使患者在心脑血管疾病中获益在临床研究中仍未达成共识[1]。因此,Hcy在心血管疾病中可能具有更复杂的调控机制。研究发现,Hcy可诱导血管平滑肌细胞(vascular smooth muscle cells,VSMCs)发生表型去分化[2]。
血管平滑肌表型的去分化与心脑血管病密切相关。平滑肌与其他肌细胞相比,具有很强的表型重塑性。成熟分化的VSMCs呈长梭形,稳定表达包括表型蛋白(smooth muscle actin-α,α-SMA),钙调节蛋白calponin和smoothelin在内的收缩相关蛋白,细胞增殖与迁移能力极低,称为收缩型VSMCs。但收缩型VSMCs在异常刺激下可发生表型去分化,一方面细胞收缩蛋白表达减少,分泌蛋白如骨桥蛋白(osteopontin,OPN)表达增强,细胞骨架极性分布减弱;另一方面细胞增殖、迁移能力增强[3]。VSMCs收缩表型的丧失是冠心病、肺动脉高压、主动脉瘤等心血管疾病的重要病理变化[3,4]。
现研究发现,内质网应激(endoplasmic reticulum stress,ERS)可能在心血管疾病发病中发挥重要作用。ERS是细胞内环境受到干扰后,未折叠蛋白或错误折叠蛋白在内质网腔大量堆积,进而影响细胞功能的异常状态。高同型半胱氨酸血症、高脂血症、血管机械损伤等危险因素都可引起血管壁细胞ERS状态。此外,在巨噬细胞、内皮细胞及脂肪细胞中也都观察到ERS发挥着表型调控的作用[4]。但是ERS是否参与调控Hcy诱导的VSMCs去分化,仍未被人们了解。
临床中血管保护药物,如他汀类药物被发现存在药物作用的多效性[5,6]。但是,这类常用药物多效性是否与血管ERS状态相关,仍不十分明确。本研究旨在明确瑞舒伐他汀(rosuvastatin,Rsv)对 Hcy诱导的VSMCs表型去分化的影响并探讨ERS在其中的作用,进一步揭示ERS在他汀类药物的血管保护作用的机制,为血管重构性疾病的治疗提供新的理论依据。
1 材料与方法
1.1 实验材料
SPF级C57BL/6小鼠,雌雄不限,8周左右,体重22~25 g(购自上海斯莱克实验动物有限责任公司)。实验试剂:Hcy、血小板源生长因子-BB(platelet derived growth factor-BB,PDGF-BB)衣霉素、磷脂酸(sigma),Rsy(Medchem Express),4-苯基丁酸(杭州昊鑫生物有限公司),Ⅱ型胶原酶(Vetec),荧光染料 488Ⅰ-鬼笔环肽(Abnova),real-time PCR试剂盒(Roche),DMEM高糖培养基、胎牛血清、0.25%胰蛋白酶-EDTA(GIBCO),α-SMA、OPN、calponin、GAPDH单克隆抗体(Abcam),雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、phospho-mTOR(S2448)、P70S6激酶(P70S6 kinase,P70S6K)、phospho-P70S6K(T389)单克隆抗体(Cell Signaling Technology),辣根过氧化酶标记二抗(Abbkine),MTT(Emresco),Transwell小室(Corning)。
1.2 实验方法
1.2.1 VSMCs内质网应激诱导和分组 小鼠VSMCs细胞用II型胶原酶消化法获取,传代3~5代后无血清饥饿培养24 h。实验1:RSV对 Hcy诱导的VSMCs去分化和ERS状态的影响。细胞分为对照组、Hcy组(1 mmol/L)、PDGF-BB组(30 ng/ml)、Hcy+低 Rsv组(0.1μmol/L)、Hcy+中 Rsv组(1μmol/L)、Hcy+高 Rsv组(10μmol/L),每组设 3复孔,分别于培养后 30 min、1 h、2 h、6 h、12 h时用 realtime-PCR检测葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)、X盒结合蛋白 1(X-box binding protein 1,XBP1s),同型半胱氨酸诱导内质网应激泛素结构域1(Herpud 1),反映 ERS水平;48 h时检测细胞表型蛋白α-SMA表达和细胞骨架变化。实验2:ERS在Hcy诱导的VSMCs去分化中的作用。细胞分为对照组、Hcy(1 mmol/L)组、Hcy+Rsv(10μmol/L)组、Hcy+Rsv+衣霉素(tunicamycin,Tm,10μg/ml)组,Hcy+4-苯基丁酸(4-phenylbutyrate,4-PBA,5 mmol/L)组,每组设3复孔,检测细胞增殖、迁移和表型蛋白表达变化。实验3:mTOR信号通路对细胞ERS影响。细胞分为对照组、Hcy组、Hcy+Rsv组、Hcy+Rsv+磷脂酸(phosphatidic acid,PA,10μmol/L)组和 Hcy+雷帕霉素(rapamycin,Rapa,50 nmol/L)组,每组设 3复孔,干预30 min后检测mTOR-P70S6K信号磷酸化程度及ERS水平。
1.2.2 RNA提取检测 ERS指标 经典 Trizol-异丙醇沉淀法提取总 RNA,测定浓度纯度。Real-time PCR检测GRP78、XBP1s和Herpud1的mRNA表达水平。总RNA按逆转录试剂盒及real-time PCR试剂盒说明书进行操作,引物序列如表1所示。记录Ct值后按2-△△Ct法进行相对定量。
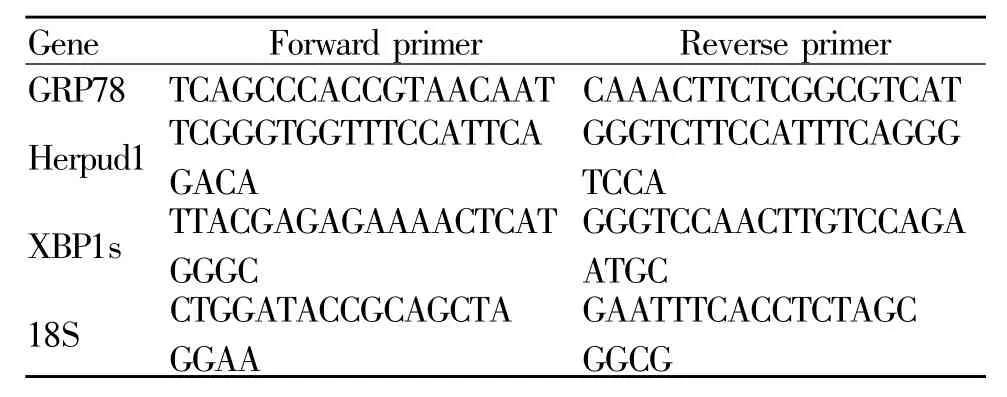
Tab.1Primer sequences used for real-time PCR
1.2.3 提取蛋白检测表型蛋白及信号通路改变
六孔板每孔加入200μl预冷RIPA裂解液冰上裂解细胞 30 min,12 000 r/min离心 10 min取上清,加入上清体积1/4体积的5×loading buffer,混匀后沸水浴5 min变性蛋白,置于-80℃环境冻存。配制SDS PAGE胶,每个泳道20μg蛋白样品上样。按实验设计分别检测样品中α-SMA、OPN、calponin、mTOR、pmTOR、P70S6K、p-P70S6K以及内参 GAPDH表达情况。
1.2.4 细胞增殖实验 分别收集3~5代 VSMCs,按上述分组以每孔2×103个细胞接种于96孔培养板中,每组设3个复孔。待细胞贴壁后,无血清培养基饥饿24 h后更换为每孔100μl条件培养基,分别培养 12 h、24 h、36 h、48 h后,按每孔加入 20μl MTT液(5 mg/ml)。避光孵育 4 h,小心弃上清,每孔加入200μl DMSO,震荡溶解结晶后,测量各孔579 nm波长下吸光值,独立使用重复3次。
1.2.5 细胞迁移实验 取 3~5代 VSMCs,培养基中加入羟基脲(1.8 mmol/L)抑制增殖,12 h后重悬浮 VSMCs(3×104cells/ml)。在 Transwell小室上腔室(0.8μm)中加入 200μl细胞悬液,下室加入完全培养基。2 h后待细胞贴壁,上室更换为无血清的条件培养基。24 h后多聚甲醛固定,棉签拭去上层细胞,0.1%结晶紫溶液染色,于倒置显微镜下随机取5个视野统计各视野细胞数目。
1.2.6 细胞骨架鬼笔环肽染色 取无菌盖玻片置于6孔板中,按每孔1 000个细胞接种细胞,待细胞贴壁后无血清饥饿24 h,无血清条件培养基干预48 h后,多聚甲醛固定,鬼笔环肽染液避光孵育2 h,PBS洗涤3次后,在荧光显微镜490 nm激发波长观察细胞微丝骨架结构和细胞形态。
1.3 统计学分析
实验数据以均数±标准差(±s)表示,两组数据间比较采用t检验,多组数据间比较用单因素方差分析,多组数据间两两比较用 Student-Newman-Keuls检验,并用SPSS 19.0统计软件分析结果。
2 结果
2.1 瑞舒伐他汀对VSMCs微丝骨架分布影响
对照组细胞微丝骨架极性明显,细胞呈长条形或长梭形;Hcy组及PDGF-BB组细胞呈短梭形或椭圆形,微丝分布紊乱;添加瑞舒伐他汀可增强细胞微丝骨架分布的极性,恢复细胞长梭形外形,该作用随他汀浓度增加而增强(图1)。

Fig.1 Effects of rosuvastatin on location and changes inform of actin cytoskeleton were detected with phalloidin(×400)
2.2 瑞舒伐他汀对Hcy诱导的VSMCs表型去分化的影响
Western实验显示,Hcy组较对照组,α-SMA、calponin表达下调,OPN表达上调(P<0.01);添加瑞舒伐他汀可增强Hcy组α-SMA、calponin表达,抑制OPN表达,且作用随他汀浓度的提高而增强(P<0.05,P<0.01,图 2)。结果显示 RSV干预可抑制Hcy诱导的VSMCs去分化,维持细胞收缩表型。

Fig.2 Effects of Hcy and rosuvastatin on VSMCs phenotype markers expression(n=3)
2.3 瑞舒伐他汀对Hcy诱导的ERS的影响
药物干预 30 min时,与对照组相比 Hcy组GRP78、Herpud1和XBP1s mRNA水平升高且差异有统计学意义;10μmol/L Rsv+Hcy组较 Hcy组 GRP78和 XBP1s mRNA水平降低(1.400±0.236 vs 2.562±0.340,1.045±0.137 vs 5.923±0.939,P<0.05),Herpud1 mRNA水平降低(1.385±0.101 vs 5.923±0.755,P<0.01),且 Rsv对 ERS的抑制作用随浓度升高和时间延长而增强(图3)。

Fig.3 Effects of rosuvastatin on Hcy mediated(±s,n=3)
2.4 ERS对VSMCs表型去分化的影响
Transwell实验中,Hcy组较对照组穿透纤维膜的迁移细胞数量明显增加;Hcy+Rsv组和Hcy+4-PBA组较Hcy组,细胞迁移数量减少(分别为56.7±9.4 vs 72.4±16.8,48.3±6.5 vs 72.4±16.8);Hcy+Rsv+Tm组细胞迁移数高于Hcy+Rsv组(96.1±18.3 vs 56.7±9.4,图 4A)。MTT实验发现 Hcy+Rsv组和Hcy+4-PBA组细胞活性低于Hcy组,Hcy+Rsv+Tm组细胞活性高于 Hcy+Rsv组(图4B)。Western blot发现4-PBA可抑制 Hcy诱导的VSMCs表型蛋白去分化改变,而Hcy+Rsv+Tm组较Hcy+Rsv组表型蛋白去分化程度高(图4C、D)。
2.5 mTOR信号通路对ERS的调节作用
Hcy组较对照组mTOR、P70S6K磷酸水平明显增强;Hcy+Rsv组和Hcy+Rapa组mTOR和P70S6K磷酸化较Hcy组受到抑制(图5A、B),且ERS水平减轻(图5C);Hcy+Rsv+PA组较 Hcy+Rsv组 mTORP70S6K磷酸化信号增强,ERS水平升高(P<0.05,P<0.01)。
3 讨论
VSMCs细胞表型的去分化发生在动脉粥样硬化、高血压、主动脉瘤等心血管疾病的病理生理过程中。VSMCs的去分化并没有特异性的指标,因此对VSMCs去分化的鉴定常需从细胞形态观察、表型蛋白表达以及细胞增殖、迁移能力等多个方面的共同确认。尽管,VSMCs可向多种细胞表型转化,比如巨噬细胞样表型、软骨细胞样表型、泡沫细胞表型等,但 VMSCs的去分化是其中的共同过程[7,8]。

Fig.4 Role of ERSin VSMCs phenotype switch(±s,n=3)

Fig.5 mTOR-P70S6K signaling in ERSmodulation(n=3)
高Hcy血症是动脉粥样硬化的独立危险因素,可诱导血管壁中的内皮细胞和平滑肌细胞发生炎症反应和氧化应激,进而引起细胞凋亡或死亡。现研究发现,Hcy在引起血管壁细胞炎症反应,促进凋亡的同时,也会诱导细胞ERS的发生和VSMCs收缩表型的丧失[2,9]。但 ERS在其诱导 VSMCs去分化中的作用,还未被人们完全了解。Hcy介导 mTORP70S6K信号激活,可能导致内质网腔中“流入”的新生多肽急剧增加,加重了内质网的多肽折叠功能负荷,进一步造成内质网腔内环境紊乱。此外,高浓度Hcy还会引起基因组广泛的甲基化,这也可能是导致细胞蛋白代谢紊乱的重要机制[10]。
ERS在哺乳动物的胚胎发育和生长中扮演着重要的角色。通过人工药物干预减轻胚胎的ERS水平,可导致胚胎的发育成熟速度加快;反之,在哺乳动物孕期给予ERS诱导剂刺激,则会引起胚胎发育迟滞,早产甚至流产[11,12]。此外,糖尿病相关研究中观察到,ERS下游信号的紊乱可导致胰岛β细胞的胰岛素释放功能受损[13]。以上证据都提示ERS及其下游信号在组织发育及功能维持中的关键作用。
研究学者在动脉粥样硬化、高血压、主动脉瘤及心肌病中均观察到血管或心肌的异常ERS状态[14]。ERS除了能引起细胞凋亡,导致组织中细胞丧失外,细胞功能表型的改变也可能是其在心血管疾病中的另一项重要致病机制。研究者通过tunicamycin等ERS诱导药物干预实验动物后,发现血管的ERS可能引起血管顺应性降低,整体血压升高以及内皮细胞功能紊乱等血管异常状态[15]。Carlisle等在动物实验中观察到,4-PBA干预可显著减轻血管的病理性肥厚[16]。本研究进一步发现,Hcy诱导的VSMCs表型的去分化作用以及瑞舒伐他汀的表型保护作用可能与细胞ERS相关。瑞舒伐他汀浓度依赖性的抑制 Hcy诱导的 ERS。进而用 ERS诱导剂 tunicamycin增强ERS水平后,Rsv的表型保护作用被显著抑制;反之,同时用Hcy和4-PBA干预细胞,VSMCs仍能维持较强的收缩表型,提示VSMCs收缩表型受到ERS水平调控。
ERS对VSMCs细胞表型的调控可能与ERS下游的激活信号相关。研究发现,XBP1s可与细胞表型的重要调控因子Kruppel like factor 4和间质转化因子Snail1的基因启动子结合,影响相关因子的表达[17,18]。Shinozaki S团队发现,敲除 ERS激活的下游蛋白Herpud1能显著减轻高脂小鼠动脉斑块的面积,增强斑块稳定性[19]。以上研究都提示ERS下游信号在血管壁细胞表型调控中的潜在作用机制。本研究发现,常用的血管保护药物-他汀类药物,有一部分非降脂依赖的保护作用可能是通过调控血管壁细胞的ERS状态,维持VSMCs收缩表型实现的。
本研究提示,瑞舒伐他汀可能通过抑制mTORP70S6K信号通路磷酸化,减轻细胞ERS状态,进而抑制Hcy诱导的VSMCs表型去分化。通过抑制血管组织的ERS状态或阻断ERS下游的特异性信号通路,保护细胞功能表型,可能是对动脉粥样硬化、高Hcy型高血压等发生细胞表型转化的血管重构疾病的潜在治疗策略。
【参考文献】
[1] Study of the Effectiveness of Additional Reductions in cholesterol and Homocysteine Collaborative Group,Armitage JM,Bowman L,et al.Effects of homocysteine-lowering with folic acid plus vitamin B12 vs placebo on mortality and major morbidity in myocardial infarction survivors:a randomized trial[J].Jama,2010,303(24):2486-2494.
[2] 李 刚,孟立平,周昌钻,等.同型半胱氨酸对大鼠主动脉血管平滑肌细胞表型转化的影响[J].温州医科大学学报,2016,46(1):33-38.
[3] Bennett MR,Sinha S,Owens GK.Vascular smooth muscle cells in atherosclerosis[J].Circ Res,2016,118(4):692-702.
[4] Oh J,Riek AE,Weng S,et al.Endoplasmic reticulum stress controls M2 macrophage differentiation and foam cell formation[J].JBiol Chem,2012,287(15):11629-11641.
[5] 武宇洲,崔 炜,李淑琴,等.普伐他汀对心脏成纤维细胞转化生长因子-β1合成的影响[J].中国应用生理学杂志,2010,26(2):141-143.
[6] Longo M,Spinelli R,D’Esposito V,et al.Pathologic endoplasmic reticulum stress induced by glucotoxic insults inhibits adipocyte differentiation and induces an inflammatory phenotype[J].Biochim Biophysi Acta,2016,1863(6PtA):1146-1156.
[7] Liu T,Lin J,Ju T,et al.Vascular smooth muscle cell differentiation to an osteogenic phenotype involves matrix metalloproteinase-2 modulation by homocysteine[J].Mol Cell Biochem,2015,406(1-2):139-149.
[8] Beazley KE,Nurminsky D,Lima F,et al.Wnt16 attenuates TGFbeta-induced chondrogenic transformation in vascular smooth muscle[J].Arterioscler Thromb Vasc Biol,2015,35(3):573-579.
[9] Zhang Z,Zhao L,Zhou Y,et al.Taurine ameliorated homocysteine-induced H9C2 cardiomyocyte apoptosis by modulating endoplasmic reticulum stress[J].Apoptosis,2017,22(5):647-661.
[10] Mandaviya PR,Stolk L,Heil SG.Homocysteine and DNA methylation:a review of animal and human literature[J].Mol Genet Metab,2014,113(4):243-252.
[11]Yoon SB,Choi SA,Sim BW,et al.Developmental compe-tence of bovine early embryos depends on the coupled response between oxidative and endoplasmic reticulum stress[J].Biol Reprod,2014,90(5):104.
[12]Zhang JY,Diao YF,Oqani RK,et al.Effect of endoplasmic reticulum stress on porcine oocyte maturation and parthenogenetic embryonic development in vitro[J].Biol Reprod,2012,86(4):128.
[13]Engin F.ER stress and development of type 1 diabetes[J].J Investig Med,2016,64(1):2-6.
[14]范小芳,李文娟,陈兆琴,等.慢性低氧性肺动脉高压大鼠肺组织内质网应激介导的凋亡的变化[J].中国应用生理学杂志,2011,27(3):270-274.
[15] Spitler KM,Webb RC.Endoplasmic reticulum stress contributes to aortic stiffening via proapoptotic and fibrotic signaling mechanisms[J].Hypertension,2014,63(3):e40-45.
[16]Carlisle RE,Werner KE,Yum V,et al.Endoplasmic reticulum stress inhibition reduces hypertension through the preservation of resistance blood vessel structure and function[J].J Hypertens,2016,34(8):1556-1569.
[17]Li H,Chen X,Gao Y,et al.XBP1 induces snail expression to promote epithelial-to-mesenchymal transition and invasion of breast cancer cells[J].Cell Signal,2015,27(1):82-89.
[18]Sugiura K,Muro Y,Futamura K,et al.The unfolded protein response is activated in differentiating epidermal keratinocytes[J].J Invest Dermatol,2009,129(9):2126-2135.
[19] Shinozaki S,Chiba T,Kokame K,et al.A deficiency of Herp,an endoplasmic reticulum stress protein,suppresses atherosclerosis in ApoE knockout mice by attenuating inflammatory responses[J].PloSOne,2013,8(10):e75249.
