CD4+、CD8+T淋巴细胞表达对术后辅助放疗的非小细胞肺癌患者的预后意义
2018-05-11胡静郑璐张欢乐张三典陆妙珍徐国栋李旎叶爽
胡静 郑璐 张欢乐 张三典 陆妙珍 徐国栋 李旎 叶爽
2015年统计数据显示肺癌仍是中国发病率和死亡率居于首位的恶性肿瘤[1]。虽然近年来基础研究和临床治疗技术突飞猛进,但是肺癌死亡率仍居高不下,2015年因肺癌死亡的患者高达70万。免疫治疗是目前兴起的一种治疗肺癌的手段[2],寻求合适的治疗靶点和免疫标志物成为研究的热点[3]。传统理论一直认为放疗是通过损伤肿瘤的脱氧核糖核酸达到治疗肿瘤的作用。然而近期研究表明,放疗可以通过影响特定的免疫调节机制来发挥抗肿瘤效应[4]。尤其是当与免疫治疗联用时,可以提高免疫治疗的疗效[5]。Hald等[6]报道CD4+和CD8+共表达是可切除的、术后行辅助放疗的肺癌患者的独立预后指标。鉴于放疗与肿瘤特异性免疫反应的潜在关联,本文旨在探讨CD4+、CD8+T淋巴细胞表达对术后行辅助放疗的非小细胞肺癌(non small cell lung cancer,NSCLC)患者的预后意义。
1 资料和方法
1.1 一般资料 收集本院2011年3月至2014年3月行手术切除且术后放疗的NSCLC患者385例。纳入标准:年龄在18岁及以上;经手术切除后的标本病理证实为NSCLC;近期未接受任何激素或免疫抑制剂治疗;5年内无第二原发肿瘤;有术后放疗指征(切缘阳性或pN2患者),放疗期间未行同步化疗或靶向治疗。最终符合标准46例,其中男 30例,女16例,年龄 44~74(54±6)岁;鳞癌16例,腺癌30例;按美国癌症联合委员会(American joint committee on cancer,AJCC)分期(第7版)标准:ⅡA期5例,ⅡB期7例,ⅢA期34例。
1.2 方法
1.2.1 放疗方法 采用德国西门子公司生产的Primus.h直线加速器实施放疗,采用累及野,予6MV或10MV X线照射。部分患者采用普通放疗,对原发灶、同侧肺门及纵隔进行垂直照射,每次200cGy,每周5次,当剂量达到40Gy/20f后缩野,调整照射野角度避开脊髓至治疗剂量。部分患者采用调强放射技术(Intensity modulated radiation therapy,IMRT),勾画瘤床及相应转移淋巴结引流区为临床靶区(CTV),CTV外扩0.5~1cm为计划靶区(PTV)。对于周围正常器官如食管、正常肺组织、心脏、脊髓等给予限量,放疗剂量为50~66Gy,2Gy/次,1 次/d,每周 5次,共 6~7周。
1.2.2 标本采集 每例病例分别选用1份含有肿瘤细胞的蜡块和肿瘤边缘的间质组织蜡块制作标本,采用距离原发肺肿瘤3cm的正常肺组织做成的蜡块作为对照,由2位病理医生确认入选。
1.2.3 免疫组化及量化分析 兔抗人CD4(BM4379,0.2ml)、CD8(BM4263,0.2ml)免疫组化单克隆抗体(工作浓度 1∶50)、二抗(BA1011,0.1ml)、即用型 SABC-AP试剂盒(SA1054)均购于武汉博士德生物工程有限公司。免疫组化流程及具体方法按照试剂盒所提供的操作执行。免疫组化结果的量化通过光学显微镜(Olympus,BX53)分析特定免疫细胞被染色浸润的程度来计算。CD8+T淋巴细胞的量化标准:(1)肿瘤组织:上皮细胞浸润>5%的为高表达,浸润≤5%为低表达,细胞未染色为无表达;(2)间质组织:细胞核表面浸润>50%的为高表达,核表面浸润≤50%为低表达,核未染色为无表达。CD4+T淋巴细胞的量化标准:(1)肿瘤组织:上皮细胞浸润≥5%的为高表达,浸润<5%为低表达,细胞未染色为无表达;(2)间质组织:细胞核表面浸润≥25%的为高表达,核表面浸润<25%为低表达,核未染色为无表达。
1.2.4 随访 随访起始时间为放疗开始时,截止时间为2017年5月。记录患者总生存时间(放疗结束至死亡或随访截止的时间)。
1.3 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,两组间比较采用两独立样本t检验,多组间比较采用方差分析;计数资料以百分率表示,组间比较采用χ2检验;采用Kaplan-Meier法分析单因素与生存率之间的关系,并绘制生存曲线。同时采用Log-rank法检测各生存曲线的差异。多因素分析采用Cox回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 患者的临床特征与生存率的关系 46例患者的中位生存时间为(24±6)个月,3年生存率为45.65%。患者的临床特征与生存率的关系见表1。

表1 患者的临床特征与生存率的关系
由表1可见,患者的年龄、组织学分化程度以及淋巴结分期与生存时间均有关(均P<0.05),当年龄≤65岁,分化程度越高,淋巴结分期越晚,患者的生存时间越长。而性别、吸烟、体重变化、病理类型均与生存时间无关(均P>0.05)。
2.2 患者的临床特征与T淋巴细胞浸润程度的关系见表2。

表2 患者的临床特征与T淋巴细胞浸润程度的关系
由表2可见,肿瘤组织中CD4+及CD8+T淋巴细胞浸润程度与患者年龄、性别、病理类型、组织学分化程度及淋巴结分期等临床病理因素均无关(均P>0.05)。
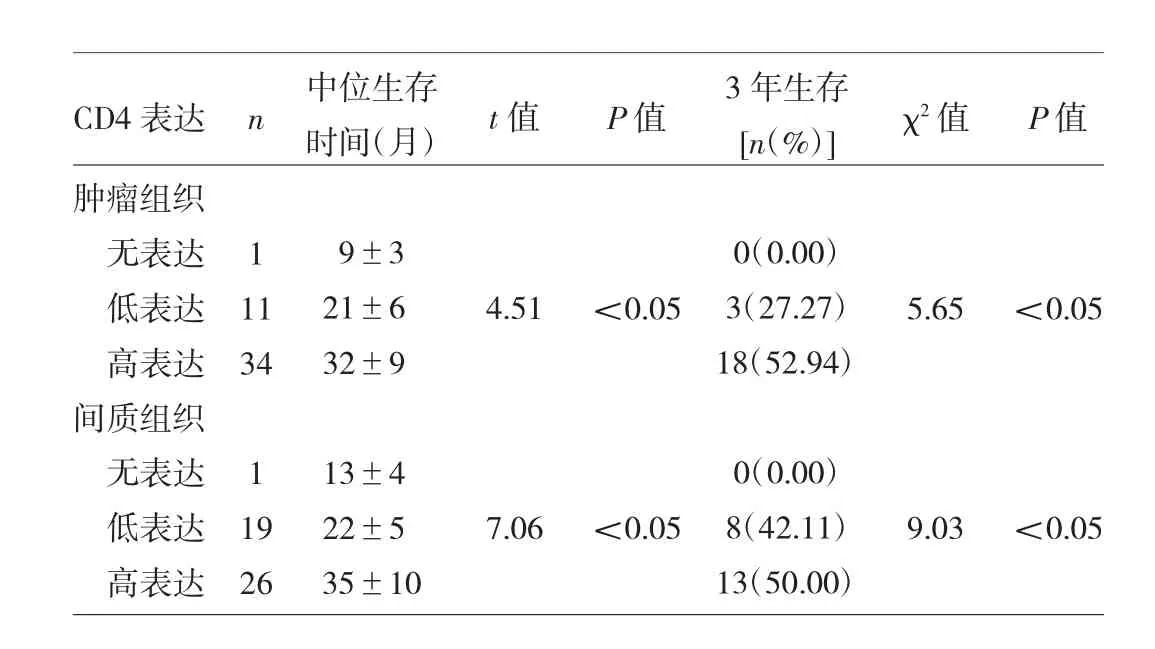
表3 CD4表达与生存率的关系
由表3~4可见,肿瘤组织及间质组织高表达CD4者、间质组织高表达CD8者3年总生存率均明显高于低表达者(均P<0.05)。图1生存曲线显示,对于接受术后放疗的NSCLC患者,肿瘤组织中高表达CD4者生存期最长。肿瘤及间质组织CD4和CD8的免疫组化染色图片见图2(插页)。

表4 CD8表达与生存率的关系

图1 肿瘤及间质组织中不同CD4/CD8表达的NSCLC患者的生存曲线
2.4 患者3年总生存率与临床特征的多因素分析 见表5。

表5 患者3年总生存率与临床特征的多因素分析
由表5可见,肿瘤组织CD4高表达者的HR为0.048(95%CI:0.008~0.263,P<0.01),而 CD8 高表达和CD4/CD8比值高表达的HR分别为1.800和1.500(均P>0.05)。肿瘤组织高表达CD4是NSCLC患者3年总生存率的独立预测因子。
3 讨论
NSCLC占所有肺癌患者80%以上,30~40%的患者就诊时已为局部晚期,单一的治疗手段难以提高疗效。早期患者通过手术切除可以获得长期生存,而局部中晚期的患者即使达到了手术完全切除,预后仍然不佳[7-8]。因此,局部晚期NSCLC的综合治疗一直是临床研究的热点。
对于可切除的局部晚期NSCLC,局部复发和远处转移仍是其主要失败原因,手术切除和术后辅助性化疗是常用的治疗方法。对于术后放疗的价值,多个国内外研究均证实放疗使局部晚期NSCLC完整切除术后患者的局部控制率和生存率获益[9-10]。Wang等[11]进行的一项大样本量回顾性研究中,共入组3 395例行不完全切除术的肺癌患者,分为术后放疗组和未行术后放疗组,前者1 207例,后者2 188例。结果显示,术后行辅助性放疗者中位生存期、5年总生存率分别为33.5个月、32.4%,好于未接受放疗者分别为23.7个月、23.7%,差异均有统计学意义,且术后放疗者的死亡风险比未放疗者下降了20%。该研究证实术后辅助性放疗能提高Ⅱ~Ⅲ期N0~2手术不完全切除肺癌患者的总生存率。
本研究显示,术后放疗患者高表达CD4+T淋巴细胞的中位生存期为32个月,3年生存率近40%。高表达CD4+T淋巴细胞的肺癌患者,其3年生存率更高,反之则更低。对于手术切除未行放疗的NSCLC患者,Jackute等[12]发现肿瘤组织浸润CD4+、CD8+T淋巴细胞与总生存和无进展生存均无关联,而肿瘤间质组织高浸润Foxp3+CD4+T淋巴细胞是改善NSCLC患者预后的独立指标。Kinoshita等[13]也发现非腺肺癌中CD8+T淋巴细胞低表达,腺癌吸烟患者中高Foxp3/CD4比值对于可切除的NSCLC患者是不良预后因素。因此,肿瘤组织高表达CD4+T淋巴细胞对于可切除且行辅助放疗的NSCLC患者来说,具有预测放疗疗效的价值,对于筛选出局部晚期NSCLC患者是否需行术后辅助放疗具有重要意义。通过分层分析,发现不同淋巴细胞亚群表达的肺癌患者临床特征基本一致,基本排除表达CD4+/CD8+T淋巴细胞的患者因其他临床病理因素对于预后的影响。此外,有研究也表明同时高表达CD4和CD8对生存率的影响具有协同效应[14],在本实验中未观察到相同效应。由此可见,肿瘤组织中CD4+T淋巴细胞表达可以作为术后NSCLC患者辅助治疗选择的免疫标志物,更好地指导个体化治疗。
肿瘤组织中CD4+和CD8+T淋巴细胞在肺癌患者的免疫反应中发挥着重要作用。CD4+T淋巴细胞是免疫应答的主要反应细胞,其协调B淋巴细胞分化产生抗体。CD8+T淋巴细胞则抑制抗体的合成、分泌及T淋巴细胞增殖。放疗可能通过促进肿瘤相关抗原的表达,促进肿瘤基质的免疫介导作用,减弱调节性T细胞的活性等来影响机体的免疫功能[3]。国内学者实验证实,CD4+T淋巴细胞百分含量超出正常参考范围的晚期乳腺癌患者,放疗后CEA和CA15-3水平下降,与放疗前比较,差异具有统计学意义[15]。Gupta等[16]也发现间质低表达CD4/CD8预示细胞水平不足,从而无法实现放疗放大效应。通过免疫治疗促进免疫反应可能因此放大肿瘤基质中缺乏CD4/CD8患者的放疗反应。本研究也发现,间质组织CD8+T淋巴细胞高表达在辅助放疗的肺癌患者中具有高度的预测意义,同时提示间质局部的免疫调节可能与放疗之间存在某种关联。
本研究通过对肿瘤组织及间质组织中淋巴细胞的表达进行分选,初步证实肺癌肿瘤组织中CD4+T淋巴细胞高表达可作为术后NSCLC患者辅助治疗选择的免疫标志物,更好地指导个体化治疗。但是本结果仍然具有局限性,由于本研究样本量较小,而且属回顾性研究,存在患者选择的偏倚。下一步笔者将继续扩大样本量,探讨CD4高表达的机制,同时开展前瞻性研究,通过加强对体内免疫细胞功能和生物标志物的认识,进一步探讨术后接受辅助放疗的NSCLC患者免疫细胞标志物的表达及其预后作用。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CACancer J Clin,2016,66(2):115-132.
[2]Holmberg L,Sandin F,Bray F,et al.National comparisons of lung cancer survivalin England,Norway and Sweden 2001-2004:differences occur early in follow-up[J].Thorax,2010,65(5):436-441.
[3]Van den HeuvelMM,Burgers SA,van Zandwijk N.Immunotherapy in nonsmall-cell lung carcinoma:from inflammation to vaccination[J].Clin Lung Cancer,2009,10(2):99-105.
[4]Demaria S,BhardwajN,McBride WH,et al.Combining radiotherapy and immunotherapy:a revived partnership[J].Int J Radiat OncolBiolPhys,2005,63(3):655-666.
[5]Reits EA,Hodge JW,Herberts CA,et al.Radiation modulates the peptide repertoire,enhances MHC class I expression,and induces successful antitumor immunotherapy[J].J Exp Med,2006,203(5):1259-1271.
[6]Hald SM,Bremnes RM,Al-Shibli K,et al.CD4/CD8 co-expression shows independent prognostic impact in resected non-small cell lung cancer patients treated with adjuvant radiotherapy[J].Lung cancer,2013,80:209-215.
[7]翟浩然,钟文昭.ASCO 2015局晚期肺癌治疗进展[J].浙江医学,2015,18:1490-1492.
[8]邢力刚.2015年肺癌放疗研究进展回顾[J].浙江医学,2016,38(4):231-232,251.
[9]Mantovani C,Levra NG,Filippi AR,et al.Postoperative radiotherapy for patients with completely resected pathologic N2 non-small-cell lung cancer:a retrospective analysis[J].Clin Lung Cancer,2013,14(2):194-199.
[10]刘翼,阿迪力,陆艳荣,等.ⅢA(N2)期非小细胞肺癌术后放疗疗效分析[J].中国癌症杂志,2013,6:452-456.
[11]Wang EH,Corso CD,Rutter CE,et al.Postoperative radiation therapy is associated with improved overall survival in incompletely resected stage II and III non-small-cell lung cancer[J].J Clin Oncol,2015,33(25):2727-2734.
[12]Jackute J,Zemaitis M,Pranys D,et al.The prognostic influence of tumor infiltrating Foxp3+CD4+,CD4+and CD8+Tcells in resected non-small cell lung cancer[J].Journal of Inflammation,2015,12(1):63.
[13]Kinoshita T,Muramatsu R,Fujita T,et al.Prognostic value of tumor-infiltrating lymphocytes differs depending on histological type and smoking habit in completely resected non-small cell lung cancer[J].Annals of Oncology,2016,27:2117-2123.
[14]Hiraoka K,Miyamoto M,Cho Y,et al.Concurrent infiltration by CD8+T cells and CD4+T cells is a favourable prognostic factor in non-small-cell lung carcinoma[J].Br J Cancer,2006,94:275-280.
[15]朱江,何津祥,何津春.CD4+T细胞与放疗前后肿瘤标志物变化[J].国际检验医学杂志,2016,37(20):2828-2830.
[16]Gupta A,Probst HC,Vuong V,et al.Radiotherapy promotes tumor-specific effector CD8+T cells via dendritic cell activation[J].J Immunol,2012,189:558-566.
