光谱法联合分子对接研究人血清白蛋白与新的抗肿瘤活性小分子的体外结合
2018-05-10刘举,宫雪,徐亮*,张力,宫平
刘 举,宫 雪,徐 亮*,张 力,宫 平
(1.辽宁大学 药学院,辽宁 沈阳 110036;2.辽宁大学 生命科学院,辽宁 沈阳 110036;3.沈阳药科大学 基于靶点的药物设计与研究教育部重点实验室,辽宁 沈阳 110016)
人血清白蛋白(Human serum albumin,HSA)是一种人体血浆内十分重要的、含量最为丰富的蛋白质,约占血清总蛋白的60%。HSA可与许多内源性和外源性物质(如氨基酸、胆红素、代谢物、脂肪酸、金属离子、药物等) 结合,具有存储和转运的重要功能[1]。因此,HSA通常被用作研究生物活性物质与蛋白质相互作用的模型蛋白。HSA的三维晶体结构由585个氨基酸残基组成,包含3条同源的α-螺旋结构域:Ⅰ、Ⅱ和Ⅲ。每条结构域各自均包含A和B两个亚结构域,例如ⅡA或者ⅡB。每个主结构域中的两个亚结构域均以槽口相对的方式形成圆筒状结构。几乎所有疏水性氨基酸均包埋在圆筒腔内部,形成疏水腔[2]。Sudlow等[3]研究发现,大多数药物在HSA上主要有两个结合位点:SiteⅠ和SiteⅡ,分别位于亚结构域ⅡA 和ⅢA的疏水腔内。

图1 LJC-116的分子结构Fig.1 Molecular structure of LJC-116
LJC-116(如图1)是对Type Ⅱ类小分子c-Met激酶抑制剂的4-苯氧基喹啉这一基本母核进行结构改造,运用拼合原理、电子等排原理,将具有抗肿瘤作用的药效团引入母核中,从而设计成的具有全新结构的4-苯氧基喹啉类Type Ⅱ型小分子c-Met激酶抑制剂。该化合物以3-甲氧基4-羟基苯乙酮为原料经14步反应合成制得,分子式为:C34H35F2N7O5,分子量:659.27。体外抗肿瘤活性测试表明该化合物具有较好的抗肿瘤活性,该化合物对HT-29、H460、A549、MKN-45的抗增殖活性均与N-[3-氟-4-[[6-甲氧基-7-[[3-(吗啉-4-基)丙基]氧]喹啉-4-基]氧]苯基]-N′-(4-氟苯基)环丙烷-1,1-二甲酰胺(Foretinib)相当,其IC50值分别为0.080、0.14、0.11、0.030 μmol/L[4]。
目前,作为全新合成的具有抗肿瘤活性的小分子c-Met激酶抑制剂,LJC-116与HSA相互作用的研究尚未见报道。为此,本文考察了在模拟生理条件下,LJC -116与HSA的体外结合性质。利用荧光探针竞争实验研究了LJC-116与HSA的结合部位。采用荧光光谱法以及结合反应的热力学性质计算了结合作用的驱动力。通过双对数方程计算了两者之间的结合常数,利用荧光光谱、紫外光谱法结合Förster偶极-偶极非辐射能量转移理论方程计算了两者之间的能量转移效率以及结合距离。本研究有望为小分子c-Met激酶抑制剂类药物的体内转运情况研究提供一定的有用信息,同时也有助于了解药物对蛋白质结构和功能的影响。
1 实验部分
1.1 试剂与仪器
LJC-116[4]合成提纯后直接用于本研究。HSA(美国Sigma公司);氯化钠(NaCl)、三羟甲基氨基甲烷(Tris)购自国药集团化学试剂有限公司;布洛芬(Ibuprofen)、华法林(Warfarlin)购自安耐吉化学试剂有限公司;实验用水为蒸馏水。
UV-2550型紫外-可见分光光谱仪(日本岛津公司);F-7000型荧光光谱仪(日本日立公司);AL204型分析天平(梅特勒-托利多仪器(上海)有限公司);微量进样器(上海安亭微量进样器厂)。
1.2 实验方法
1.2.1溶液配制及光谱测定方法HSA储备液用Tris-HCl-NaCl(pH 7.4)缓冲溶液溶解后放置于冰箱冷藏保存;LJC-116与布洛芬、华法林储备液的配制均先将相应药品溶于少量乙醇后,再用Tris-HCl-NaCl缓冲溶液稀释至适当浓度。
288、299、310 K 3个温度下荧光光谱测定、荧光的内滤光效应校正、288 K下紫外光谱测定以及288 K下荧光探针实验见文献[5-8]。
1.2.2分子对接研究使用分子对接软件AutoDock 4.2.5.1和AutoDock Tools 1.5.6研究LJC-116和HSA之间的相互作用。分子对接需要LJC-116和HSA的三维结构。对于LJC-116,首先使用ChemDraw绘制出其二维结构,然后使用Chem 3D生成三维结构。HSA蛋白的三维结构下载于PDB数据库(http://www.rcsb.org/pdb),其PDB ID为1AO6,然后使用Pymol 1.8.2.0将三维结构中所有水分子去除,并添加极性氢原子。在分子对接前,使用AutoDock Tools 1.5.6为LJC-116和HSA添加Gasteiger电荷,合并非极性氢,并将原子转换为AutoDock类型。分子对接时的盒子中心坐标为33.175,30.604,34.136,盒子大小为70×70×70格点,其中格点间距离为0.375 Å。对接过程中能量优化采用拉马克遗传算法,评价函数使用半经验自由能评价函数,遗传算法最大搜索步数和最大代数分别设为25 000 000和27 000,其余参数均为默认值。对接共产生100个LJC-116与HSA的结合构象,根据构象的聚类与结合能分布情况选择合适的结合构象进行分析。本研究使用了PyMOL 1.8.2.0和Ligplot+1.4.5[9]对结合构象进行可视化分析。
2 结果与讨论
2.1 LJC-116浓度对HSA紫外光谱的影响

图2 不同浓度LJC-116存在下HSA的紫外吸收光谱Fig.2 UV-Vis absorption spectra of HSA in different concentrations of LJC-116[LJC-116](a-e) :0.5,1.0,1.5,2.0,2.5(×10-5 mol/L); [LJC-116](f-k) :0,0.5,1.0,1.5,2.0,2.5(×10-5 mol/L),[HSA](f-k) :5.0×10-6 mol/L;T=288 K
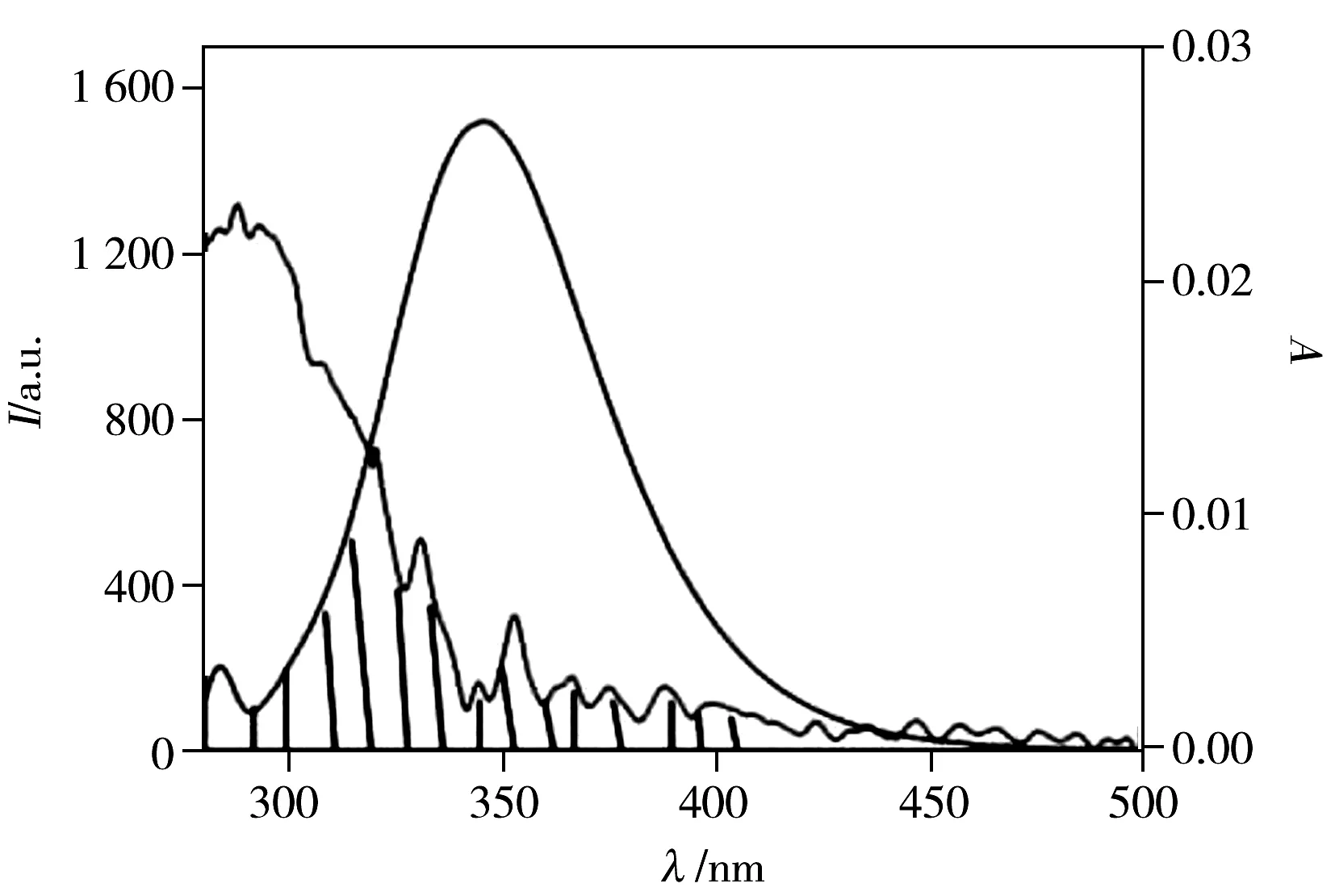
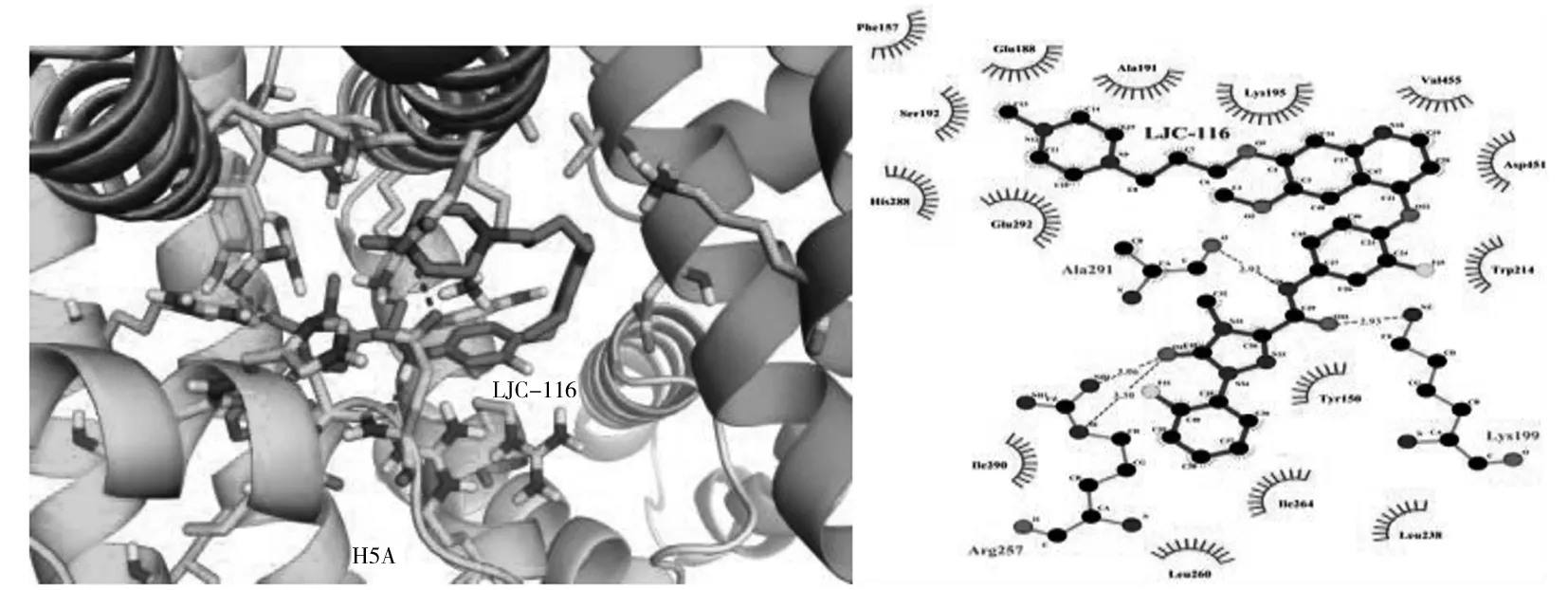
LJC-116浓度对HSA紫外光谱的影响见图2。从图2可以看出,HSA在280 nm处有最大吸收峰,而LJC-116 的吸收峰位于295 nm和320 nm,两者的吸收光谱部分重叠。加入LJC-116 后,随着LJC-116 浓度的增加,HSA 在280 nm处的吸收峰位略有红移。说明LJC-116 使包埋在HSA 分子内部的色氨酸(Trp)和酪氨酸(Tyr)残基部分裸露于水相,同时疏水基团之间的疏水作用增强,引起电子轨道跃迁能量减小,造成HSA的紫外吸收光谱图表现出吸收峰红移。在320 nm处,对比加入LJC-116后的HSA吸光度值与两者单纯吸光度值之和发现:AHSA+ALJC-116 图3 LJC-116与HSA相互作用的荧光光谱图Fig.3 Fluorescence spectra of HSA+LJC-116 solutions LJC-116 concentration(a-f):0,0.5,1.0,1.5,2.0,2.5×10-5 mol/L;[HSA]=5.0×10-6 mol/L,T=299 K 2.2.1LJC-116对HSA猝灭方式的确定HSA的内源荧光主要来自Trp和Tyr,图3为HSA在不同浓度LJC-116存在下的荧光发射光谱。 随着LJC-116浓度的增加,HSA的内源荧光(280 nm激发)呈规律性降低,同时峰位稍有红移(0.3 nm),表明HSA与LJC-116发生了作用,氨基酸残基所处微环境极性增加。 HSA溶液的荧光发射峰位于348 nm处。 测定HSA在288、299、310 K 3个温度下的荧光光谱数据,利用 Stern-Volmer(S-V)方程,计算了LJC-116+HSA体系的猝灭常数[7]。 F0/F=1+KSV[Q]=1+Kqτ0[Q] (1) 各参数含义见文献[10]。 根据式(1)以F0/F对[Q]作图可得一条直线,如图4A所示[6]。 由图4A与表1可看出,S-V曲线均具有较好的线性关系(r2>0.99),说明两者之间只发生一种猝灭。在288、299、310 K温度下,由直线的斜率求得HSA+LJC-116体系的KSV分别为4.320×103、3.810×103、3.540×103L·mol-1。 在3个温度下,HSA+LJC-116体系的Kq分别为:Kq=4.324×1011L/(mol·s),r2=0.999 0(288 K);Kq=3.814×1011L/(mol·s),r2=0.997 5(299 K);Kq=3.542×1011L/(mol·s),r2=0.998 9(310 K)。3个温度下的Kq值均大于2.0×1010L/(mol·s),此外,S-V曲线的斜率随温度的升高而降低,表明LJC-116在实验浓度下对HSA的荧光猝灭效应不是动态猝灭,而是通过复合物形成[7]。 因此,LJC-116与HSA的猝灭类型是静态猝灭。 此结果与紫外可见光谱判断的猝灭类型一致[11]。 表1 3个温度下HSA+LJC-116体系的KSV、Kq、KA、n、ΔG0、ΔH0和ΔS0Table 1 Quenching constants(KSV and Kq),stability constants(KA),binding site numbers(n) and thermodynamic parameters calculated according to Stern-Volmer plots and double logarithm plots of HSA+LJC-116 system at three temperatures 2.2.2LJC-116与HSA的结合常数及结合位点数当小分子独立结合在高分子的1组位点时,可用双对数方程来确定结合常数和结合位点数[15]。 lg[(F0-F)/F]=lgKA+nlg[Q] (2) 式中,KA为LJC-116与HSA的结合常数,n为LJC-116与HSA之间的结合位点数,[Q]是游离体系中LJC-116的浓度,但由于其浓度未知,因此计算中以猝灭剂LJC-116的浓度代替。 将lg [(F0-F)/F]对lg [Q]作图(图4B),所得直线斜率为结合位点数,截距的负对数值为结合常数。 因此从表1可得,在288 K时,HSA+LJC-116体系中KA=4.629×104L/mol,n=1.006 4,在299 K时,KA=4.172×104L/mol,n=1.008 2,在310 K时KA=3.808×104L/mol,n=1.006 55。 这表明,LJC-116与HSA之间相互作用的结合常数大小顺序为:HSA+LJC-116(310 K) 2.2.3LJC-116与HSA的作用力类型LJC-116与HSA之间作用类型的判断对药物设计有着重要的指导作用。基于不同温度下的KA,结合以下热力学公式,可求出结合反应过程中的焓变(ΔH)、熵变(ΔS) 和自由能变(ΔG)。 ΔG=-RTlnKA (3) lnKA=-ΔH/(RT)+ΔS/R (4) ΔG=ΔH-TΔS (5) 由表1可知,在3种不同温度下,ΔG0均为负值,表明结合过程是自发的。 ΔS(66.45)>0,且 ΔH(-65.82)<0。 根据热力学参数的正负性与结合作用力的关系,可判定LJC-116与HSA的结合为疏水作用和氢键共同作用所致[15]。 LJC-116的分子结构中包含2个疏水的苯环以及含N原子的1个喹啉环、1个哌嗪环以及三氮唑。苯环与HSA的疏水基团易形成疏水作用,而含杂原子的哌嗪环和三氮唑与HSA易形成氢键作用。其中杂原子N又是氢键的良好受体,易与HSA形成氢键。 图5 HSA的荧光光谱与LJC-116紫外吸收光谱的重叠Fig.5 Spectral overlap of fluorescence of HSA solution and absorption of LJC-116 solution [HSA]=[LJC-116]=5.0×10-6 mol/L;T=288 K 2.2.4LJC-116与HSA的结合距离LJC-116与HSA的Trp残基之间的结合距离(r)采用能量转移效率(E)来评价。根据Förster偶极-偶极非辐射能量转移理论方程,E由式(6)描述[20]: E=1/[1+(r/R0)6] (6) 式中,r是供体(HSA)和受体(LJC-116)之间的结合距离,R0是能量转换率为50%时的结合距离,可通过式(7)计算[20]: (7) 式中,K2是偶极子的空间取向因子,n是介质的折射率,J是供体(HSA)的发射光谱和受体(LJC-116)吸收光谱的重叠积分,φD是供体(HSA)在缺少受体(LJC-116)下的量子产率。在此情况下,HSA分子中K2、n、φD分别为2/3、1.336和0.118[14]。 也可通过式(8)计算J[17]: J=∑f(λ)ε(λ)λ4δλ/σf(λ)δλ (8) 其中,ε(λ)是LJC-116在波长λ处的摩尔吸光系数,f(λ)是HSA在波长λ处的荧光强度。通过上式,R0和r可进一步被计算。图5展现了HSA溶液荧光发射光谱和LJC-116紫外-可见吸收光谱的重叠。此外,能量传递的效率(E)也可由方程(9)确定: E=1-F/F0 (9) 根据公式(6)~(9),在299 K下,计算得R0=1.28 nm,r=1.69 nm,E=15.6%,J=7.1697×10-15cm3·L/mol。0.5R0 2.2.5分子探针确定HSA与LJC-116的结合位置为确定LJC-116在HSA上的结合位点,分别以华法林和布洛芬作为SiteⅠ和SiteⅡ的荧光探针试剂,考察对HSA+LJC-116体系荧光光谱的影响。固定LJC-116与HSA的摩尔比为1∶1,使荧光探针的非特异性结合达到最小[19]。逐渐加入探针试剂,LJC-116被荧光探针取代的百分比按F2/F1×100%计算[20](F1和F2分别为HSA+LJC-116体系加入探针试剂前后的荧光强度),以F2/F1对探针试剂和HSA的浓度比作图。结果表明,随着布洛芬的浓度增加,HSA+LJC-116体系的荧光强度变化不大,说明HSA与布洛芬的作用位点不同。而加入的华法林使HSA+LJC-116体系的荧光强度明显降低,华法林可将LJC-116从HSA+LJC-116中置换出来,说明LJC-116在HSA上的作用位点与华法林一致,均为SiteⅠ。 2.3.1同步荧光光谱的研究本研究中,设置Δλ分别等于15、60 nm,得到分别显示Tyr和Trp残基特性的同步荧光光谱如图6所示。 由图6可知,随着LJC-116浓度的增加,Tyr和Trp残基的同步荧光强度均逐渐降低。LJC-116的加入使荧光发生猝灭,说明LJC-116与蛋白存在相互作用。未观察到Tyr最大发射波长发生蓝移或红移,但Trp的最大发射波长红移了0.4 nm,说明HSA中的Trp残基对LJC-116更敏感,HSA与LJC-116的相互作用使Trp残基所处的疏水环境极性增加,肽链的伸展程度有所增加,进而引起HSA构象发生变化[21]。在同步荧光光谱中得到的Trp红移结果与静态荧光光谱的红移结果一致。 2.3.2三维荧光光谱的研究为进一步分析LJC-116与HSA结合后HSA构象的变化,分别测定了HSA和HSA+LJC-116混合溶液的三维荧光光谱(见图7)。 由表2计算可知,加入LJC-116 后,Peak 1的峰强下降了51.9%; Peak 2的峰强下降了74.5%,且斯托克斯位移从110 nm增至120 nm,表明氨基酸残基的微环境极性增加,疏水性减弱[22]。 此结果验证了同步荧光光谱以及静态荧光光谱的红移结果。值得注意的是,加入LJC-116后的HSA瑞利散射峰明显增强,说明生成了新的尺寸更大的复合物,增大了瑞利散射峰的强度。 表2 单纯HSA和HSA+LJC-116体系的三维荧光光谱特征参数Table 2 Three-dimensional fluorescence spectral characteristic parameters of free HSA and HSA+LJC-116 systems 位点竞争实验显示了LJC-116在HSA的结合部位为Site Ⅰ,为进一步验证这一结果,使用分子对接技术在分子水平上模拟两者之间的结合作用。通过研究100个对接构象的聚类情况(阈值 2.0 Å),发现能量最低的聚类包含的构象数目最多,取这一聚类中结合能最低的构象作为HSA+LJC-116的结合结构,结合能为-10.44 kcal/mol。对接结果见图8。 图8 HSA和HSA+LJC-116相互作用的分子对接图Fig.8 Interaction model of LJC-116 at site Ⅰ of HSA with its hydrogen bodings and hydrophobic interactions 图8所示的对接结果表明:药物分子与HSA在site Ⅰ的疏水腔内结合,且两者之间存在较强的疏水作用力以及氢键作用。与LJC-116形成氢键的氨基酸残基为Lys199、Arg257、Ala291,与LJC-116产生疏水相互作用的氨基酸残基很多(包括Tyr150、Glu153、Phe157、Glu188、Ala191、Ser192、Lys195、Trp214、Arg222、Leu238、Leu260、Ile264、Ser287、His288、Ile290、Glu292、Lys436、Asp451和Val455)。此对接结果与热力学实验判断的作用力结果相吻合。 本文采用荧光光谱法、紫外可见吸收光谱法、同步荧光光谱法、三维荧光光谱法以及分子对接技术全面研究了新合成的小分子c-Met激酶抑制剂LJC-116与HSA之间的相互作用。首先通过紫外光谱法和荧光光谱法考察两者的作用机制为生成静态复合物的静态猝灭,并计算了结合常数与结合位点数。进而根据反应的热力学常数得出结合的作用力为氢键和疏水作用。同时采用探针竞争实验获得了LJC-116在HSA上的结合位点为SiteⅠ,且更接近于Tyr残基。最后利用光谱法联合Förster偶极-偶极非辐射能量转移理论方程计算了两者之间的结合距离。并采用同步荧光光谱法和三维荧光光谱法探讨了HSA构象的变化。本研究为小分子c-Met激酶抑制剂分子在体内的转运和传输提供了一定的信息,并进一步阐明了人血清白蛋白的结构和功能。 参考文献: [1] Guo M,Xu X T,Wu Z W.ActaPharm.Sin.(郭明,徐兴涛,吴志武.药学学报),2011,46(9):1084-1092. [2] Cao T W,Zhou K,Huang W B,Shi J W,Tan X P,Huang C L,Ran Y.Chin.J.Anal.Chem.(曹团武,周坤,黄文兵,时建伟,谭晓平,黄春林,冉媛.分析化学),2017,45(5):700-706. [3] Sudlow G,Birkett D J,Wade D N.Mol.Pharmacol.,1976,12:1052. [4] Liu J,Nie M H,Wang Y J,Hu J X,Zhang F,Gao Y L,Liu Y J,Gong P.Eur.J.Med.Chem.,2016,123:431-446. [5] Liu B M,Zhang J,Bai C L,Wang X,Qiu X Z,Wang X L,Ji H,Liu B.J.Lumin.,2015,168:69-76. [6] Shahabadi N,Khorshidi A,Moghadam N H.Spectrochim.ActaA,2013,114:627-632. [7] Wang Q,Huang C R,Jiang M,Zhu Y Y,Wang J,Chen J,Shi J H.Spectrochim.ActaA,2016,156:155-163. [8] Singh P,Choudhury S,Chandra G K,Lemmens P,Pal S K.J.Photochem.Photobiol.B,2016,157:105-112. [9] Zhu C Y,Li X J,Zhang L,Duan Y T,Liu H S.Chin.J.Bioinf.(朱春玉,李雪娇,张力,段艳婷,刘宏生.生物信息学),2012,10(4):254-258. [10] Lakowicz J R.PrinciplesofFluorescenceSpectroscopy.Now York:Plenum Press,1983:303. [11] Xu X Y,Wang D D,Sun X J,Zeng X Y,Li L W,Sun D Z.Thermochim.Acta,2009,493:30-36. [12] Bi S Y,Bian J Y.J.Mol.Sci.(毕淑云,边江鱼.分子科学学报),2010,26(2):99-102. [13] Bera R,Sahoo B K,Ghosh K S,Dasgupta S.Int.J.Biol.Macromol.,2008,42:14-21. [14] Wang Y P,Zhang G W,Wang L H.J.Instrum.Anal.(王亚萍,张国文,汪浪红.分析测试学报),2013,32(12): 1433-1437. [15] Xu L,Hu Y X,Li J,Liu Y F,Zhang L,Ai H X,Liu H S.J.Photochem.Photobiol.B,2017,173:187-195. [16] Wu Y H,Han Z B,Ma J Z,He Y,Liu L Y,Xin S G,Yu Z.Spectrosc.SpectralAnal.(吴雨杭,韩忠保,马嘉泽,何研,刘丽艳,辛世刚,于湛.光谱学与光谱分析),2016,36(3):765-769. [17] Ma X H,Song B L,Xiao W J,Geng J,Li X X,Chen J.Spectrosc.SpectralAnal.(马雪红,宋百灵,肖文浚,耿晶,李新霞,陈坚.光谱学与光谱分析),2017,37(6):1826-1830. [18] Cui F L,Fan J,Li J P,Hu Z D.Bioor.Med.Chem.,2004,12:151-157. [19] Jiang T,Ma L,Zhang Y H,Wang J M.Chin.J.Anal.Chem.(江涛,马良,张宇昊,王佳曼.分析化学),2016,44(1):54-60. [20] Lu Y,Gao S H,Wang Y L,Wang G K,Yan C L,Chen D J.Chin.Sci.Bull.(卢雁,高胜华,王运来,王公柯,闫长岭,陈得军.科学通报),2009,54:2071-2075. [21] Wang Y R,Huang F,Liu Y.Spectrosc.SpectralAnal.(王艺润,黄芳,刘颖.光谱学与光谱分析),2016,32(4):1205-1210.
2.2 荧光光谱讨论


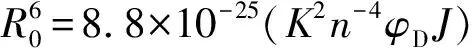
2.3 HSA与LJC-116结合后构象的变化



2.4 分子对接研究
3 结 论
