激光解吸电离傅立叶变换离子回旋共振质谱用于食用油的快速分析
2018-05-10李卫峰杨秋霞林泽鹏郭鹏然
李卫峰,杨秋霞,林泽鹏,管 鹏,2,郭鹏然*
(1.广东省测试分析研究所 广东省化学危害应急检测技术重点实验室 广东省原位电离质谱分析工程技术研究中心,广东 广州 510070; 2.兰州理工大学 石油化工学院,甘肃 兰州 730050)
食用油是人们日常生活中必不可少的营养成分,其化学组成包括甘油三酯、甘油二酯、脂肪酸、甾醇、酚类等,其中,甘油三酯(Triacylglycerols,TAGs)是食用油的主要成分(占95%以上)。TAGs由甘油和3个脂肪酸酯化而成[1],由于脂肪酸分为饱和脂肪酸(Saturated fatty acid)、单不饱和脂肪酸(Monounsaturated fatty acid)和多不饱和脂肪酸(Polyunsaturated fatty acid),最终形成的甘油三酯种类十分庞大,所以不同种类的食用油因含有的TAGs成分不同,其营养价值有很大的差异。据报道,甘油三酯中的脂肪酸组成及含量与多种疾病相关(如冠心病、心脑血管疾病和老年痴呆症等[2-3]),因此在饮食搭配过程中合理选择食用油品种至关重要。但不同种类食用油外观及组成高度相似,以次充好、食用油掺假现象频繁发生,极大地影响了食用油品行业的健康安全发展。因此,开发快速、直接分析食用油中甘油三酯的方法对有效监控食用油质量和保障食用油安全具有重要意义。
目前,食用油的分析方法主要包括红外光谱法、色谱法、色谱-质谱联用法及直接进样质谱法[4-8]。其中,直接进样质谱法因具有易操作、分析速度快、高通量等特点而成为分析食用油中TAGs的前沿手段之一。当前用于食用油中TAGs直接分析的离子源种类多样,包括基质辅助激光解吸电离源(MALDI)[9-10]、电喷雾离子源(ESI)[11-12]、解吸附电喷雾离子源(DESI)、大气压化学电离源(APCI)等[13-16]。与其他离子源相比,MALDI源可以避免样品纯化或化学修饰等预处理过程,具有样品制备方便、易操作、耐盐度好的优点,已被广泛应用于食用油的快速筛查分析。但是,MALDI离子源也有自身缺陷,如低质量数的区域易受基质峰干扰、质谱图重现性受制于基质结晶的均匀程度。为解决这些难题,涌现了多种新型的样品制备手段,如Picariello等[17]在不锈钢样品靶上预沉积硝化纤维层后可以获得重复稳定的TAGs信号,并且显著降低了碎片离子峰强度。Park等[18]在无基质的条件下利用紫外激光直接解吸电离石墨板靶上食用油并获得了TAGs的质谱图,但质谱图的信噪比和分辨率较差。Calvano等[19]研究发现无基质激光解吸电离(LDI)的方式可直接用于橄榄油、大豆油、玉米油等多种食用油中的TAG成分研究。更深入的研究得知,利用LDI源可直接快速识别橄榄油中掺杂葵花籽油及快速甄别食用油的品质[20]。此外,LDI源还被直接用于金属有机化合物的直接分析,且可同时获得元素和有机物的信息[21]。相比于MALDI源,LDI源的优势体现在可省去基质结晶步骤,使样品制备更加简单且去除了基质信号的干扰。虽然LDI源有以上优势,但利用LDI源对批量食用油的主成分分析却少有报道。
本文利用LDI-FTICR-MS直接对食用油中的TAGs进行了快速分析研究,开发了一种更为简便、快速分析食用油中TAGs的方法。根据TAGs的一级质谱图和二级碎片信息可以直接识别不同类型的食用油,利用主成分分析法和聚类分析法可快速地将批量的食用油进行归类。此外,利用LDI源可直接识别橄榄油中的掺杂菜籽油且根据线性公式可以初步预测掺杂油品的种数。
1 实验部分
1.1 仪器与装置
Solarix XR 7.0T FTICR-MS质谱仪:美国Bruker公司产品,配有基质辅助激光解吸电离源(MALDI),DataAnalysis 4.4和ProfileAnalysis 2.2数据处理软件,其中激光器为Smartbeam Ⅱ型的固态激光器,最大能量为300 μJ,频率在0~1 kHz内可调,波长为355 nm;WH-3微型旋涡混合仪:上海泸西分析仪器有限公司。
1.2 材料与试剂
二氯甲烷(分析纯,广州市化学试剂厂);三氟乙酸钠校准溶液(NaTFA,美国Sigma-Aldrich公司)。橄榄油、大豆油、花生油、菜籽油、玉米油、葵花油等食用油购于本地超市;猪油自行制备。
1.3 样品制备
食用油样品:准确移取4 μL样品分别溶于1 mL二氯甲烷后,利用涡旋仪混匀待测。
掺杂食用油1号:将菜籽油与橄榄油按体积比配制成系列混合食用油(0%、5%、10%、20%、40%、60%、80%、100%,V茶籽油∶V橄榄油),然后准确移取4 μL样品分别溶于1 mL二氯甲烷后,利用涡旋仪混匀待测。
掺杂食用油2号:将菜籽油和玉米油按体积比1∶1配制成混合油,进一步将混合油与橄榄油按体积比配制成系列混合食用油(10%、20%、30%、40%、50%、60%、80%,V混合油∶V橄榄油),然后准确移取4 μL样品分别溶于1 mL二氯甲烷中,利用涡旋仪混匀待测。
LDI点样:移取1 μL制备好的食用油样品点于样品靶上即可进样分析。
1.4 实验条件
正离子模式下,选择激光能量为45%,Medium模式光斑,100 Hz的激光频率,辐照次数为100 shots,作用路径为Random的条件进行实验。设置质量采集范围m/z50~1 500,采样大小为1 mega-words,累加次数为8,和谐阱累积时间为0.002 s进行数据采集。进行二级质谱测定时,隔离窗口(Isolation window)设为10,碰撞能量为25 eV。
2 结果与讨论
2.1 质谱实验考察
与MALDI源不同,LDI离子源避免了基质结晶好坏的影响,缩短了样品制备时间。因此,实际质谱图质量只受激光相关参数的影响,如激光光斑、激光能量、激光频率等。当固定激光光斑大小时,增加激光能量和激光频率会增强离子流且获得高信噪比的质谱图。但对于FTICR-MS的质量分析器来说,和谐阱的体积大小固定,若离子流太强,过剩的离子在质量分析器中将受电荷排斥的影响而导致质量轴偏移。为保证质量轴精度,选择光斑为Medium模式,45%激光能量,100 Hz的激光频率,辐照次数为100 shots进行后续实验。以5种不同品牌的玉米油为例进行了重复性验证,多次测定质谱图中m/z877.73与m/z903.74的峰强度比,5种玉米油均可获得良好的重现性,相对标准偏差RSD<10%。以上结果初步表明LDI-FTICR-MS可直接用于食用油中TAGs的分析。
2.2 大豆油与橄榄油一级谱图分析
为保证质量轴精度,实验前均在ESI离子源模式下利用NaTFA标准溶液进行质量轴校准。图1A为采用LDI-FTICR-MS技术获得的大豆油的归一化一级质谱图,其中青色区域代表甘油二酯(Diacylglycerol,DAG),粉色区域代表甘油三酯。由图得知,甘油二酯与甘油三酯的比例与实际食用油中的比例相差较大。这是因为绝大多数甘油二酯由甘油三酯碎裂形成,所以在图1A中将甘油二酯的区域标记为DAG like fragments。对谱图作进一步解析得出图1A中的青色区域主要为甘油二酯的离子峰(见图1B),并主要由含16个碳的棕榈酸(P,C16H32O2)和含18个碳的油酸(O,C18H34O2),亚油酸(L,C18H32O2)或亚麻酸(Ln,C18H30O2)两两组合而成。图1C与图1D分别为C52(C16∶C18∶C18)和C54(C18∶C18∶C18)甘油三酯的分布图。由图得知,除了获得TAGs的钠离子复合峰外,还可得到TAGs的钾离子复合峰,且两种复合峰的分布基本类似。而据报道,若使用MALDI源测定食用油中的甘油三酯时,其谱图中主要以TAGs的钠离子复合峰为主[22-23]。这是因为随着LDI采用的激光能量的增加,制备样品过程中溶剂中及样品靶上残留的钠盐和钾盐也易被解吸出来。另外,由于离子源在300 Pa的低真空环境中工作,离子源内稀薄气体中含有的微量钠、钾元素也会增加钠、钾离子复合峰的概率。因此,在高激光辐照条件下,LDI源很容易获得TAGs钠离子和钾离子复合峰[24-25]。同理,橄榄油的一级归一化质谱图也可以获得相同的结果(图2)。因此,由图1和图2初步得出,大豆油中亚油酸所占的比例最多,而橄榄油中油酸为主要成分。数据表明利用TAGs的一级质谱图可以区分不同类型的食用油。
2.3 多种食用油的特征谱图分析
已有文献报道利用MALDI源、APCI源可直接对不同种类食用油中的TAGs进行分析[23,26],验证了直接进样分析方法具有高效、快速的优势。LDI离子源避免了基质结晶的过程,因此具有分析更加快速、高效的特点。采用LDI源获得的7种不同种类常用食用油中TAGs的分布见图3,由图得知,每种类型食用油的质谱图均含有TAGs的钠离子和钾离子的复合峰。对比图3G与图3A~F得知,猪油中因含有大量的不饱和脂肪酸(P,棕榈酸),所以质谱图中主要以C52的TAGs为主;植物油中富含不饱和脂肪酸,所以与动物油相比,植物油TAGs分布呈相反趋势,主要以C54的TAGs为主。虽然葵花油、大豆油、玉米油等6种食用油的TAGs分布类似,但根据各自特异的TAGs分布也可进行区分。例如,根据m/z877.73与m/z903.74之间的比例即可区分葵花油和玉米油(见图3A、D)。根据m/z877.73、m/z901.74及m/z903.74等可区分大豆油、葵花油与玉米油。
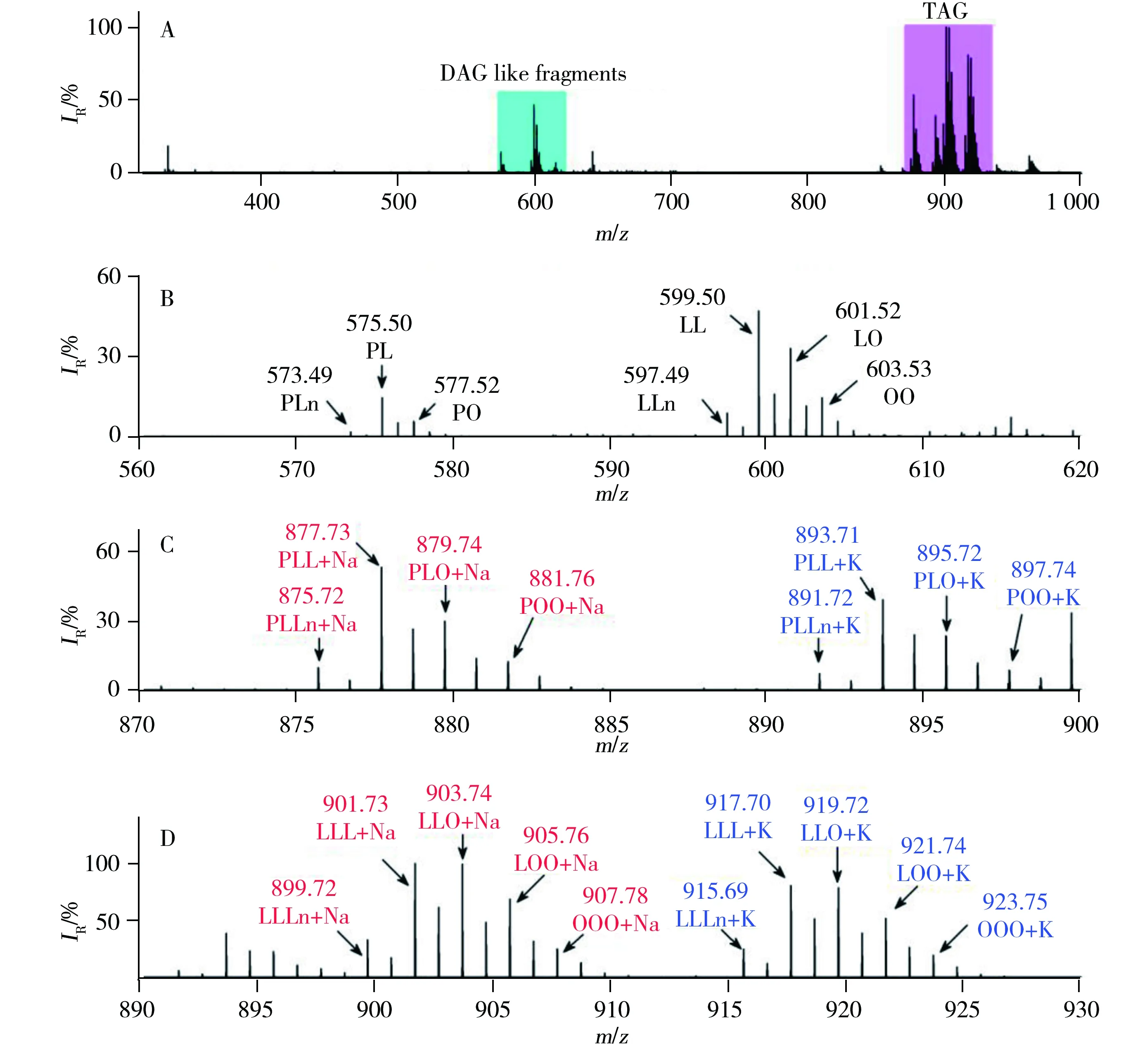
图1 大豆油在不同质量范围内的LDI-FTICR-MS质谱图Fig.1 Typical LDI mass spectra of soybean oil at various mass rangesmass ranges:A.m/z 300~1 000,B.m/z 560~620,C.m/z 870~900,D.m/z 890~930;P:palmitic acid,Ln:linolenic acid,L:linoleic acid,O:oleic acid
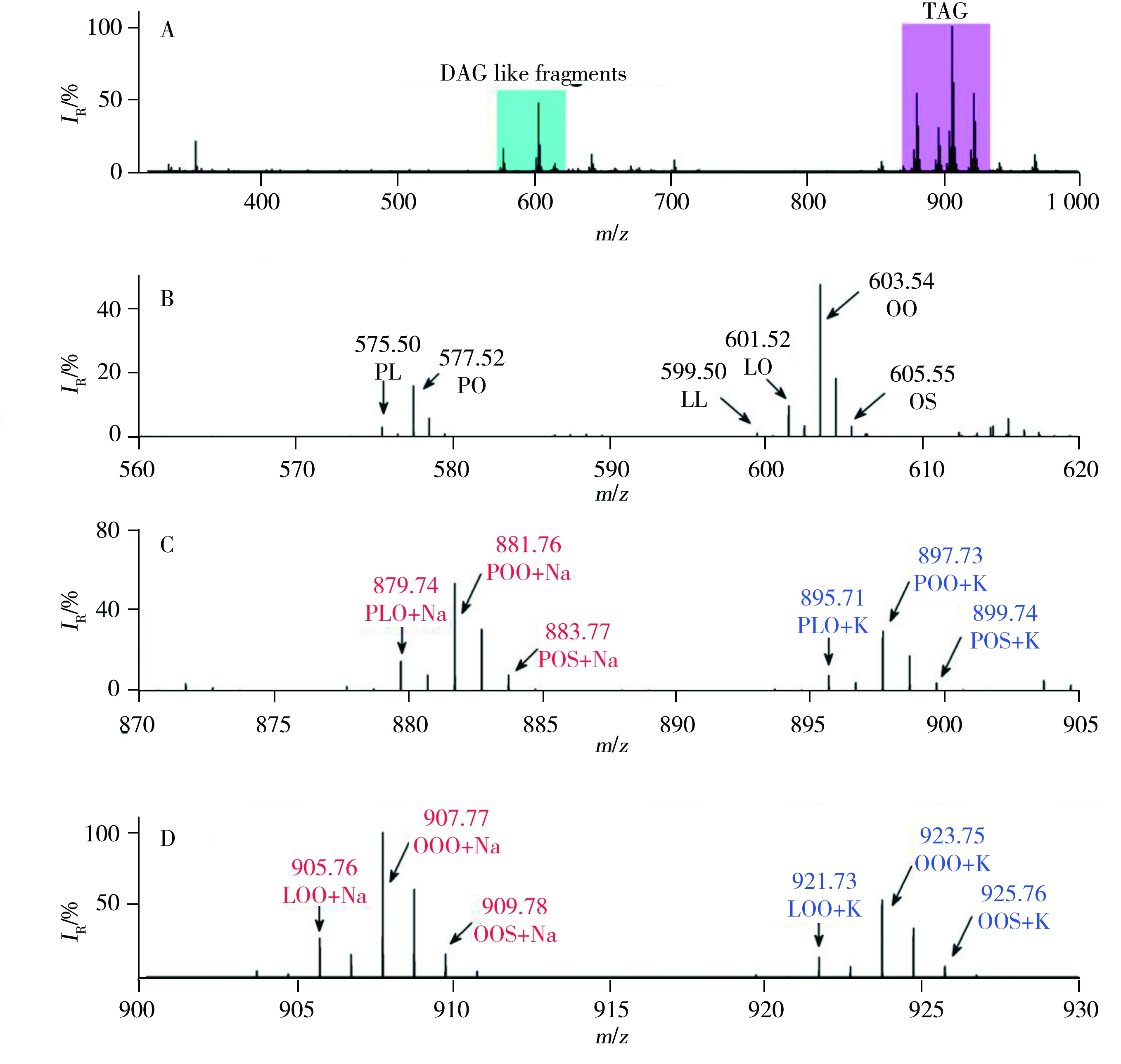
图2 橄榄油的LDI-FTICR-MS质谱图Fig.2 Typical LDI mass spectra of soybean oil at various mass rangesmass range:A.m/z 300~1 000,B.m/z 560~620,C.m/z 870~900,D.m/z 890~930;P:palmitic acid,Ln:linolenic acid,L:linoleic acid,O:oleic acid,S:stearic acid
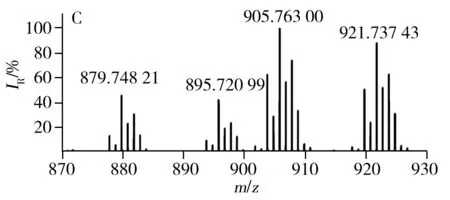
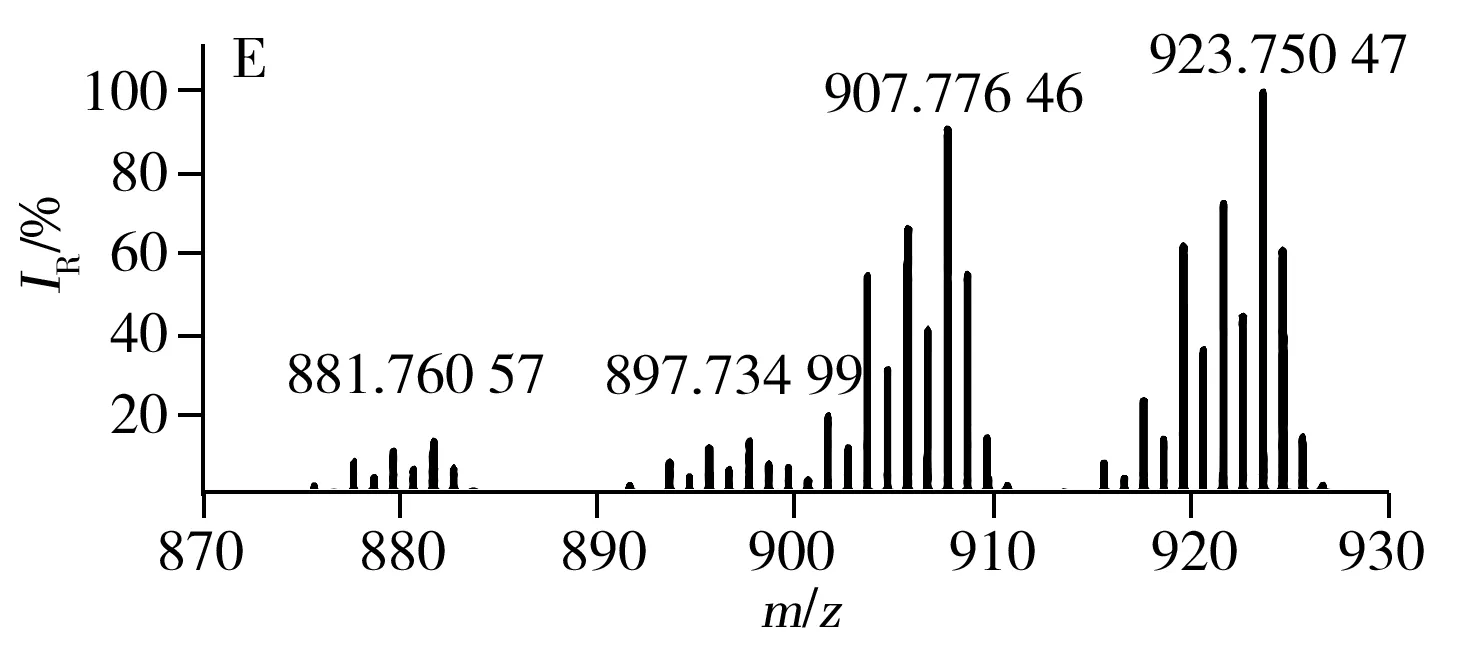
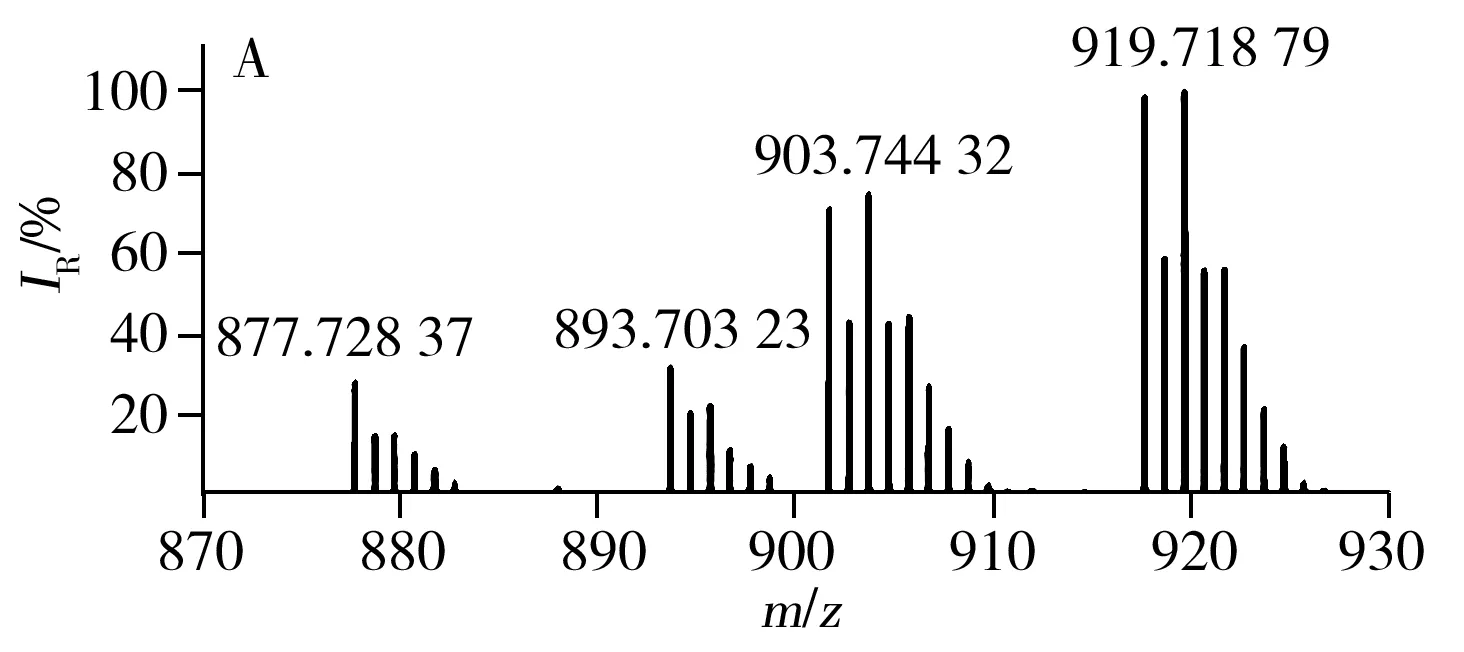
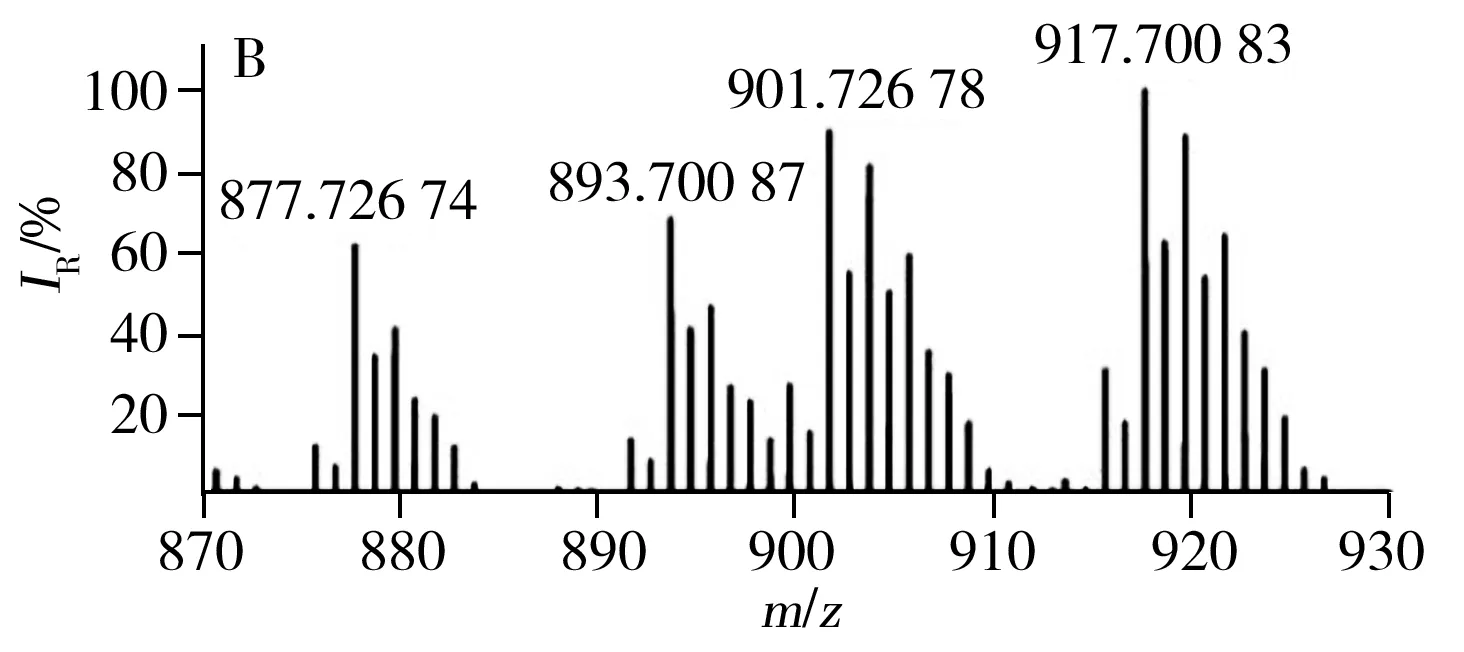
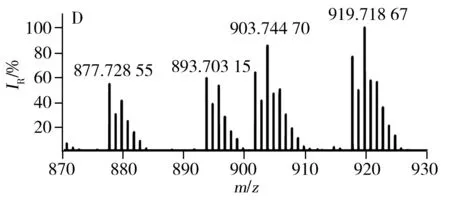
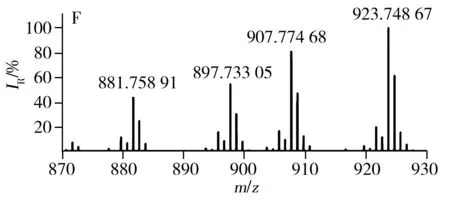
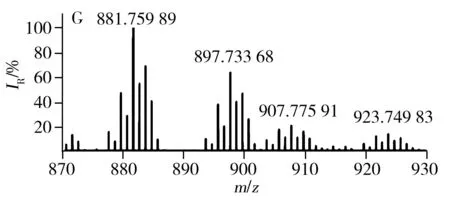
图3 不同种类食用油的TAGs分布Fig.3 TAGs profile of different edible oils using LDI-FTICR-MSA:sunflower oil,B:soybean oil,C:peanut oil,D:corn oil,E:canola oil,F:olive oil,G:lard
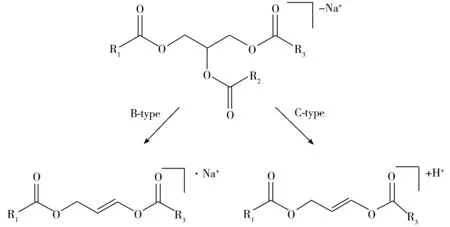
图4 典型的TAG碎裂路径Fig.4 Typical the dissociation pathways for the [TAGs+Na]+
2.4 食用油二级谱图分析
根据TAGs的一级质谱图分布可初步区分不同类型的食用油,若能获取TAGs的二级碎片信息,将会为食用油中TAGs分析提供更加丰富、精确的信息。据文献报道,当采用高能量的碰撞诱导解离(CID)方式进行TAGs碎片实验研究时,碎片主要由TAGs失去1个脂肪酸或者脂肪酸钠形成,具体的碎片离子形成机制可分为两种,具体见图4[27-28]。本实验采用25 eV大小的碰撞能量分别对大豆油、橄榄油和猪油进行实验,具体结果见图5。当选择图5A中大豆油质谱图的m/z901.73作为母离子进行二级碎片实验时,所得的碎片离子主要分为两个区域,以m/z621.49和m/z599.50为主(图5B)。其中,m/z621.49离子是由[LLL+Na]+失去1个L形成,即通过B-type断裂方式形成[LL+Na]+;而m/z599.50离子则是[LLL+Na]+经由C-type断裂方式失去1个[L+Na]分子形成。通过这些碎片离子信息可以推测大豆油中含有大量亚油酸。当选择橄榄油的m/z907.77进行二级碎片实验时,TAGs会失去1个油酸或油酸钠并形成以[OO+Na]+和[OO]+为主的两种类型碎片峰,由此得知橄榄油中富含油酸分子(图5C、D),而通过猪油的二级碎片信息可推测猪油含有大量棕榈酸,具体见图5D和图5F。获得的TAGs碎片信息提供了更加精确的脂肪酸的组成,从而为精确定性食用油提供了更为丰富的信息。
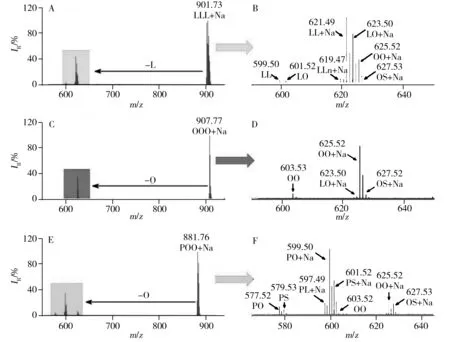
图5 甘油三酯的碎裂图Fig.5 Mass spectra of TAG fragmentsA:soybean oil at m/z 901.73;B:expanded fragmentation information of soybean oil;C:olive oil at m/z 907.77;D:expanded fragmentation information of olive oil;E:lard at m/z 881.76;F:expanded fragmentation information of lard
2.5 统计学用于食用油的分析
虽然通过食用油中TAGs的一级质谱和二级质谱图可以快速识别不同类型的食用油,但在实际的检测分析中食用油种类繁杂,样品量大,往往需要借助数据统计才能进行快速有效的筛查分析。常用的统计学主要包括主成分分析和聚类分析两种[29-30],主成分分析旨在用尽可能少的变量因子反映大量原始变量因子的主要信息,利用该方法可使复杂的数据简单化。聚类分析是利用一组变量对目标进行分组归类,样本之间的相似性可以利用“距离”度量。距离越短,表明样本的相似度越大。本实验分别利用这两种统计学对34种食用油进行分析。在分析前,需将m/z860~910质荷比范围内的质谱图进行归一化处理,其中主成分分析结果如图6~7所示。由图6得知,PC1和PC2的差异贡献值分别为54.4%和77.0%。在置信度为95%的条件下,利用PCA分析法可将34种食用油明显区分为7个区域(见图7),且根据分布可获得每种食用油的特征质荷比。另外,由图8得知,聚类分析方法获得的结果与主成分分析法的结果一致,能够将34种食用油进行很好的归类。统计学的数据表明,与MALDI源相似,LDI源同样可快速区分不同种类食用油,该技术有望成为食用油的快速筛查和鉴定潜在的分析工具。
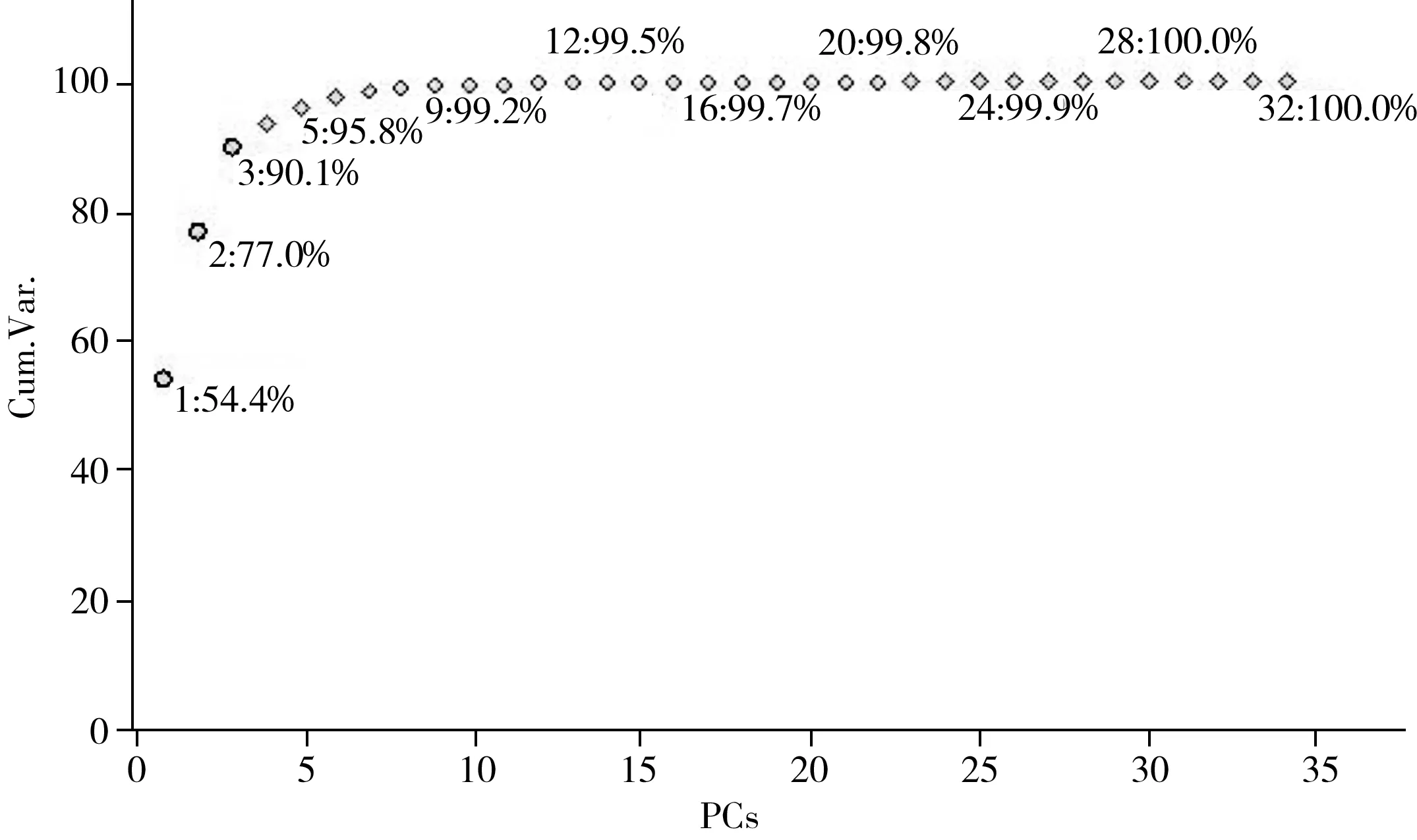
图6 不同主成分的差异值Fig.6 Explained variance plot of a PCA model for 34 kinds of oils
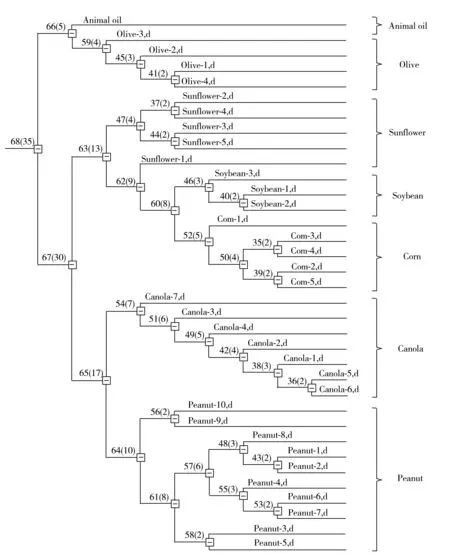
图8 34种食用油的聚类分析树状图Fig.8 Hierarchical clustering analysis plot of 34 kinds of pure edible oils
2.6 橄榄油中菜籽油掺杂量
橄榄油因含有丰富的不饱和脂肪酸与具有美容养颜的功效而备受消费者青睐,但其价格却高居不下。在紧俏的市场供应背景下,不法分子常在橄榄油中掺入一些低廉的食用油来牟取暴利。由于不同种类食用油中TAGs高度相似,常规的分析手段很难进行快速识别。为验证LDI源对食用油快速准确的识别能力,在橄榄油中掺入了不同比例的菜籽油进行分析,以I881.76/I907.78与掺入菜籽油比例作图,在0%~100%的比例范围内,可以获得较好的线性(y=-0.003 87x+0.571 4,r2=0.981 2),且即使掺杂5%的菜籽油也可以直接被快速识别。此外,将同等比例的菜籽油和玉米油的混合油(掺杂食用油2号)掺入橄榄油中,并同样以I881.76/I907.78与掺入混合油的比例作图,在10%~80%的比例范围内,仍然可以获得良好的线性(y=-0.0024 4x+0.563 8,r2=0.989 4)。通过以上两个线性公式可知,当掺入的食用油成分变化时会影响线性曲线的斜率但截距基本不变。因此,可以通过工作曲线斜率的变化初步推测橄榄油中掺杂的是一种食用油还是多种食用油。以上结果表明,LDI源具有快速识别掺杂食用油的能力。
3 结 论
本研究建立了一种用于食用油中TAGs分析的LDI-FTICR-MS直接快速分析方法。利用一级质谱图和二级碎片信息可以快速区分不同类型的食用油。利用统计学方法,可以有效地将34种食用油归为7类。利用该方法可直接识别掺杂5%菜籽油的橄榄油。此外,根据线性曲线斜率可简单推测橄榄油中掺杂的油是单个品种油还是混合油。结果表明,该方法可以简便、快速可靠地分析食用油中的TAGs,有望成为快速筛查食用油的有效分析方法。
参考文献:
[1] Saraiva S A,Cabral E C,Eberlin M N,Catharino R R.J.Agric.FoodChem.,2009,57(10):4030-4034.
[2] Gerber M,Thiébaut A,Astorg P,Clavel-Chapelon F,Combe N.Eur.J.LipidSci.Technol.,2005,107(7/8):540-559.
[3] Judé S,Roger S,Martel E,Besson P,Richard S,Bougnoux P,Champeroux P,Le Guennec J Y.Prog.Biophys.Mol.Bio.,2006,90(1):299-325.
[4] Yang Y,Ferro M D,Cavaco I,Liang Y.J.Agric.FoodChem.,2013,61(15):3693-3702.
[5] Sales C,Cervera M I,Gil R,Portolés T,Pitarch E,Beltran J.FoodChem.,2017,216(Suppl C):365-373.
[6] Azizian H,Kramer J K G.Lipids,2005,40(8):855-867.
[7] Wu Z,Rodgers R P,Marshall A G.J.Agric.FoodChem.,2004,52(17):5322-5328.
[8] Liu X P,Wang H Y,Guo Y L.J.Instrum.Anal.(刘小潘,王昊阳,郭寅龙.分析测试学报),2017,36(1):37-41.
[9] Calvano C D,Ceglie C D,D’Accolti L,Zambonin C G.FoodChem.,2012,134(2):1192-1198.
[10] Gidden J,Liyanage R,Durham B,Lay J O.RapidCommun.MassSpectrom.,2007,21(13):1951-1957.
[11] McAnoy A M,Wu C C,Murphy R C.J.Am.Soc.MassSpectrom.,2005,16(9):1498-1509.
[12] Catharino R R,Haddad R,Cabrini L G,Cunha I B S,Sawaya A C H F,Eberlin M N.Anal.Chem.,2005,77(22):7429-7433.
[13] Cozzolino R,De Giulio B.Eur.J.LipidSci.Technol.,2011,113(2):160-167.
[14] García-Reyes J F,Mazzoti F,Harper J D,Charipar N A,Oradu S,Ouyang Z,Sindona G,Cooks R G.RapidCommun.MassSpectrom.,2009,23(19):3057-3062.
[15] Vaclavik L,Belkova B,Reblova Z,Riddellova K,Hajslova J.FoodChem.,2013,138(4):2312-2320.
[16] Byrdwell W C,Neff W E.RapidCommun.MassSpectrom.,2002,16(4):300-319.
[17] Picariello G,Romano R,Addeo F.Anal.Chem.,2010,82(13):5783-5791.
[18] Park K H,Kim H J.RapidCommun.MassSpectrom.,2001,15(16):1494-1499.
[19] Calvano C D,Palmisano F,Zambonin C G.RapidCommun.MassSpectrom.,2005,19(10):1315-1320.
[20] Calvano C D,Aresta A,Palmisano F,Zambonin C G.Anal.Bioanal.Chem.,2007,389(7):2075-2084.
[21] Yin Z,Wang X,Li W,He M,Hang W,Huang B.Anal.Chem.,2014,86:6372-6378.
[22] Ayorinde F O,Elhilo E,Hlongwane C.RapidCommun.MassSpectrom.,1999,13(8):737-739.
[23] Ng T T,So P K,Zheng B,Yao Z P.Anal.Chim.Acta,2015,884:70-76.
[24] Yin Z,Xu Z,Liu R,Hang W,Huang B.Anal.Chem.,2017,89:7455-7461.
[25] Hanley L,Kornienko O,Ada E T,Fuoco E,Trevor J L.J.MassSpectrom.,1999,34(7):705-723.
[26] Zhang Y L,Pei X L,Gong C,Han Y L,Ni T Q,Wang F,Wang S J,Lu H P,Xu X.Chin.J.Anal.Chem.(张耀利,裴兴丽,龚灿,韩玉良,倪天强,王帆,王盛君,卢海鹏,许旭.分析化学),2017,45(2):183-190.
[27] Badu M,Awudza A M.J.Int.J.FoodProp.,2017,20(2):271-280.
[28] Kubo A,Satoh T,Itoh Y,Hashimoto M,Tamura J,Cody R B.J.Am.Soc.MassSpectrom.,2013,24(5):684-689.
[29] Li X,Yang T,Li S,Wang D,Guan D.Appl.Spectrosc.,2015,69(11):1334-1341.
[30] Chen Y,Chang B H W,Ding X,He M.Sci.Rep.,2016,6(37636):1-8.
