双Schiff-Base取代的3,5-二(芳亚甲基)-4-哌啶酮衍生物的合成及活性研究
2018-05-10姚彬荣刘方正王春华侯桂革
姚彬荣,刘方正,刘 岩,杨 威,侯 迷,陈 琴,王春华,侯桂革
(滨州医学院 药学院,山东 烟台 264003)
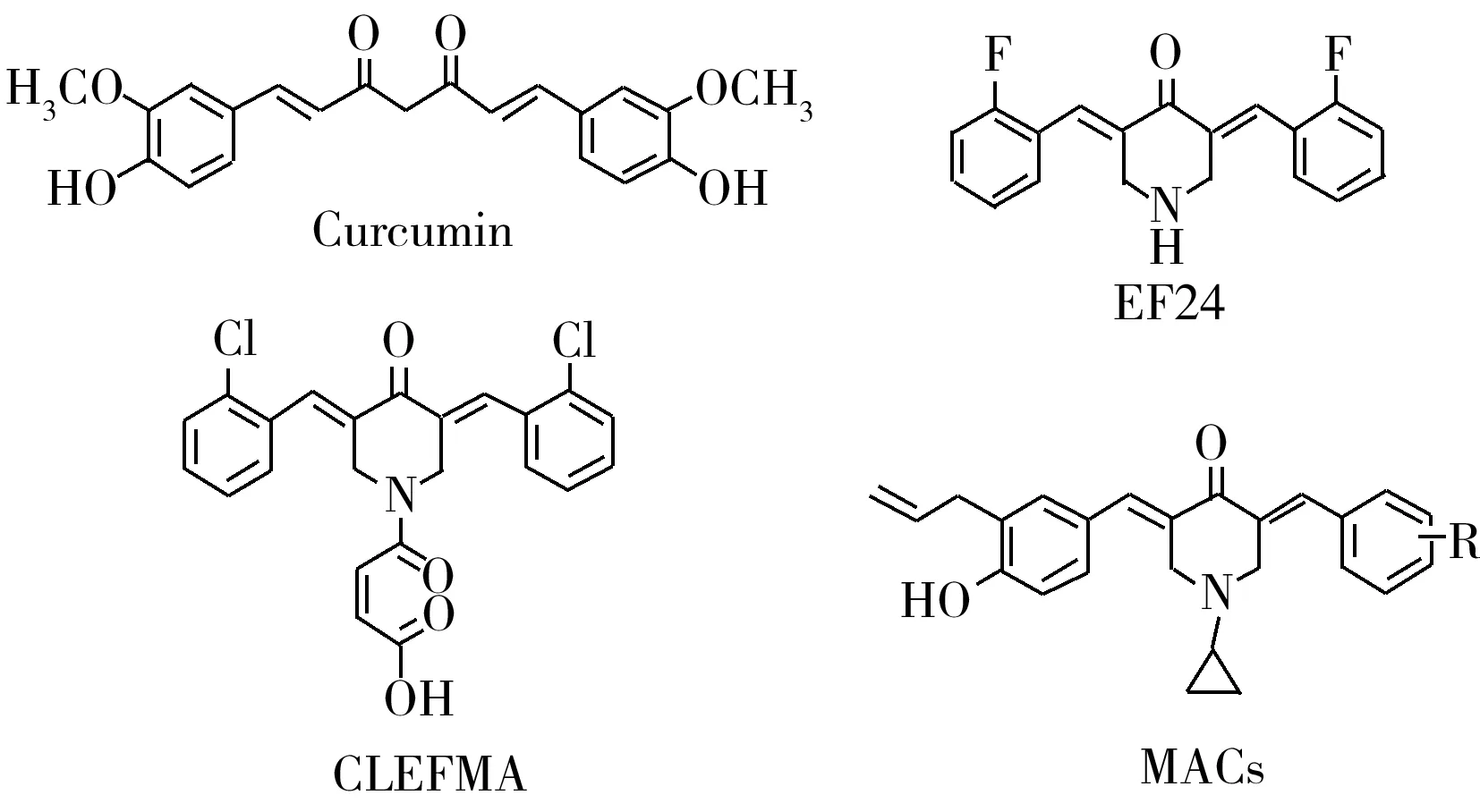
图1 3,5-二(芳亚甲基)-4-哌啶酮衍生物的结构Fig.1 Structures of 3,5-bis(arylidene)-4-piperidone derivatives
近年来医疗技术得到迅猛发展,但肿瘤仍是具有挑战性的健康问题。姜黄素已被证实具有较好的抗肿瘤活性,但其化学结构不稳定、生物利用度低[1-4],因此对其重要的α,β-不饱和酮药效团进行衍生化研究具有重要意义。3,5-二(芳亚甲基)-4-哌啶酮是一类α,β-不饱和酮与β-氨基酮相结合的新型姜黄素类似物,其结构中含有两个α,β-不饱和酮药效团A,可与肿瘤细胞中的巯基发生两次连续的烷基化反应,这是此类药物与肿瘤细胞的主要结合位点,而当中心哌啶酮的氮原子被其它基团取代后,则形成一个辅助结合位点B。分子两侧的芳香基团若有其它活性基团取代,则对于整个分子与肿瘤靶点的结合更加有利,可形成辅助结合位点C。3个结合位点的协调作用,可以有效地提高分子的细胞毒活性[5-7]。Shoji等[8]研究发现,3,5-二(2-氟苯亚甲基)-4-哌啶酮(EF24,图1)在MDA-MB-231人乳腺癌细胞和DU-145人前列腺癌细胞中通过依赖氧化还原机制引起细胞周期停止和凋亡,从而发挥抗癌作用。Yadav等[9]研究了EF24在表达IL-1受体的低容血量休克的大鼠模型上的药物作用,发现EF24可有效调节IL-1受体途径。Dimmock等[10]研究发现3,5-二(芳亚甲基)-4-哌啶酮中两个芳环为构象E时抗肿瘤活性较好。Awasthi等[11]研究发现3,5-二(芳亚甲基)-4-哌啶酮衍生物(CLEFMA)能通过氧化应激机制引起肺腺癌H441细胞的自我吞噬。另外,Zhou等[12]报道了一系列不对称的3,5-二(芳亚甲基)-4-哌啶酮化合物(MACs)可通过抑制Beas-2B细胞中TNF-α、IL-6、IL-1β和VCAM-1 等炎症因子的mRNA表达起到抗炎作用,从而对急性肺损伤(ALI)具有治疗作用。
本课题组设计并合成了一系列3,5-二(芳亚甲基)-4-哌啶酮衍生物,并通过评价其对肿瘤细胞系的细胞毒性及抗肿瘤活性,筛选出部分体外抗肿瘤活性和抗多药耐药活性的化合物,进一步系统研究了该类化合物的构效关系[13-17]。研究发现,将多酚类芳醛与氨基取代的3,5-二(芳亚甲基)-4-哌啶酮缩合得到双Schiff-Base化合物,可对THP-1显示较好的抑制活性,而多卤素取代的3,5-二(芳亚甲基)-4-哌啶酮衍生物及其活性研究尚未见报道。为系统研究该类化合物的构效关系,寻找低毒高效的抗肿瘤药物,本文通过Claisen-Schmidt缩合、SnCl2/HCl还原以及Schiff-Base缩合反应得到一系列双Schiff-Base取代的3,5-二(芳亚甲基)-4-哌啶酮衍生物,并对其抗肿瘤活性进行了系统研究。
1 实验部分
1.1 试剂与仪器
N-甲基-4-哌啶酮、各种芳醛均购于国药集团化学试剂有限公司;阿霉素(DOX)购于滨州医学院烟台附属医院。Frontier FT-IR型傅立叶变换红外光谱仪(美国Perkin Elmer公司,KBr压片);Bruker DPX-400型核磁共振仪(德国Bruker公司,以CDCl3或DMSO-d6作为溶剂),SGW X-4 显微熔点仪(上海精密科学仪器有限公司)。分子对接采用SYBYL-X 2.0软件(美国Tripos公司)。
1.2 化合物3a-i的合成
于50 mL圆底烧瓶中,将N-甲基-3,5-二(3-氨基苯亚甲基)-4-哌啶酮(0.32 g,1.0 mmol)分别与2,4-二氟苯甲醛(0.29 g,2.0 mmol)、2,5-二氟苯甲醛(0.29 g,2.0 mmol)、3,5-二氟苯甲醛(0.29 g,2.0 mmol)、4-氯苯甲醛(0.28 g,2.0 mmol)、2,4-二氯苯甲醛(0.35 g,2.0 mmol)、3,4-二氯苯甲醛(0.35 g,2.0 mmol)、4-溴苯甲醛(0.37 g,2.0 mmol)、2-溴-4氟苯甲醛(0.41 g,2.0 mmol)、2-溴-3-羟基苯甲醛(0.40 g,2.0 mmol)溶于15 mL甲醇中,滴加两滴甲酸,常温下搅拌反应8 h (TLC跟踪反应进程),抽滤,水洗,干燥得黄色固体3a-i。
(3E,5E)-N-甲基-3,5-二[3-(2,4-二氟苯基亚甲基氨基)苯亚甲基]-4-哌啶酮(3a),产率70%,熔点147~149 ℃,1H NMR(400 MHz,DMSO-d6,25 ℃,TMS,ppm):δ8.75(s,2H),8.18(dd,J=15.6,8.0 Hz,2H),7.66(s,2H),7.53(t,J=7.7 Hz,2H),7.46(d,J=9.4 Hz,2H),7.44-7.37(m,4H),7.35(d,J=7.8 Hz,2H),7.26(t,J=8.0 Hz,2H),3.77(s,4H),2.40(s,3H)。13C NMR(100 MHz,CDCl3):δ186.8,165.1(dd,J=255.1,12.4 Hz),163.2(dd,J=256.5,12.3 Hz),153.0,152.0,136.3,136.0,133.6,129.5(t,J=4.1 Hz),129.4,128.2,122.9,121.2,120.4(dd,J=9.3,3.7 Hz),112.4(dd,J=21.8,3.5 Hz),104.2(t,J=25.2 Hz),57.0,45.8。IR(cm-1):2 780(br),1 674(m),1 617(s),1 587(s),1 500(s),1 428(m),1 266(m),1 221(s),1 186(s),1 138(s),1 088(s),964(s),922(m),889(m),849(s),815(m),790(s),728(m),690(s)。元素分析(%):C34H25F4N3O,理论值:C 71.95,H 4.44,N 7.40;测量值:C 71.89,H 4.45,N 7.37。
(3E,5E)-N-甲基-3,5-二[3-(2,5-二氟苯基亚甲基氨基)苯亚甲基]-4-哌啶酮(3b),产率63%,熔点146~148 ℃,1H NMR(400 MHz,DMSO-d6,25 ℃,TMS,ppm):δ8.77(s,2H),7.82(s,2H),7.66(s,2H),7.58-7.33(m,12H),3.77(s,4H),2.39(s,3H)。13C NMR(100 MHz,DMSO-d6):δ186.8,156.0(dd,J=241.3,1.6 Hz),157.5(d,J=240.5,1.5 Hz),153.9,151.5,136.2,134.8,134.6,130.1,128.9,125.2(dd,J=12.0,7.6 Hz),123.4,122.5,120.8(dd,J=24.8,9.1 Hz),118.7(dd,J=23.9,8.5 Hz),113.7(dd,J=25.1,2.9 Hz),56.7,45.7。IR(cm-1):2 780(br),1 674(m),1 622(s),1 587(s),1 486(s),1 267(m),1 245(s),1 187(s),1 156(m),1 140(m),1 100(m),954(m),895(s),804(s),791(s),731(s),690(s)。元素分析(%):C34H25F4N3O,理论值:C 71.95,H 4.44,N 7.40;测量值:C 71.99,H 4.51,N 7.48。
(3E,5E)-N-甲基-3,5-二[3-(3,5-二氟苯基亚甲基氨基)苯基亚甲基]-4-哌啶酮(3c),产率69%,熔点143~145 ℃,1H NMR(400 MHz,DMSO-d6,25 ℃,TMS,ppm):δ8.77(s,2H),7.82(s,2H),7.66(s,2H),7.58-7.29(m,12H),3.77(s,4H),2.39(s,3H)。13C NMR(100 MHz,CDCl3):δ186.8,164.1(d,J=257.0 Hz),158.6,151.8,136.3,136.0,133.6,130.6(d,J=9.1 Hz),129.4,128.3,122.8,121.5,120.4(d,J=24.7 Hz),115.5(d,J=21.5 Hz),57.1,45.9。IR(cm-1):1 674(m),1 622(s),1 587(s),1 487(s),1 436(w),1 267(m),1 246(s),1 221(m),1 187(s),1 140(m),1 100(m),966(w),916(m),895(s),805(s),791(s),732(s),690(s)。元素分析(%):C34H25F4N3O,理论值:C 71.95,H 4.44,N 7.40;测量值:C 72.02,H 4.39,N 7.45。
(3E,5E)-N-甲基-3,5-二[3-(4-氯苯基亚甲基氨基)苯亚甲基]-4-哌啶酮(3d),产率64%,熔点149~151 ℃,1H NMR(400 MHz,CDCl3,25 ℃,TMS,ppm):δ8.45(s,2H),7.86(m,6H),7.49(m,6H),7.30(m,2H),7.21(m,2H),3.82(s,4H),2.49(s,3H)。13C NMR(100 MHz,CDCl3):δ186.4,159.2,151.6,137.7,135.9,135.7,134.0,133.1,129.7,129.0,128.7,127.6,122.4,120.8,56.6,45.5。IR(cm-1):2 780(br),1 674(m),1 632(s),1 586(s),1 490(s),1 283(s),1 245(m),1 184(s),1 155(m),1 088(s),974(s),953(m),913(m),860(m),826(s),795(s),691(s)。元素分析(%):C34H27Cl2N3O,理论值:C 72.34,H 4.82,N 7.44;测量值:C 72.30,H 4.77,N 7.49。
(3E,5E)-N-甲基-3,5-二[3-(2,4-二氯苯基亚甲基氨基)苯亚甲基]-4-哌啶酮(3e),产率68%,熔点164~166 ℃,1H NMR(400 MHz,CDCl3,25 ℃,TMS,ppm):δ8.88(s,2H),8.23(d,J=8.5 Hz,2H),7.89(s,2H),7.49(m,4H),7.38(d,J=8.4 Hz,2H),7.31(d,J=7.5 Hz,2H),7.25(m,4H),3.87(s,4H),2.51(s,3H)。13C NMR(100 MHz,CDCl3):δ186.3,156.0,151.4,137.5,136.3,135.9,135.6,133.2,131.2,129.4,129.1,129.1,128.0,127.3,122.5,121.1,56.7,45.5。IR(cm-1):1 671(m),1 616(s),1 584(s),1 471(m),1 287(m),1 189(s),1 134(m),1 098(s),972(m),957(w),921(m),890(w),866(s),821(m),792(m),690(s)。元素分析(%):C34H25Cl4N3O,理论值:C 64.47,H 3.98,N 6.63;测量值:C 64.49,H 3.90,N 6.59。
(3E,5E)-N-甲基-3,5-二[3-(3,4-二氯苯基亚甲基氨基)苯亚甲基]-4-哌啶酮(3f),产率72%,熔点107~109 ℃,1H NMR(400 MHz,DMSO-d6,25 ℃,TMS,ppm):δ8.70(s,2H),8.17(s,2H),7.94(d,J=8.1 Hz,2H),7.82(d,J=8.2 Hz,2H),7.66(s,2H),7.55(t,J=7.6 Hz,2H),7.41(d,J=12.2 Hz,4H),7.35(d,J=7.7 Hz,2H),3.78(s,4H),2.41(s,3H)。13C NMR(100 MHz,CDCl3):δ186.4,159.4,151.1,136.5,135.7,134.4,134.2,134.0,131.8,131.3,130.3,129.7,128.5,128.4,123.1,122.0,56.3,45.3。IR(KBr Pellet cm-1):1 671(m),1 613(s),1 583(s),1 470(s),1 279(s),1 206(m),1 183(s),1 127(m),1 058(m),975(w),909(w),821(m),788(m),699(s)。元素分析(%):C34H25Cl4N3O,理论值:C 64.47,H 3.98,N 6.63;测量值:C 64.43,H 4.05,N 6.67。
(3E,5E)-N-甲基-3,5-二[3-(4-溴苯基亚甲基氨基)苯亚甲基]-4-哌啶酮(3g),产率68%,熔点147~149 ℃,1H NMR(400 MHz,CDCl3,25 ℃,TMS,ppm):δ8.43(s,2H),7.86(s,2H),7.81(d,J=8.0 Hz,4H),7.65(d,J=8.0 Hz,4H),7.47(t,J=7.5 Hz,2H),7.29(d,J=10.4 Hz,2H),7.22(m,4H),3.82(s,4H),2.49(s,3H)。13C NMR(100 MHz,CDCl3):δ186.4,159.3,151.5,135.9,135.7,134.4,133.1,131.7,129.8,129.0,127.2,125.8,122.4,120.8,56.6,45.4。IR(cm-1):1 673(m),1 623(s),1 585(s),1 486(s),1 284(s),1 207(m),1 183(s),1 097(s),974(m),953(m),912(m),885(m),856(m),814(s),795(s),690(s)。元素分析(%):C34H27Br2N3O,理论值:C 62.50,H 4.17,N 6.43;测量值:C 62.46,H 4.15,N 6.38。
(3E,5E)-N-甲基-3,5-二[3-(2-溴-4-氟苯基亚甲基氨基)苯亚甲基]-4-哌啶酮(3h),产率67%,熔点134~136 ℃,1H NMR(400 MHz,CDCl3,25 ℃,TMS,ppm):δ8.82(s,2H),8.28(dd,J=8.5,6.5 Hz,2H),7.87(s,2H),7.49(t,J=8.0 Hz,2H),7.40(dd,J=8.0,1.9 Hz,2H),7.32(d,J=7.6 Hz,2H),7.26(s,4H),7.18(dd,J=11.7,4.6 Hz,2H),3.83(s,4H),2.50(s,3H)。13C NMR(100 MHz,CDCl3):δ186.8,164.1(d,J=257.1 Hz),158.7,151.8,136.3,136.0,133.6,130.8(d,J=3.4 Hz),130.6(d,J=9.0 Hz),129.4,128.3,126.5(d,J=9.8 Hz),122.8,121.6,120.4(d,J=24.7 Hz),115.5(d,J=21.5 Hz),57.1,45.9。IR(cm-1):1 671(m),1 616(m),1 586(s),1 484(s),1 282(m),1 217(s),1 189(s),1 061(m),975(m),956(m),920(m),889(m),855(s),823(m),787(s),690(s)。元素分析(%):C34H25Br2F2N3O,理论值:C 59.24,H 3.66,N 6.10;测量值:C 59.26,H 3.57,N 6.13。
(3E,5E)-N-甲基-3,5-二[3-(2-溴-3-羟基苯基亚甲基氨基)苯亚甲基]-4-哌啶酮(3i),产率为71%,熔点137~139 ℃,1H NMR(400 MHz,DMSO-d6,25 ℃,TMS,ppm):δ10.59(s,2H),8.86(s,2H),7.66(s,2H),7.61(d,J=7.5 Hz,2H),7.54(t,J=7.6 Hz,2H),7.42(d,J=7.5 Hz 2H),7.30(m,6H),7.14(d,J=7.8 Hz,2H),3.79(s,4H),2.41(s,3H)。13C NMR(100 MHz,DMSO-d6):δ192.2,160.6,154.6,151.7,135.8,135.1,134.4,134.2,129.8,128.7,128.3,122.7,121.9,119.1,118.8,113.7,56.4,45.3。IR(cm-1):3 085(br),1 666(w),1 602(s),1 565(s),1 460(m),1 425(m),1 298(s),1 218(s),1 182(s),1 026(m),940(m),918(m),889(m),826(m),785(m),687(s)。元素分析(%):C34H27Br2N3O3,理论值:C 59.58,H 3.97,N 6.13;测量值:C 59.63,H 3.94,N 6.15。
1.3 抗肿瘤活性测试
选用9种肿瘤细胞系:SGC-7901(胃癌细胞)、A549(肺癌细胞)、HCT116(结肠癌)、HeLa(宫颈癌细胞)、HePG2(肝癌细胞)、K562(人慢性骨髓性白血病细胞)、THP-1(人急性单核粒细胞白血病细胞)、U937(组织细胞淋巴瘤细胞)、MCF-7(乳腺癌细胞)。1种正常细胞株:LO2(人正常肝细胞)。采用MTT法进行活性测试:取1×104/100 μL的细胞,接种于96孔培养板中,于37 ℃、5%CO2下培养24 h,加入一定浓度梯度的合成化合物,继续培养24 h。将96孔板中的溶液除去,加入已配制的MTT溶液200 μL (培养基∶MTT=9∶1,体积比),37 ℃孵育4 h,弃上清液,加入150 μL DMSO 37 ℃摇床孵育10 min,用酶标仪测定其在570 nm处的吸光度,计算IC50。合成化合物及阳性对照DOX的浓度梯度为10、5、2.5、1.25、0.625、0.312 5、0.156 25、0.078、0.039、0.019 5 μg/mL。
1.4 分子对接模拟
3b、3i对接入Bcl-2(PDB:1YSW)蛋白结构。分子对接选用SYBYL-X 2.0软件(Triops公司)的Surflex-Dock 模块,所有对接操作在SYBYL-X 2.0药物设计软件中的Surflex-Dock程序下按默认值完成。配体小分子3b、3i均在Chem3D中形成3D构象,采用Tripos力场分子力学程序Minimize进行结构优化,负载Gasteiger-Hückel电荷,以Powl能量梯度法进行能量优化,优化后得到稳定构象[18]。通过PyMol和Ligplus分析两者对接的结合方式和相互作用力。
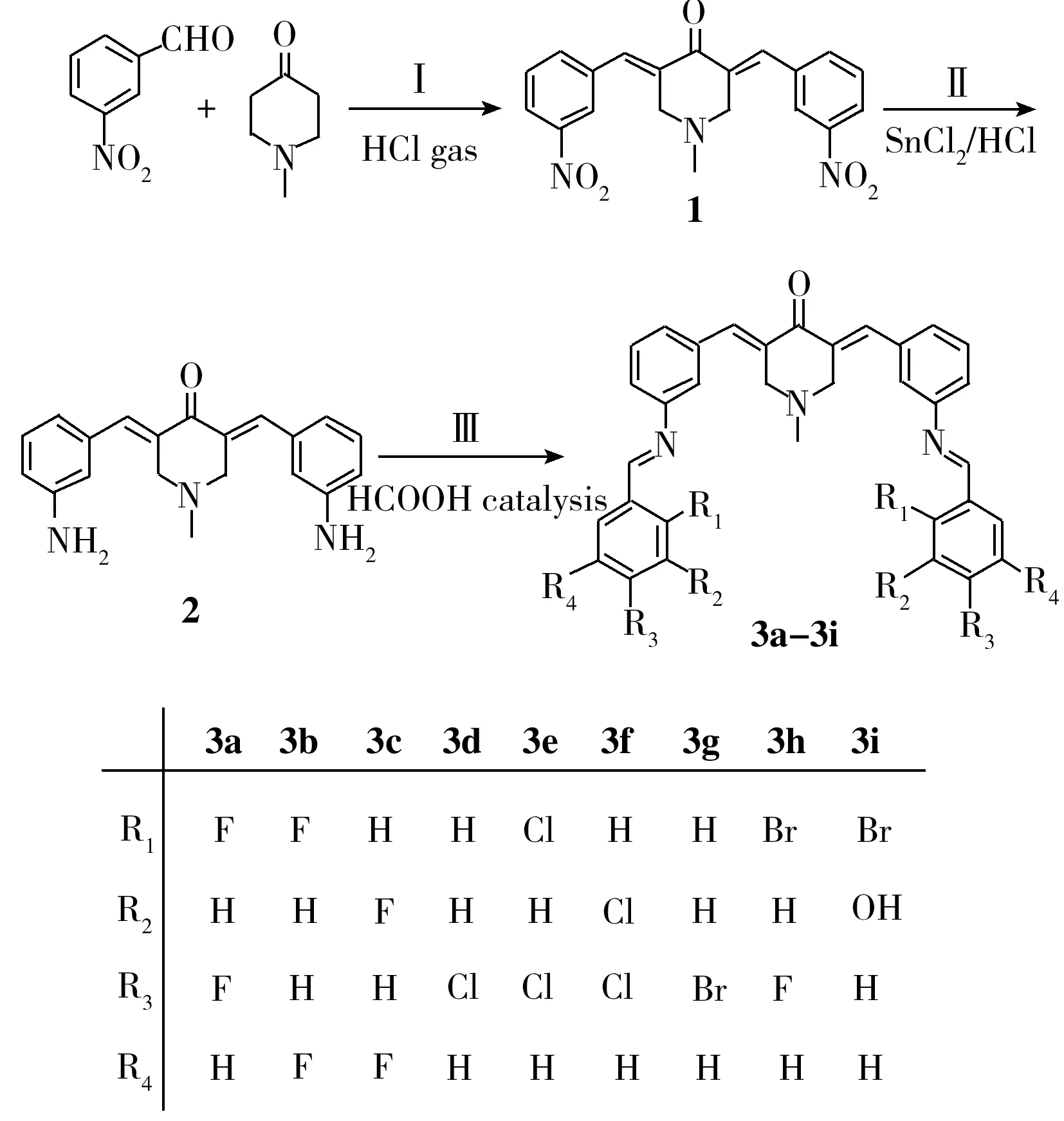
图2 3a-i的合成和结构Fig.2 Synthesis and structures of 3a-i
2 结果与讨论
2.1 化学部分
本文以N-甲基-4-哌啶酮和3-硝基苯甲醛为原料,通过Claisen-Schmidt缩合反应得到N-甲基-3,5-二(3-硝基苯亚甲基)-4-哌啶酮中间体1;然后,用SnCl2/盐酸还原得到N-甲基-3,5-二(3-氨基基苯亚甲基)-4-哌啶酮中间体2;最后,与一系列卤代苯甲醛通过Schiff-Base缩合反应得到3a-i(图2),产率为64%~72%。中间体1和2的谱图数据与文献一致[16-17]。化合物3a-i利用NMR、IR、元素分析等手段进行结构表征,结果显示其在DMSO、DMF、二氯甲烷、丙酮、甲醇、乙醇中有较好的溶解度,但几乎不溶于水。
2.2 抗肿瘤活性分析
本文采用MTT法,评价药物对SGC-7901、A549、HCT116、HeLa、HePG2、K562、THP-1、U937、MCF-7等细胞系的抗肿瘤活性及对LO2的细胞毒性。从表1得知,3a-i对上述9种肿瘤细胞均表现出显著的抑制活性,部分化合物对某些细胞的IC50值小于1.0 μmol/L。3a-i对SGC-7901细胞的抑制活性明显优于阳性对照药DOX(阿霉素,IC50=7.37±0.59 μmol/L),特别是具有双F取代基的化合物3a和具有间Br取代基的化合物3g的IC50值仅为(2.25±0.37) μmol/L和(2.03±0.12) μmol/L,更有意义的是,3a对LO2的IC50值可达(12.53±0.94) μmol/L,比DOX的IC50值(10.32±0.92 μmol/L)略大。对于A549细胞,具有双F取代基的化合物3a(1.33±0.05 μmol/L)和3b(1.46±0.30 μmol/L)的活性明显优于其他化合物,且比DOX(3.83±0.16 μmol/L)的活性更好。对于HCT116细胞,化合物3b和3f的活性在这一系列化合物中最好,且活性优于DOX(10.87±2.53 μmol/L);对于HeLa细胞,化合物的活性几乎与DOX相当,其中具有双F取代基的化合物3a-c活性优于其他化合物,特别是3c(1.75±0.16 μmol/L)的活性最好;对于HePG2细胞,除了3e的抑制活性较差外,IC50值达(7.14±0.46) μmol/L,其他化合物的抑制活性明显优于DOX,并且化合物3i的活性最佳,IC50值仅为(1.09±0.18) μmol/L。对K562细胞,3a、3d、3f、3i的IC50值小于1.0 μmol/L,表现出较强的抑制活性。对THP-1细胞,3a、3b、3f、3i化合物表现出较强的抑制活性,其IC50值均小于1.0 μmol/L。其中具有双F取代基的化合物3b的IC50值为(0.31±0.01) μmol/L,低于DOX。其它化合物对THP-1的抑制活性劣于DOX。对U937细胞,邻-Br取代的化合物3h和3i的抑制活性较好,优于DOX;对MCF-7细胞,该类化合物的IC50值较大,抑制活性明显次于DOX。对LO2的细胞毒性分析显示,化合物3a,d-f的细胞毒性较小,它们的IC50值比DOX更大,并且细胞毒性明显低于文献报道的结构相似的化合物[16-17]。另外,对于化合物3g-i,化合物3i抑制肿瘤细胞的活性较好,这可能与化合物3i中的酚羟基具有潜在的抗氧化、清除活性自由基的作用密不可分。结构分析显示,具有双F取代基的化合物3a-c的抑制活性相对其他化合物好,说明氟取代对于双Schiff-Base取代的3,5-二(芳亚甲基)-4-哌啶酮衍生物的抗肿瘤活性有利。
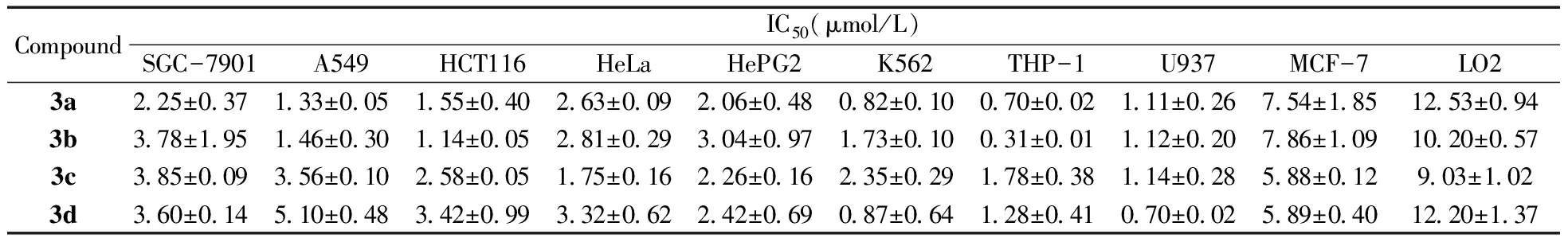
表1 抗肿瘤活性和细胞毒性Table 1 Antitumor activity and cytotoxicity
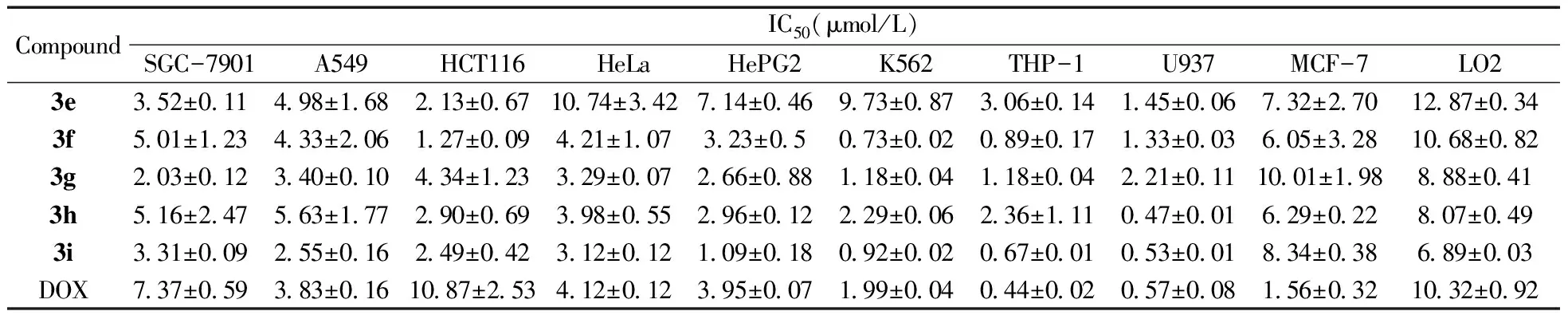
(续表1)
2.3 对Bcl-2及BAX表达的影响
抗凋亡因子Bcl-2和促凋亡因子BAX是引起细胞凋亡的重要基因,Bcl-2能够阻止细胞色素c从线粒体释放到细胞质,从而抑制细胞凋亡而导致肿瘤的产生,而BAX的过度表达可拮抗Bcl-2的保护效应而使细胞趋于死亡[19-20]。Anant等[21]研究发现,低剂量的EF24能有效抑制抗凋亡基因Bcl-xL和Bcl-2的表达,但不影响促进肿瘤细胞凋亡基因BAX的表达,从而导致Bcl-xL/BAX和Bcl-2/BAX的蛋白比例呈下降趋势。如图3所示,化合物3a-c和3i能有效降低Bcl-2的表达和升高BAX的表达。
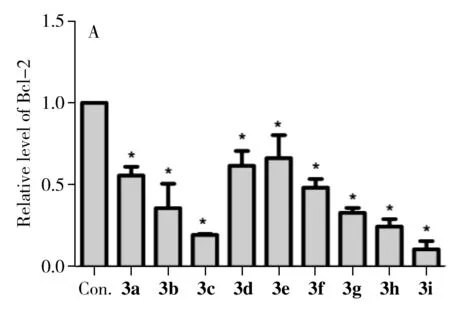
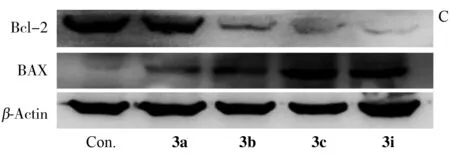
图3 qPCR检测化合物3a-i对THP-1细胞中Bcl-2(A)和BAX(B)蛋白基因表达的影响,以及Western Blot验证3a-c和3i对Bcl-2和BAX蛋白表达的影响Fig.3 Effect of compounds 3a-i on the expression level of resistance gene Bcl-2 (A) and BAX (B) detected by qPCR and Western Blot (C)the control is THP-1 untreated with any compounds(未用药物处理的THP-1作为空白对照)
2.4 分子对接
Bcl-2蛋白是重要的抗肿瘤药物作用靶点[19-20],抑制剂与Bcl-2结合的重要驱动力分别是疏水作用力和氢键相互作用力(图4中虚线所示)。P1、P2口袋是Bcl-2(PDB:1YSW)蛋白中活性腔内较大的两个口袋,P3、P4是活性腔两端较小的两个口袋,而L1是一个相对较窄的P1和P2连接部位。如图4A所示,化合物3b的两个2,5-二氟苯亚氨基能与P1和P2口袋相吻合,而中心的3,5-二(芳亚甲基)-4-哌啶酮基团穿越L1连接部位,与Bcl-2蛋白上的ARG-143片段形成强的氢键(图4B中虚线所示),Pro-43等氨基酸残基与化合物3b形成12个疏水键[22](图4C中弧形锯齿线所示)。而化合物3i因末端有酚羟基,与GLY-142形成稳定的氢键(图4D和图4E中虚线所示),与Pro-42等氨基酸残基形成10个疏水键(图4F中弧形锯齿线所示),分子中心的3,5-二(芳亚甲基)-4-哌啶酮基团则与P1口袋结合,另一侧的端基2-溴-3-羟基苯亚氨基基团则与P4口袋结合,从而表现出较好的抑制活性。
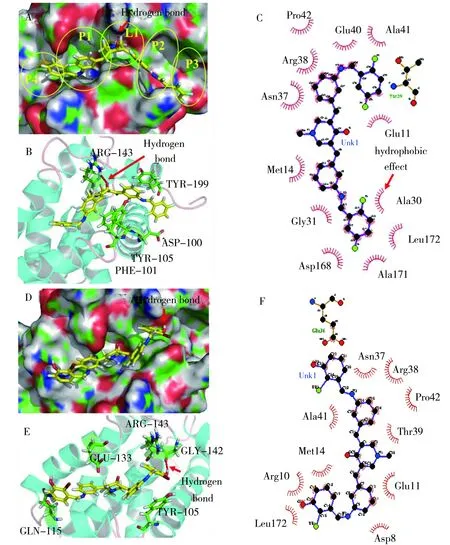
图4 化合物3b (A、B、C)和3i (D、E、F)与Bcl-2(PDB:1YSW)蛋白的对接模型Fig.4 Molecular docking mode of compound 3b (A,B,C) and 3i (D,E,F) in the active site of Bcl-2 protein
3 结 论
本文合成了一系列双Schiff-Base取代的3,5-二(芳亚甲基)-4-哌啶酮衍生物3a-i。此类化合物对SGC-7901、A549、HCT116、HeLa、HePG2、K562、THP-1、U937、MCF-7等肿瘤细胞显示出显著的抑制活性。部分化合物对某些细胞的IC50值小于1.0 μmol/L。另外,化合物3a、d-f对LO2的细胞毒性比DOX小。构效关系显示,F取代的化合物3a-c活性优于Br和Cl取代的化合物3d-i。分子对接模型证实化合物3b和3i对Bcl-2蛋白有显著的抑制作用。
参考文献:
[1] Sun A,Lu Y J,Hu H,Shoji M,Liotta D C,Snyder J P.Bioorg.Med.Chem.Lett.,2009,19:6627-6631.
[2] Tan X,Sidell N,Mancini A,Huang R P,Wang S M,Horowitz I R,Liotta D C,Taylor R N,Wieser F.Reprod.Sci.,2010,17:931-940.
[3] Liu W S,Chen Q,Sun J F,Wang C H,Zhao F,Hou G G.J.Instrum.Anal.(刘文帅,陈琴,孙居锋,王春华,赵峰,侯桂革.分析测试学报),2015,34(8):900-904.
[4] Wu J,Weng B,Qiu P,Cai Z,Fan L,Ying S,Zhang X,Wu X,Liang G.Chin.J.Org.Chem.,2014,34:1573-1581.
[5] Thomas S L,Zhong D,Zhou W,Malik S,Liotta D,Snyder J P,Hamel E,Giannakakou P.CellCycle.,2008,7:2409-2417.
[6] Kasinski A L,Du Y,Thomas S L,Zhao J,Sun S Y,Khuri F R,Wang C Y,Shoji M,Sun A,Snyder J P,Liotta D,Fu H.Mol.Pharmacol.,2008,74:654-661.
[7] Sun J F,Zhang S,Yu C,Hou G G,Zhang X F,Li K K,Zhao F.Chem.Biol.Drug.Des.,2014,83:392-400.
[8] Adams B K,Ferstl E M,Davis M C,Herold M,Kurtkaya S,Camalier R F,Hollingshead M G,Kaur G,Sausville E A,Rickles F R,Snyder J P,Liotta D C,Shoji M.Bioorg.Med.Chem.,2004,12:3871-3883.
[9] Yadva V,Vilekar P,Awasthi S,Awasthi V.ArtificialOrgans.,2014,38:675-683.
[10] Das U,Sakagami H,Chu Q,Wang Q,Kawase M,Selvakumar P,Sharma R K,Dimmock J R.Bioorg.Med.Chem.Lett.,2010,20:912-917.
[11] Lagisetty P,Vilekar P,Sahoo K,Anant S,Awasthi V.Bioorg.Med.Chem.,2010,18:6109-6120.
[12] Zhu H P,Xu T T,Qiu C Y,Wu B B,Zhang Y L,Chen L F,Xia Q Q,Li C L,Zhou B,Liu Z G,Liang G.Eur.J.Med.Chem.,2016,121:181-193.
[13] Liu L D,Liu S L,Liu Z X,Hou G G.J.Mol.Struct.,2016,1112:1-8.
[14] Sun J F,Hou G G,Zhao F,Cong W,Li H J,Liu W S,Wang C H.Chem.Biol.Drug.Des.,2016,88:534-541.
[15] Sun J F,Wang S W,Li H J,Jiang W G,Hou G G,Zhao F,Cong W.J.EnzymeInhib.Med.Chem.,2016,31:495-502.
[16] Chen Q,Hou Y,Hou G G,Li N,Cong W,Zhao F,Li H J,Wang C H,Sun J F.J.Chem.Res.,2016,40:400-403.
[17] Chen Q,Hou Y,Hou G G,Sun J F,Li N,Cong W,Zhao F,Li H J,Wang C H.Res.Chem.Intermediat.,2016,42:8119-8130.
[18] Jain A N.J.Med.Chem.,2003,46(4):499-511.
[19] Wan Y,Wu S,Xiao G,Liu T,Hou X,Chen C,Guan P,Yang X,Fang H.Bioorg.Med.Chem.,2015,23:1994-2003.
[20] Adams J M,Cory S.Science,1998,281:1322-1326.
[21] Subramaniam D,May R,Sureban S M,Lee K B,George R,Kuppusamy P,Ramanujam R P,Hideg K,Dieckgraefe B K,Houchen C W,Anant S.CancerRes.,2008,68:1962-1969.
[22] Cheng G,Zhang G C,Ma L,Tian S X,Zhang X Y.J.HunanAgric.Univ.(程功,张国财,马玲,田树新,张星耀.湖南农业大学学报),2016,42(3):262-267.
