不同有机氮源对发酵法生产肌苷影响的研究
2018-05-10张晓红陈亭亭
何 峰,李 科,张晓红,陈亭亭,杨 薇,项 俊*
(1.经济林木种质改良与资源综合利用湖北省重点实验室,湖北 黄冈 438000;2.大别山特色资源开发湖北省协同创新中心,湖北 黄冈 438000)
肌苷又名次黄嘌呤核苷(inosine,IR),学名9-β-D-吠喃核糖次黄嘌呤核苷,是一类由次黄嘌呤与核糖形成的核苷类化合物。其分子式为C10H12NO5,分子质量为268.23[1]。在食品工业中,肌苷是合成5′-肌苷酸二钠(disodiumeinosine-5′-monophosphate,IMP)最重要的前体物质,而5′-肌苷酸二钠和5′-鸟苷酸二钠(I+G)是新一代安全的增鲜剂与营养剂——鸡精的主要成分,广泛应用于食品工业中[2-4]。肌苷是在人体中发现的化合物,在遗传密码正确翻译时必不可少[5-7]。在医药工业中,肌苷参与人体的能量代谢和物质代谢,是仅有的可以代替人类自身三磷酸腺苷(adenosine triphosphate,ATP)的药物。肌苷也是多种抗病毒核苷类药物的前体物质。在医疗方面主要用于医治白细胞和血小板的减少、活化肝功能、提高细胞内ATP水平等[8],可以治疗肝脏、心脏、血细胞以及视网膜等方面的疾病[9]。
肌苷的生产方法有菌体自溶法、发酵法和酶水解核糖核酸(ribonucleic acid,RNA)法,由于菌体自溶法和酶水解RNA法产量低,提取困难,而发酵法具有周期短、易控制、易提取和成本低的优点。因此,厂家大多采用发酵法生产肌苷[10-12]。
目前,发酵法生产肌苷采用的菌种多为经过基因工程改造的枯草芽孢杆菌(Bacillus subtilis)[13],其对营养物质的要求非常高,稍有变化,就会大大影响肌苷的发酵水平和发酵产量的稳定性。绝大多数生产企业采用淀粉水解后的葡萄糖作为碳源,无机盐是市售工业级产品,这些发酵培养基的组分参数比较容易控制。相对而言,不同生产企业采用的有机氮源各不相同,即使是同一氮源不同厂家的产品技术参数也有差异,而生产企业在采购有机氮源时往往容易忽视其差异性,从而导致肌苷发酵过程及肌苷产量的不稳定[14]。
本试验以枯草芽孢杆菌(B.subtilis)HX1026为研究对象,选择大豆蛋白胨、酵母粉、玉米浆干粉和豆粕水解液为有机氮源,考察不同有机氮源对菌株HX1026发酵过程中生物量、残糖含量和肌苷产量的影响,确定最适合菌株HX1026发酵生产肌苷的有机氮源;通过20 L发酵罐进行验证实验,并监测菌株HX1026发酵过程中肌苷晶体的形成过程,以期为大规模发酵生产肌苷过程中制定有机氮源的选择标准奠定基础,确保发酵过程中肌苷产量的稳定性。
1 材料与方法
1.1 材料与试剂
枯草芽孢杆菌(B.subtilis)HX1026:由菌株ATCC13952经过基因工程改造并多次诱变选育得到,现保藏于黄冈师范学院生命科学学院。
葡萄糖:市售淀粉在实验室中自行水解制备,水解后葡萄糖含量为32.5%;KH2PO4、FeSO4、MgSO4(均为分析纯):国药集团化学试剂有限公司;大豆蛋白胨(soybean peptone,SP):山东青州市启迪生物科技有限公司;豆粕水解液(soybean meal hydrolyzate,SMH):购买市售饲料级豆粕在实验室中自行水解制备;工业豆粕水解液:分别购于山东、河南、湖北,编号为山东1号、山东2号、河南1号、湖北1号;酵母粉(yeast powder,YP)、酵母抽提物:安琪酵母股份有限公司;玉米浆干粉(corn steep liquor powder,CP):上海西王淀粉糖有限公司。
种子培养基:淀粉水解葡萄糖2%,酵母抽提物1%,硫酸铵0.5%,氯化钠0.5%,磷酸二氢钾0.3%,0.1MPa灭菌20min,灭菌后pH值6.8~7.0。
发酵基本培养基:葡萄糖20%,硫酸铵1%,磷酸二氢钾0.3%,硫酸镁0.5%,腺苷0.025%。在摇瓶培养过程中采用0.1 MPa灭菌20 min,灭菌后pH值6.8~7.0。在发酵罐培养过程中采用原位灭菌,灭菌后pH值6.8~7.0。
有机氮源采用不同浓度梯度的大豆蛋白胨、酵母粉、玉米浆干粉和豆粕水解液。
1.2 仪器与设备
20 L自动控制发酵罐:德国B.Braun公司;Agilent 1260 Infinity II高效液相色谱仪(high performance liquid chromatography,HPLC):美国安捷伦科技有限公司;B5100紫外分光光度计:上海精密科学仪器有限公司;5B-6D型智能型氨基酸态氮测定仪(V8版):北京连华环保科技;Basler Power Pack显微镜相机:德国Basler公司;SKD-1000凯氏定氮仪:上海沛欧分析仪器有限公司;SGD-Ⅳ型全自动还原糖测定仪:山东省科学院生物技术研究中心;ZWYR-2102C立式双层恒温摇床:上海智城分析仪器制造有限公司。
1.3 实验方法
1.3.1 发酵法制备肌苷工艺流程
将斜面B.subtilis HX1026种子活化后接种至摇瓶中,200 r/min、30℃恒温培养36 h,培养过程中在波长600 nm处检测培养液的光密度(optical density,OD),当OD600nm达到0.5~0.6时,以5%的接种量接种至发酵培养基中,200r/min、30℃恒温培养60 h。
1.3.2 检测方法
采用凯氏定氮法测定氮源的总氮[15];高效液相色谱法测定肌苷含量[16-18];采用分光光度法测定菌体生物量,以OD600nm值表示[19]。发酵液中糖含量用残糖(residual sugar,RS)表示,并采用SGD-Ⅳ型全自动还原糖测定仪测定其含量[20];采用甲醛滴定法检测氨基酸态氮[21]。
1.3.3 有机氮源对菌株HX1026肌苷产量的影响
选取4种氮源:大豆蛋白胨、酵母粉、玉米浆干粉和自制豆粕水解液,总氮含量分别为8.0%、7.2%、4.5%和3.0%。每种氮源分别设置3种不同的浓度梯度,每种浓度梯度的不同氮源的总氮是相同的。分别添加到发酵培养基中进行摇瓶发酵,通过比较在总氮相同的情况下,检测不同种类、不同浓度的氮源对应的肌苷产量,以确定最适有机氮源及其添加浓度。实验方案见表1。

表1 不同种类、浓度的氮源Table 1 Different types and concentrations of nitrogen sources
1.3.4 有机氮源对菌株HX1026生物量和残糖含量的影响
分别选取1.3.3节中肌苷产量最高的氮源浓度添加到发酵培养基中,在其他培养基组分、培养条件不变的情况下,在发酵过程中,每4 h测定菌体生物量、发酵液中残糖含量,考察不同种类的氮源对菌株HX1026生长的影响以及菌株HX1026发酵过程中利用糖的情况。
1.3.5 不同厂家豆粕水解液对肌苷产量的影响
选择山东1号、山东2号、河南1号、湖北1号4个编号的工业豆粕水解液,测定其总氮、氨基酸态氮、氨基酸态氮/总氮,并以1.3.3节中确定的肌苷产量最高浓度的豆粕水解液作为氮源,其他条件都不变,考察4个不同厂家的豆粕水解液对肌苷产量的影响。
1.3.6 20 L发酵罐验证实验
将培养好的菌株HX1026种子按照10%的接种量接种到20 L发酵罐中进行发酵,发酵罐装液量为15 L。发酵条件为:搅拌转速800 r/min,通气量为22.5 dm3/min,培养温度30℃、发酵过程中pH 7.0,培养时间60 h。以1.3.5中选择的最佳浓度的豆粕水解液作为发酵培养的有机氮源,每4 h取样,分别检测菌体生物量、残糖含量和肌苷产量。
1.3.7 发酵过程中肌苷晶体形成过程
每4 h从发酵罐中取样,将样品涂布在载玻片上,自然风干,利用显微镜观察不同时间肌苷晶体的形成过程,进一步确认山东1号豆粕水解液是否适合于肌苷晶体形成。
2 结果与分析
2.1 有机氮源对肌苷产量的影响
考察不同有机氮源对肌苷产量的影响,结果如表2所示。由表2可知,以不同浓度的大豆蛋白胨、酵母粉、玉米浆干粉及豆粕水解液作为氮源时,肌苷的产量相差较大。当总氮相同时,豆粕水解液作为氮源,肌苷产量最高。当豆粕水解液含量为3.6%时,肌苷产量达到29.6 g/L。因此,可以选择豆粕水解液作为菌株HX1026发酵生产肌苷的最佳有机氮源。
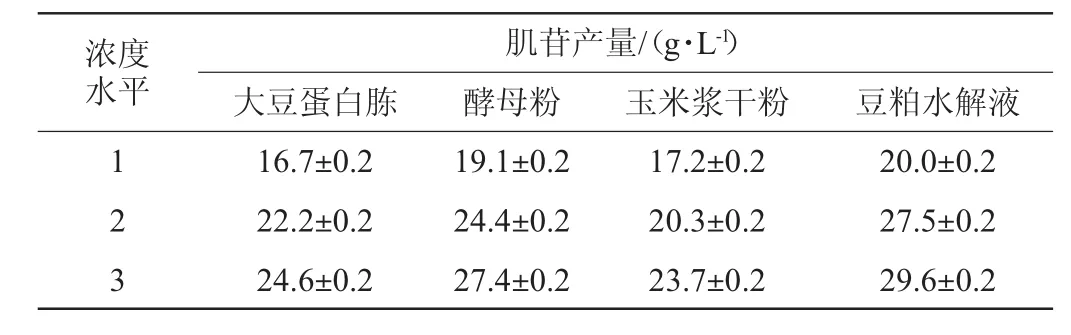
表2 不同浓度的4种有机氮源对肌苷产量的影响Table 2 Effects of four nitrogen sources with different concentrations on the yield of inosine
2.2 有机氮源对发酵过程中HX1026生物量影响
在接种量、其他培养基组分、培养条件相同的情况下,不同浓度的4种有机氮源在发酵过程中对菌体HX1026生物量的影响如图1所示。
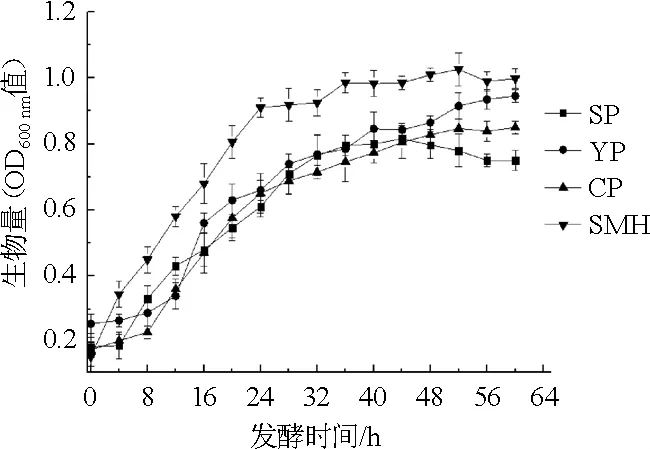
图1 不同氮源对菌株HX102生物量的影响Fig.1 Effects of different nitrogen sources on biomass of strain HX102
由图1可知,随着发酵时间的延长,各有机氮源的菌株生物量均呈先增加后逐渐趋于平稳的趋势,在0~24 h,当有机氮源为豆粕水解液时,菌体生长极为迅速,生物量(OD600nm值)快速增至0.806;而当有机氮源为大豆蛋白胨、酵母粉、玉米浆干粉时,生长相对缓慢,在24 h时对应的OD600nm值分别是0.610、0.660、0.651。且整个发酵过程中,豆粕水解液对应的OD600nm值均高于同期的其他3种氮源,说明豆粕水解液作为有机氮源更有利于菌株HX1026菌体的生长。
2.3 有机氮源对发酵过程中残糖含量的影响
不同有机氮源对发酵过程中残糖含量的影响如图2所示。
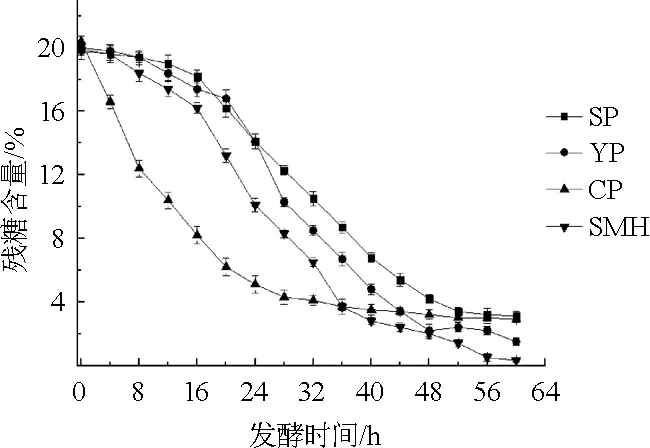
图2 不同氮源对发酵过程中残糖含量的影响Fig.2 Effects of different nitrogen sources on the residual sugar content in the fermentation process
由图2可知,除玉米浆干粉外,其他有机氮源发酵液中残糖含量随着发酵时间的延长先缓慢下降,说明菌株利用糖的速度较缓慢,当发酵至16 h后,残糖含量迅速下降,在相同发酵时间点,以豆粕水解液为氮源时,糖利用速度略快,到发酵结束时(60 h)残糖含量为0.32%,而以大豆蛋白胨和酵母粉为氮源时,残糖含量分别为3.10%和1.50%;当以玉米浆干粉作为氮源时,发酵前期(0~24 h),菌株对糖的利用速度非常快,但从32 h后糖利用速度变慢,直到发酵结束还有2.90%的残糖。因此,当以豆粕水解液作为氮源时,菌体HX1026利用糖的速度适中,糖利用充分,有利于菌株HX1026发酵生产肌苷。
2.4 4种有机氮源技术参数测定
检测4种有机氮源的总氮和氨基酸态氮含量,并计算氨基酸态氮/总氮比值,结果如表3所示。
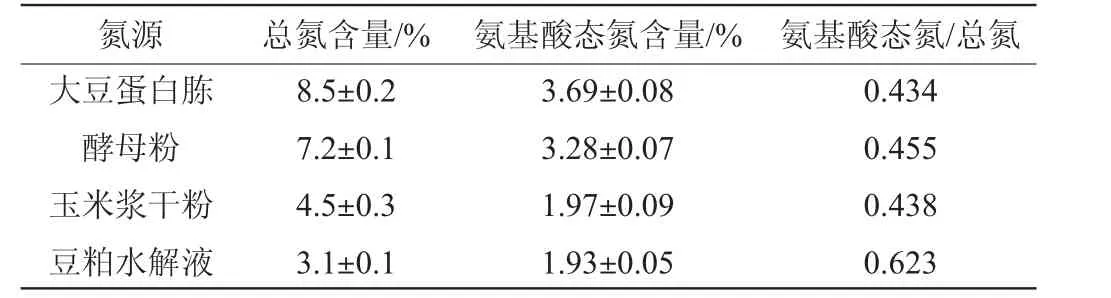
表3 4种有机氮源的氨基酸态氮和总氮含量比较Table 3 Comparison of amino acid nitrogen and total nitrogen contents of four nitrogen sources
由表3可知,尽管豆粕水解液中的总氮和氨基氮含量均低于大豆蛋白胨、酵母粉和玉米浆干粉,但豆粕水解液的氨基酸态氮/总氮比值最高,达到0.623。当培养基中总氮含量相同时,豆粕水解液作为氮源的培养基中氨基酸态氮含量最高,微生物在生长时优先利用氨基酸态氮,这可能是菌株HX1026在豆粕水解液中生长速度最快的原因。当发酵液中氨基酸态氮消耗完后,菌株HX1026需要产生蛋白酶水解总氮中的非氨基酸态氮满足菌株生长和代谢。大豆蛋白胨、酵母粉、玉米浆干粉总氮含量高,但氨基酸态氮/总氮比值较低,说明这三种氮源中非氨基酸态氮含量高。因此,在利用这3种氮源进行肌苷发酵的中后期(40~60 h),菌株HX1026生长速度变慢,残糖较多,肌苷产量较低。结果说明豆粕水解液是菌株HX1026最适合的有机氮源,同时也说明在选择有机氮源时要兼顾总氮、氨基酸态氮以及氨基酸态氮/总氮的比值,确保菌株HX1026发酵过程中肌苷产量始终处于较高水平。
2.5 不同厂家豆粕水解液对肌苷产量的影响
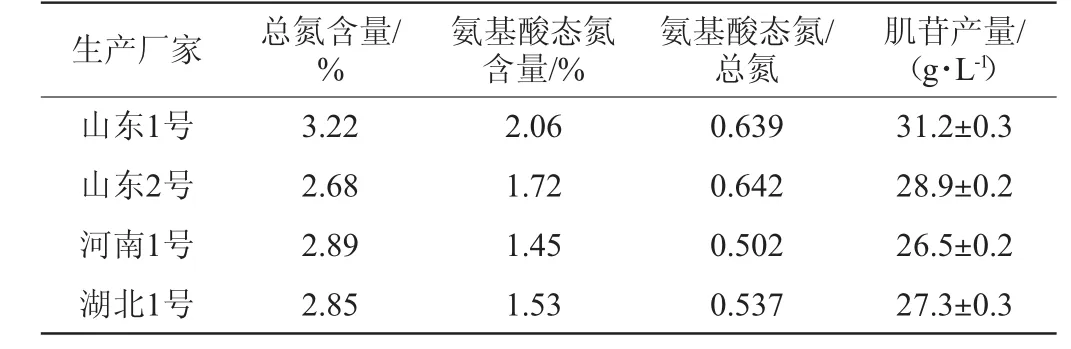
表4 不同厂家豆粕水解液的技术参数及对肌苷产量的影响Table 4 Technical parameters of soybean meal hydrolysate from different factories and the effects on the yield of inosine
由表4可知,不同厂家豆粕水解液的总氮、氨基酸态氮、氨基酸态氮/总氮等技术参数各不相同,而且对肌苷产量的影响也存在较大差异。其中,山东1号的总氮、氨基酸态氮均高于其他三个厂家的水解液,其对应的肌苷产量也明显高,达到31.2 g/L。山东2号的氨基酸态氮/总氮值稍高于山东1号,但豆粕水解液的浓度相同时,其总氮和氨基氮均低于山东1号,其对应的肌苷产量低于山东1号。因此,在选择氮源时,不仅氮源种类很重要,即使同一种氮源,不同厂家生产的产品技术参数如总氮、氨基酸态氮、氨基酸态氮/总氮等也存在较大差异,从而导致肌苷产量出现差异。这意味着在选择豆粕水解液作为肌苷发酵氮源时,需要建立严格的质量标准,以后在采购豆粕水解液时,应参照山东1号的质量标准,否则有可能因为氮源的差异影响肌苷的产量,从而影响肌苷发酵的稳定性。
2.6 20 L发酵罐验证实验
以山东1号为有机氮源,利用20L发酵罐对菌株HX1026发酵过程进行验证,考察发酵过程中生物量、残糖含量及肌苷产量变化,结果如图3所示。由图3可知,菌株HX1026生物量和肌苷产量的变化趋势基本一致,从第12小时开始,菌体OD600nm值快速增加,肌苷产量也快速增加,与之相对应的发酵液中残糖含量从第12小时快速减少,发酵至60 h时残糖含量几乎为零。在发酵结束时,肌苷产量达到51.2g/L,远高于山东1号在摇瓶发酵中的产量31.2 g/L。这可能是因为发酵罐中溶氧充足,快速搅拌使得培养基和菌体传质充分,最终提高了肌苷产量。这进一步证实山东1号是适合于菌株HX1026的生长与发酵生产肌苷的有机氮源。
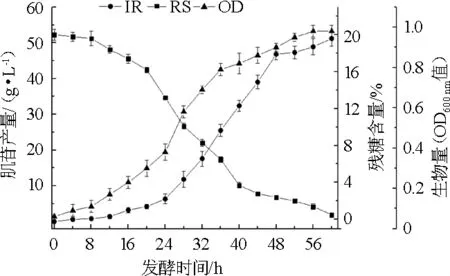
图3 山东1号豆粕水解液对B.subtilis HX1026发酵参数的影响Fig.3 Effect of Shandong No.1 soybean meal hydrolysate on the fermentation parameters of B.subtilis HX1026
2.7 发酵过程中肌苷晶体形态的变化
以山东1号为有机氮源,从20 L发酵罐中分别于24 h、36 h、48 h和60 h取样,在显微镜下观察肌苷晶体,结果如图4所示。
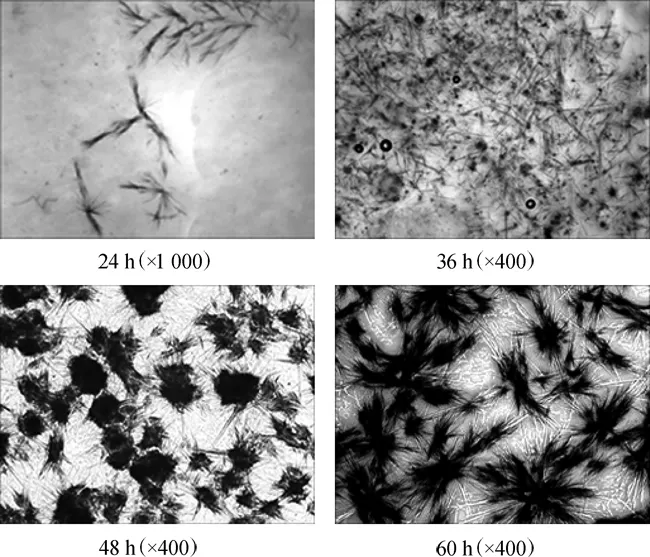
图4 发酵过程中肌苷晶体形态变化Fig.4 Changes of the crystal morphology of inosine during fermentation
由图4可知,在发酵24 h时,肌苷晶体呈羽毛状,数目比较少,晶体比较小,需在1 000倍的显微镜下才能看到;当发酵至36 h时,晶体呈绒毛状,晶体变大,在400倍显微镜下就能被观察到,且晶体数量明显增多;当发酵至48 h时,晶体呈雪花状,在400倍的显微镜下晶体非常清晰;当发酵至60 h时,晶体呈放射状,数量非常多,在400倍的显微镜下清晰可见的肌苷晶体非常粗壮。发酵过程中肌苷晶体由小变大、由少变多的过程流畅、清晰可见,结合20 L发酵罐中肌苷产量(51.2 g/L),进一步说明山东1号是合适的菌株HX1026发酵生产肌苷的有机氮源。
3 结论
本实验以枯草芽孢杆菌HX1026为研究对象,选择大豆蛋白胨、酵母粉、玉米浆干粉和豆粕水解液为有机氮源,考察不同有机氮源对菌株HX1026发酵过程中生物量、残糖含量、肌苷产量的影响,确定了豆粕水解液是最适合于菌株HX1026发酵生产肌苷的有机氮源;在此基础上,研究不同厂家生产的豆粕水解液对菌株HX1026发酵过程中肌苷产量的影响,确定山东1号豆粕水解液是最适合于菌株HX1026发酵生产肌苷的有机氮源;通过20 L规模的发酵罐验证实验,证实山东1号豆粕水解液作为氮源时,菌株HX1026肌苷产量(51.2 g/L)大幅高于摇瓶发酵(31.2 g/L),且肌苷晶体在发酵罐中形成过程清晰可见。因此,豆粕水解液的总氮、氨基酸态氮、氨基酸态氮/总氮等技术参数可以作为肌苷大规模发酵时选择有机氮源的标准,以确保氮源的稳定性,从而保证发酵过程中肌苷产量的稳定性,这对其他晶体类产品如鸟苷、核黄素的发酵过程中氮源的筛选也有具重要的参考价值。
参考文献:
[1]常景玲,任 敏.肌苷菌种的筛选和发酵条件的优化[J].中国酿造,2008,27(12):29-32.
[2]杜 琨,张亚宁,方 多.呈味核苷酸及其在食品中的应用[J].中国酿造,2005,24(10):50-52.
[3]闫俊书,宦海琳,周维仁,等.外源肌苷酸对肉鸡生长性能、肉品质及血清生化指标的影响[J].动物营养学报,2016,28(1):125-134.
[4]俞 灿,郑国斌,姚 娟,等.富含核糖核酸酿酒酵母的选育及其高密度发酵工艺[J].中国酿造,2016,35(12):66-71.
[5]MURPHY FV,RAMAKRISHNAN V.Structureof apurine-purinewobble base pair in the decoding center of the ribosome[J].Nat Struct Mol Biol,2004,11(12):1251-1252.
[6]JANKE E M B,RIECHERTKRAUSE F,WEISZ K.Low-temperature NMR studies on inosine wobble base pairs[J].J Phys Chem B,2011,115(26):8569-8574.
[7]MO A H,LANDON P B,MECKES B,et al.An on-demand four-way junction DNAzyme nanoswitch driven by inosine-based partial strand displacement[J].Nanoscale,2014,6(3):1462-1466.
[8]胡白瑛,蒋云生,刘伏友,等.肌酐分解产物对红细胞的影响及机理探讨[J].中国血液净化,2005,4(5):261-263.
[9]YUNJ,IRWINN.Inosineregulatesaxon regeneration in retinal ganglion cells[J].Chinese Ophthal Res,2000,18(3):221-223.
[10]LIU GS,WANGY J,HUANGQ,et al.Variation of adenineconcentration in inosinefermentation[J].Food Sci,2013,276(23):19687-19690.
[11]XIAO A F,YANG ST,HUI N I,et al.Optimization of shaking flask fermentation conditions for inosine production by Bacillus subtilis[J].Food Sci Technol,2013,6(9):552-563.
[12]LEDESMAAMARO R,BUEY R M,REVUELTA J L.Increased production of inosineand guanosine by means of metabolic engineering of the purine pathway in Ashbya gossypii[J].Microb Cell Factor,2015,14(1):58-59.
[13]李尔汉,杨慧林,王筱兰,等.肌苷生产菌枯草芽孢杆菌ATCC 13952的全基因组测序及序列分析[J].微生物学报,2015,55(12):1560-1567.
[14]KEMSAWASD V,VIANA T,ARDO Y,et al.Influence of nitrogen sourceson growth and fermentation performanceof different wineyeast species during alcoholic fermentation[J].Appl Microbiol Biotechnol,2015,99(23):10191-10207.
[15]DOMINI C,VIDAL L,CRAVOTTO G,et al.A simultaneous,direct microwave ultrasound-assisted digestion procedure for the determination of total Kjeldahl nitrogen[J].Ultrason Sonochem,2009,16(4):564-569.
[16]王 卫,李 翔,龚建军,等.HPLC法测定不同选育猪肉中肌苷酸的含量[J].食品工业,2016,37(5):295-298.
[17]LAVERDIERE I,CARON P,COUTURE F,et al.Liquid chromatography-coupled tandem massspectrometry based assay to evaluateinosine-5′-monophosphate dehydrogenase activity in peripheral blood mononuclear cells from stem cell transplant recipients[J].Anal Chem,2012,84(1):216-223.
[18]WALTER G A,PHILLISJW,O‘REAGAN M H.Determination of rat cerebrospinal fluid concentrations of adenosine,inosine,hypoxanthine,xanthineand uric acid by high performanceliquid chromatography[J].J Pharm Pharmacol,2011,40(2):140-142.
[19]KIM D J.Relation of microbial biomass to couting units for Pseudomonasaeruginosa[J].Afr J Microbiol Res,2012,6(21):4620-4622.
[20]马耀宏,史建国,杨俊慧,等.果汁饮料中还原糖快速测定技术的研究[J].食品与发酵工业,2006,32(6):104-106.
[21]杜亚飞,蒋英丽,何世兴,等.大曲中总酸和氨基酸态氮的连续滴定[J].中国酿造,2014,33(6):132-134.
