稻米中无机离子镉的HPLC-ICP-MS检测技术研究
2018-05-10彭青枝周陶鸿
黄 徽,彭青枝*,周陶鸿
(1.湖北省食品质量安全监督检验研究院,湖北 武汉 430075;2.湖北省食品质量安全检测工程技术研究中心,湖北 武汉 430075)
镉(cadmium)是一种重金属元素,主要以与氧、氯、硫等无机元素形成化合物的形式广泛分布于自然界中。镉对生物体内脏、脑、骨骼及血液系统均可产生毒害性,经实验显示,镉对动物的生殖和发育系统也会产生影响,被美国毒物管理委员会列为第6位危及人体健康的有毒物质[1-2]。镉在环境中不能被生物降解,工农业生产所造成的环境污染是生物体中镉的主要来源。1950年代,日本富山县神通川发生了著名的“痛痛病”事件[3],探究日本“痛痛病”的因果关系后,环境中的镉与健康的关系日益受到重视。镉在正常环境中含量很低,但是易在生物体内富集,具有高富集特性的作物如稻米等在正常环境中也能积累高浓度的镉[4],由于镉易在生物体内蓄积且难代谢,因此镉成为影响食用安全的主要重金属之一。近年来,我国部分地区频繁出现大米镉超标现象,超标率约在5%~15%[5-7],对人体健康构成了严重的威胁,社会各界对之高度关注并设法降低镉大米的食用风险[8]。
镉在生物体内可以与蛋白质、有机酸等结合成有机镉形态,也可以以离子态存在。环境学和毒理学研究结果表明,离子态镉(Cd2+)的毒性较高,结合态和有机态镉无毒或毒性非常微弱[9],通过食物摄入到人体中的重金属代谢活性和毒害效应与其存在形式有很大关系。林忠宁等[10]通过研究有机镉染毒对小鼠免疫球蛋白及其亚类水平的影响,发现无机镉对体液免疫功能的抑制作用明显高于有机镉。若简单地采用镉的总含量却以其离子态的毒性效应作为镉毒性评价标准可能会有失偏颇,往往会高估其毒害效应。镉的形态差异可以作为具有镉富集特性的食品如稻米等安全性评价的关键点,目前关于稻米中镉形态的研究较少。
稻米中的镉在淀粉、脂肪等成分中含量很低,主要以与蛋白质结合的形态存在,并且主要与谷氨酸(Glu)、异亮氨酸(Ile)、亮氨酸(Leu)、半胱氨酸(Cys)、缬氨酸(Val)、酪氨酸(Tyr)等氨基酸结合[11]。查燕等[12]通过葡聚糖凝胶层析法对稻米中镉形态进行分析也得出了相似结论。目前国标GB 2762—2017《食品安全国家标准食品中污染物限量》中规定稻米中镉限量为0.2 mg/kg,现行镉的检测方法是根据国标GB 5009.15—2014《食品安全国家标准食品中镉的测定》中规定的方法,将大米中各种形态镉消解转化成离子态镉,该方法得到的测定结果实际上是大米中总镉的含量。总镉含量作为检测指标不能如实反映其食用安全性,更不能准确地进行风险评估,应该针对各种形态镉制定相应的标准限量。
杨红霞等[13]运用体积排阻-高效液相色谱-电感耦合等离子体-质谱(size exclusion-high performance liquid chromatography-inductively coupled plasma-mass spectrometry,SEC-HPLC-ICP-MS)联用技术分析了印度芥菜中镉的存在形态,发现镉主要以植物螯合肽(phytochelatin,PC)3-镉(Cd)、植物螯合肽(PC)2-镉(Cd)、谷胱甘肽(glutathione,GSH)-镉(Cd)及半胱氨酸(cysteine,Cys)-镉(Cd)这4种有机形态存在。李彬等[14]采用凝胶色谱-高效液相色谱-电感耦合等离子体质谱法分析了富镉蕨类植物根系中镉的总量及其形态分布。但是目前国内外标准中均无测定稻米中离子态镉(Cd2+)的方法。本实验研究建立了稻米中离子态镉(Cd2+)的分析方法,并分析了部分抽检的镉超标稻米(镉含量>0.2 mg/kg)中离子态镉(Cd2+)的含量,以期为科学评估稻米中镉的食用风险,保障我国稻米食用安全提供进一步的参考。
1 材料与方法
1.1 材料与试剂
硝酸(分析纯):德国Merck公司;其他试剂均为国产分析纯;实验用水为超纯水。
Cd2+标准使用液:将1 000μg/mL Cd2+标准储备液(国家有色金属及电子材料分析测试中心)稀释为10.0μg/mL Cd2+的标准使用液,置于4℃保存备用,由10.0μg/mL Cd2+标准使用液经浸提液稀释成4.0μg/L、8.0μg/L、12.0μg/L、16.0μg/L和20.0μg/L的Cd2+标准系列使用液,使用液现配现用。
1.2 仪器与设备
UltiMate3000高效液相色谱仪(配有自动进样器):美国DIONEX公司;CS5A阳离子交换色谱柱(4mm×250mm)、CG5A保护柱(4 mm×50 mm)、Icap QC电感耦合等离子体-质谱(ICP-MS)仪(配有碰撞反应池,形态分析全自动处理接口):美国Thermo Fisher Scientific公司;900T原子吸收光谱仪:美国PE公司;MULTIWAVE PRO微波消解仪、Monowave 450微波萃取仪:奥地利安东帕(中国)有限公司。
1.3 方法
1.3.1 样品中总镉的测定
将稻米磨碎混匀,称取样品约0.5 g(精确至0.001 g)于微波消解管中,加10 mL硝酸加盖放置1 h,于微波消解仪中消解。消解完毕后,将微波消解管放入赶酸器中加热1~2 h后,然后转移消化液至离心管中,用水少量多次洗涤消化管,洗液合并,定容至50 mL,同时制备空白。用石墨炉原子吸收光谱仪测定试样及试剂空白中镉含量[15]。
1.3.2 样品中无机离子镉(Cd2+)测定
称取约1 g(精确至0.001 g)磨碎混匀的稻米样品于萃取管中,按照料液比1∶20(g∶mL)加入50 mmol/L Tris-HCl缓冲溶液(pH7.20),50℃条件下微波萃取10 min,将溶液转移至50 mL离心管中,重复提取一次,合并提取液,于3 900 r/min离心30 min,上清液用0.45μm的水系微孔滤膜过滤,滤液上HPLC-ICP-MS测定无机离子镉(Cd2+)含量,其计算公式如下:

式中:C为样品溶液的质量浓度,μg/L;C0为试剂空白溶液的质量浓度,μg/L;V为样品定容体积,mL;m为试样质量,g;X为试样的无机离子镉含量,mg/kg。
HPLC-ICP-MS主要工作参数:射频功率1 550 W,等离子体气流速14 L/min,雾化气流速0.89 L/min,辅助气流速1.1 L/min,检测器模拟电压:-1 825 V,检测器脉冲电压:1 100 V,采样时间8 min;浸提液50 mmol/L Tris-HCl缓冲溶液(pH 7.20);流动相组成:60 mmol/L草酸+100 mmol/L LiOH,使用前经过0.45μm滤膜过滤并超声脱气。
2 结果与分析
2.1 Cd2+分离与检测
以镉超标稻米中无机离子镉(Cd2+)为研究目标,采用CS5A阳离子交换色谱柱(4 mm×250 mm)对稻米样品提取液中无机离子镉进行选择性分离并进行ICP-MS检测,由于重金属对阳离子交换树脂有较强的亲和力,选择弱有机酸草酸与Cd2+形成配合物将其从阳离子交换柱中洗脱出来,为了提高草酸解离度,采用LiOH提高流动相pH值,同时也是由于Li+相对于其他金属离子对固定相的亲和力低的原因。经过方法验证,确定分离Cd2+的最佳流动相组成为60 mmol/L草酸+100 mmol/L LiOH。按1.3.2方法对镉超标稻米样品进行处理,提取液中Cd2+用LC-ICP-MS进行检测,结果见图1。由图1可知,该条件下Cd2+分离良好且无杂峰干扰,Cd2+的保留时间为4.5 min。对于元素形态研究,实验过程中需保持样品中镉元素的形态不发生转化,本研究选取Tris-HCl缓冲溶液(pH7.20)为提取剂。虽然用流动相做提取剂可以保持进样溶液具有与流动相一致的条件来消除系统峰的干扰[16]。但是本实验采用的流动相草酸是一种络合剂,可与Cd2+络合形成配合物,可能对Cd2+保留洗脱有影响,因此不适合用作提取剂。将Cd2+标准溶液用浸提液逐级稀释成4.0μg/L,8.0μg/L,12.0μg/L,16.0μg/L和20.0μg/L的标准系列溶液,Cd2+标准系列溶液的分离色谱图见图2。以Cd2+标准溶液质量浓度(x)为横坐标,积分强度(y)为纵坐标,拟合标准曲线,回归方程线性相关系数R=0.998。

图1 稻米样品萃取液中HPLC-ICP-MS分析Cd2+色谱图Fig.1 Chromatography of Cd 2+in extraction of rice sample analysis by HPLC-ICP-MS
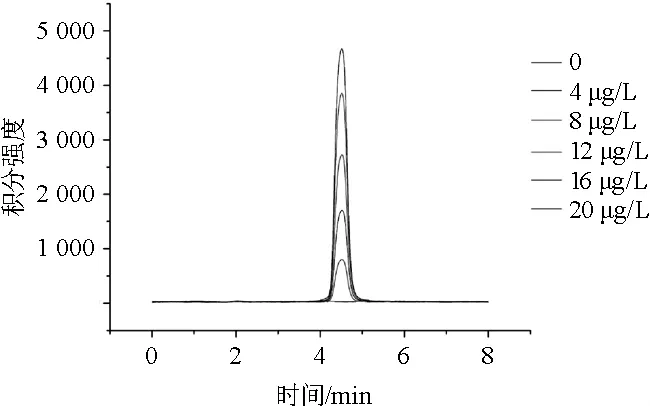
图2 HPLC-ICP-MS分析Cd2+标准溶液色谱图Fig.2 Chromatogram of Cd 2+standard solution analysis by HPLC-ICP-MS
2.2 提取条件的选择
2.2.1 萃取时间的选择
以稻米样品为试验对象,在其他条件一定的情况下,设定微波萃取时间分别为5min、10min、20min、30min、60min、120 min进行提取试验,样品中Cd2+提取结果见表1。由表1可知,提取时间在10 min内,稻米中离子态镉(Cd2+)并未达到提取完全状态,在10 min后,萃取时间对提取效率影响不明显(P>0.05),说明微波能量场可以快速将稻米中的离子态镉(Cd2+)释放出来,故选择10 min作为样品萃取时间。

表1 萃取时间对Cd2+提取效率的影响Table 1 Effect of extraction time on Cd 2+extraction efficiency
2.2.2 萃取温度的选择
保持其他条件不变,分别在30℃、40℃、50℃、60℃和70℃温度条件下对稻米样品进行微波萃取,考察萃取温度对样品中Cd2+提取效果,结果见图3。由图3可知,在50℃之前,Cd2+提取量随温度的升高而增加,在此之后基本不变,故本实验选择50℃作为萃取温度。

图3 萃取温度对Cd 2+提取效率的影响Fig.3 Effect of extraction temperature on Cd 2+extraction efficiency
2.3 精密度和加标回收实验
2.3.1 精密度实验
准确称取3个稻米样品各5份进行Cd2+含量测定实验,实验结果见表2。由表2可知,3个稻米样品Cd2+含量平行测定结果的相对标准偏差(relative standard deviation,RSD)均<10%,表明该方法精密度良好。

表2 精密度试验结果Table 2 Results of precision experiments
2.3.2 方法加标回收实验
取2个Cd2+含量已知的稻米样品分别进行加标回收试验,测定结果见表3。由表3可知,试样中Cd2+加标回收率在85.1%~91.6%,表明该检测方法准确度高。
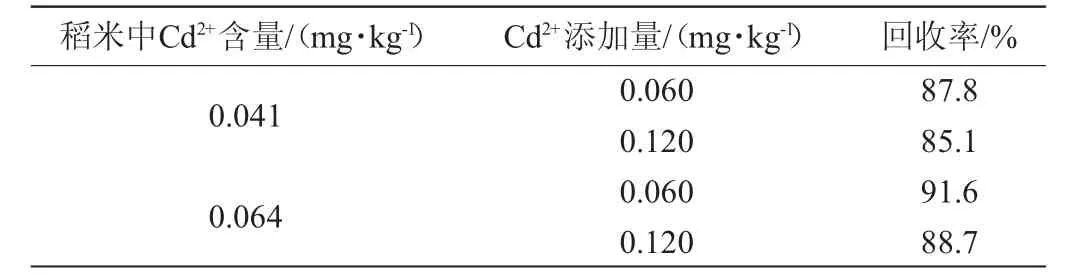
表3 加标回收率试验结果Table 3 Results of adding standard recovery rate experiments
2.3.3 方法检出限和定量限
以3倍的信噪比作为依据来考察本方法检出限,通过试验可得本方法检出限为0.005mg/kg,方法定量限为3倍的方法检出限即0.015 mg/kg。
2.4 稻米样品分析
运用本方法测定了监督抽检稻米中部分镉超标样品(镉含量>0.2 mg/kg)中无机离子态镉(Cd2+)和总镉的含量,并且分析了Cd2+占总镉含量的比例,结果见表4。

表4 稻米样品中无机离子镉和总镉的分布状态Table 4 Distribution of inorganic cadmium ion and total cadmium in rice samples
由表4可知,29个稻米样品中离子态镉(Cd2+)对总镉含量占比最低为6.95%,最高为23.50%。可见稻米中大部分镉以有机结合态存在,结论进一步说明对稻米开展镉的风险评估可能需要结合镉的形态分析才会更有说服力。
3 结论
本实验采用高效液相色谱-电感耦合等离子体-质谱联用技术(HPLC-ICP-MS)分析测定稻米样品中无机离子镉(Cd2+),方法线性回归方程相关系数R=0.998,精密度试验结果相对标准偏差(RSD)<10%,加标回收率85.1%~91.6%,方法检出限为0.005 mg/kg,表明该方法具有较高的灵敏度和准确度。运用此方法测定了抽检稻米中部分镉超标样品中无机离子镉(Cd2+)的含量,并分析了其占样品中总镉含量比例,发现稻米中无机离子镉(Cd2+)含量较低,镉主要以有机镉形态存在,为我国稻米食用安全评价提供重要的参考依据。
参考文献:
[1]李学鹏,段青源,励建荣.我国贝类产品中重金属镉的危害及污染分析[J].食品科学,2010,31(17):457-461.
[2]安 静.重金属镉对环境的污染与治理[J].现代农业,2011(2):89.
[3]HORIGUCHIH,TERANISHIH,NIIYA K,et al.Hypoproduction of erythropoietin contributesto anemia in chronic cadmium intoxication clinical study on Itai-Itai disease in Japan[J].Arch Toxicol,1994,68(10):632-636.
[4]BUSTAMANTE P,MIRAMAND P.Subcellular and body distributions of 17 trace elements in the variegated scallop Chlamys varia from the French coast of the Bay of Biscay[J].Sci Total Environ,2005,337(1-3):59-73.
[5]尚 琪,翟苗苗,姚量三,等.江西省某县大米镉污染情况追踪调查[J].卫生研究,2009,38(3):296-298.
[6]雷 鸣,曾 敏,王利红,等.湖南市场和污染区稻米中As、Pb、Cd污染及其健康风险评价[J].环境科学学报,2010,30(11):2314-2320.
[7]杨 菲,白卢皙,梁春穗,等.2009年广东省市售大米及其制品镉污染状况调查[J].中国食品卫生杂志,2011,23(4):358-362.
[8]傅亚平,刘 阳,吴卫国,等.酸溶联用发酵技术脱除大米中镉的工艺优化[J].中国酿造,2015,34(10):62-67.
[9]赵艳芳,宁劲松,翟毓秀,等.镉在海藻中的化学形态[J].水产学报,2011,35(3):405-409.
[10]林忠宁,董胜璋,林育纯,等.有机镉染毒对小鼠免疫球蛋白及其亚类水平的影响[J].卫生研究,2002,31(6):408-409
[11]周显青,王铃钊,张玉荣,等.稻米籽粒中镉的分布、形态和检测方法研究进展[J].粮食与饲料工业,2014(7):9-13.
[12]查 燕,杨居荣,刘 虹,等.污染稻麦籽实中镉和铅的分布及其存在形态[J].北京师范大学学报:自然科学版,2000(2):268-273.
[13]杨红霞,刘 葳,刘 冰,等.体积排阻高效液相色谱-电感耦合等离子体质谱测定印度芥菜中镉的形态[J].分析化学,2009,37(10):1511-1514.
[14]李 彬,刘 丽,王秋泉,等.SE-HPLC/ICP-MS/ESI-MS联用技术用于富镉植物中镉的形态研究[J].光谱学与光谱分析,2010,30(4):1096-1100.
[15]中华人民共和国国家卫生和计划生育委员会.GB 5009.15—2014食品安全国家标准食品中镉的测定[S].北京:中国标准出版社,2015.
[16]尚德荣,赵艳芳,翟毓秀,等.高效液相色谱-电感耦合等离子体质谱(HPLC-ICP-MS)分析水产品中游离态三价铝(Al3+)[J].科学通报,2013,58(36):3812-3817.
