新形势下学生的化学思维的培养
——酸式盐的化学性质探究
2018-05-09王光伟
王光伟
(湖北省十堰市东风高级中学 442000)
高中化学人民教育出版社出版社必修一中离子反应和选修四《化学反应原理》中对于酸式盐的介绍仅仅提出一种研究思路,没有深入,致使很多学生在遇到与酸式盐有关的反应,计算,离子浓度大小比较等方面的问题,屡出错误,究其原因是,学生在学习和应用过程中,仅仅把其当成一个知识点,没有从微观层面把握知识体系,没有把具体物质电离和水解知识进行对比和归纳,没有从“量”的角度去研判粒子在水溶液中所扮演的角色.笔者根据教学过程中的所得的经验和具体做法和大家分享.
一、建立微粒观,电解质在水溶液中的存在状态
电解质在高中化学教材中占据着及其重要的地位,电解质具体可以包含酸、碱、盐、活泼金属氧化物及其复杂氧化物和水.酸式盐属于盐的范畴,故而在水溶液中会发生电离,以离子的形式存在,强电解质在水溶液中完全电离,弱电解质在水中分布电离,并且以第一步电离为主,多元弱酸酸式盐的酸式酸根在发生电离的同时也会发生部分的水解.水溶液的酸碱性直接取决于酸根离子的电离程度和水解程度.
二、多元酸酸式盐在水溶液中的行为
1.多元强酸酸式盐在水溶液中的表现
在高中化学中,硫酸是多元强酸的代表,NaHSO4在水溶液中:

于是硫酸氢盐在水溶液中表现出来的化学性质即强酸性和硫酸根的性质,即具有以下的化学性质:(1)可以使酸碱指示剂发生颜色变化;(2)与碱发生类似中和反应;(3)与金属氧化物反应;(4)与活泼金属单质反应制备氢气;(5)与强碱弱酸盐反应制备弱酸;(6)与重金属离子生成难溶的硫酸盐.这个在具体的题目中相对较容易.
2.多元弱酸酸式盐在水溶液中的表现
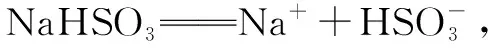

K=4.8×10-6
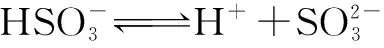
Ka2(25℃)=6.6×10-8

Kh(25℃)=8.1×10-13

Kw=1.0×10-14

三、具体的实例应用
1.碳酸氢钠溶液中溶液中离子浓度大小比较
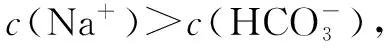
①质子守恒c(H+)+c(H2CO3)=c(OH-)+c(CO32-)
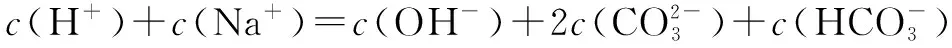
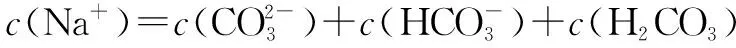
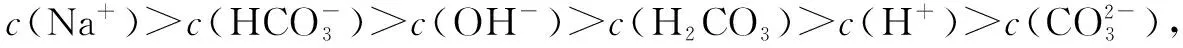
2.氯气通入到NaHCO3溶液中的反应

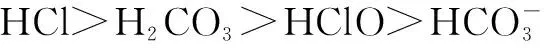
氯气通入到NaHCO3溶液中离子方程式为:

氯气通入到Na2CO3溶液中离子方程式:
氯气不足:
氯气过量:
3.NaHSO3溶液中的微粒浓度大小分析
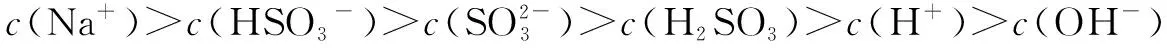
一线教师在具体的教学中,应根据知识内容展开层进式教学,注重对学生个体的独立思维能力的培养.这样的思维应该建立在严密的逻辑推理基础上,只有这样才能促进学生整体由线性思维到立体思维的极大提升.
参考文献:
[1]许文.浅议溶液中微粒浓度大小的比较[J].化学教学,2013(9):72-73.
