CO2与强碱溶液反应产物的判断
——依量反应产物的判断
2018-05-09王法鹏
王法鹏
(安徽省灵璧中学 234200)
中学化学中,与反应物量有关的化学反应很多,称之为依量反应,如何对依量反应进行计算是教学中一个难点,对于该类型题可以采用以下解题步骤进行处理.
解题步骤:
1.判断可能发生的反应,写出相关的化学方程式.
2.按恰好完全反应,确定相关反应物的物质的量之比.(即寻找临界点)
3.根据临界点,确定讨论范围,进行判断.
4.进行定量计算常用讨论法和守恒法进行解答.
下面以CO2与NaOH溶液反应为例:
反应原理:

①

②
由①与②可得:

根据上述反应原理对于CO2与NaOH溶液反应后溶液的组成进行判断.
一、根据反应物之间物质的量关系进行判断
可以根据


两个反应作为依据,以反应物的物质的量的关系为临界点进行讨论:

反应物间关系溶液组成n(NaOH)n(CO2)>21NaOH、Na2CO3n(NaOH)n(CO2)=21Na2CO321>n(NaOH)n(CO2)>11Na2CO3、NaHCO311≧n(NaOH)n(CO2)NaHCO3
二、根据反应产物的质量进行判断

如向含4 g NaOH溶质的溶液中通入CO2气体:

产物的质量溶液组成m(产物)=8.4gNaHCO38.4g>m(产物)>5.3gNa2CO3、NaHCO3m(产物)=5.3gNa2CO35.3g>m(产物)>4.0gNa2CO3、NaOH
例1 往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M.通入的CO2体积V(标准状况)与白色固体M的质量W的关系如图所示.
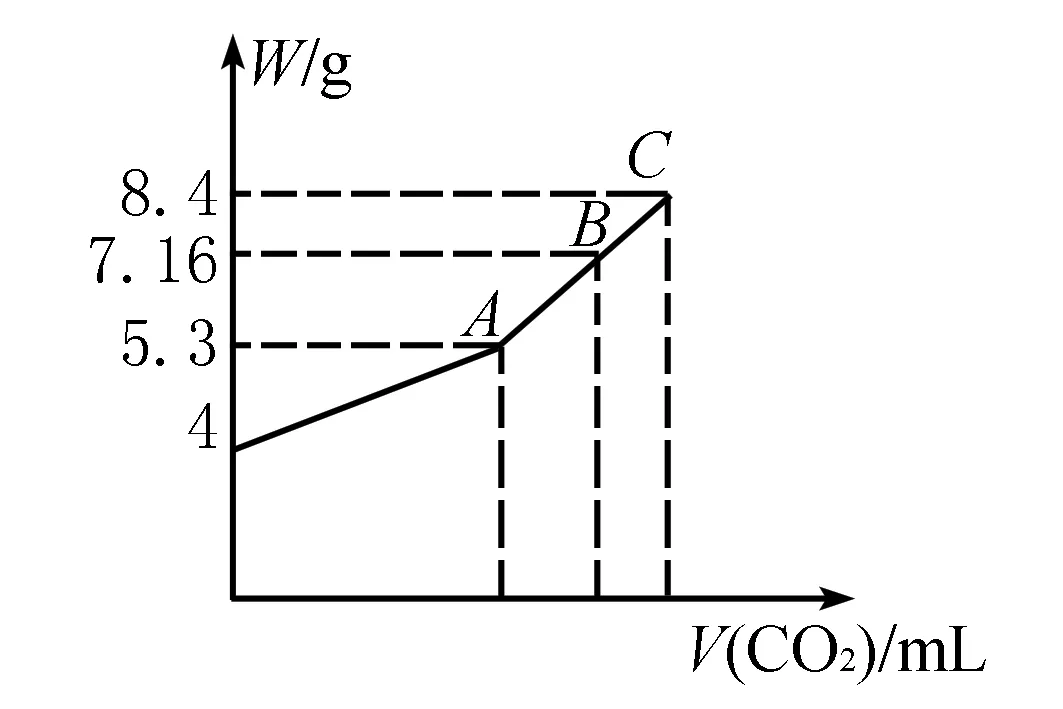
试解答下列问题:
(1)A点时,白色固体M的化学式为____,通入的CO2的体积为____mL.
(2)C点时,白色固体M的化学式为____,通入的CO2的体积为 ____mL.

(3)B点时,M的组成成份为____(用化学式表示),通入的CO2的体积为____mL.
(4)该NaOH溶液的物质的量浓度为____.
解析4g NaOH完全反应生成Na2CO3时,所得固体质量为5.3g,全部生成NaHCO3时所得固体质量为8.4g,所以A点为Na2CO3,通入CO2的体积为1.12L.C点为NaHCO3,通入CO2的体积为2.24L.B点介于两者之间,故为Na2CO3、NaHCO3混合物,利用守恒法计算CO2的体积为1.792L,则原NaOH溶液的物质的量浓度为1mol/L.
三、根据反应产物与盐酸反应的现象进行判断
如向NaOH与一定量的CO2反应后的溶液中加盐酸,所产生的气体与盐酸体积的关系为:
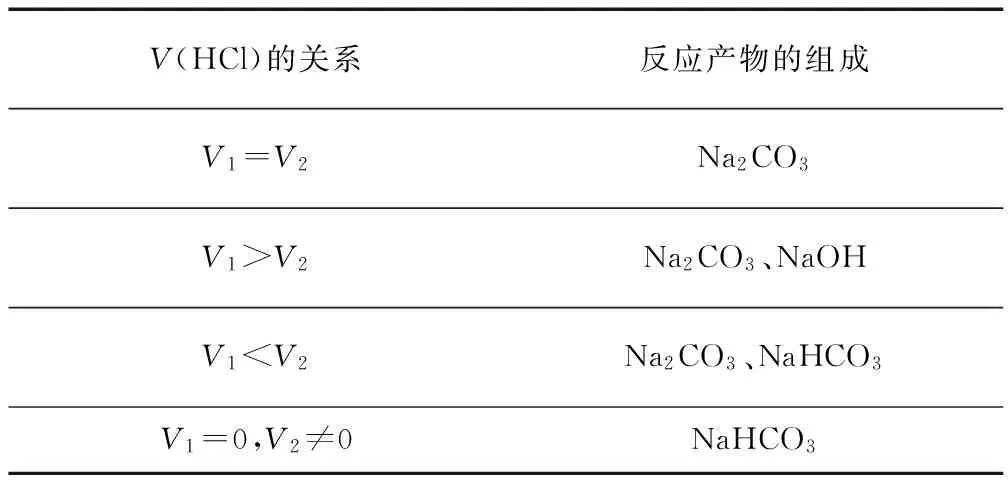
V(HCl)的关系反应产物的组成V1=V2Na2CO3V1>V2Na2CO3、NaOHV1 例2 向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体,再在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发)下列分析都正确的组合是( ) ① Ⅰ图对应溶液中的溶质为NaHCO3; ② Ⅱ图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1∶1; ③ Ⅲ图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1∶1; ④ Ⅳ图对应溶液中的溶质为Na2CO3. A.①② B.①③ C.②④ D.②③ 解析图像Ⅰ中从O点即开始产生CO2气体,对应溶液中的溶质为NaHCO3,①正确;图像Ⅱ中Oa段消耗HCl的量小于ab段消耗的HCl的量,对应溶液中的溶质为Na2CO3、NaHCO3,且二者的物质的量之比n(Na2CO3)∶n(NaHCO3)=1∶(3-1×2)=1∶1,②正确;图像Ⅲ中,Oa段消耗HCl的量等于ab段消耗的HCl的量,对应溶液中的溶质为Na2CO3,③不正确;图像Ⅳ中Oa段消耗HCl的量大于ab段消耗的HCl的量,对应溶液中的溶质为Na2CO3、NaOH,且二者的物质的量之比n(Na2CO3)∶n(NaOH)=1∶(3-1×2)=1∶1,④不正确. 练习:1.向浓度相等,体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL. (1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是: ①________________________, ②________________________, ③________________________, ④________________________. (2)在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示. ①A曲线表明,原溶液倒入CO2后,所得溶液与盐酸反应产生CO2的最大体积是____mL;(标准状况) ②B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为:____; ③原NaOH溶液的物质的量浓度为:____. 2.向100g 8%的NaOH溶液中通入一定量的H2S,然后将溶液在低温下小心蒸干.所得固体与通入H2S量的关系如下图所示. 如果最后所得到的固体质量为7.92g,则通入的标准状况下的H2S的体积为____或____. 参考答案: 1.(1)①NaOH、Na2CO3,②Na2CO3③Na2CO3、NaHCO3 ④NaHCO3. (2)①112 mL ②NaOH、Na2CO3 ③0.150mol/L. 2.896mL 或 2307.2 mL. 参考文献: [1]王磊.普通高中课程标准实验教科书.化学1( 必修)[M].济南:山东科技出版社,2007. [2]王磊.普通高中课程标准实验教科书.化学反应原理(选修)[M]. 济南:山东科技出版社,2007.


