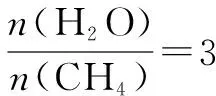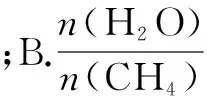破解化学平衡图像考点攻略
2018-05-09王晓波
王晓波
(内蒙古赤峰市林东第一中学 025450)
通过对全国新课标卷试题的分析研究,可以看出化学反应速率与化学平衡及其图像分析是历年高考的重点、难点和热点,其重视程度呈逐年增加趋势,在选择题中命题内容常与热化学结合,融合图象于一体,重点考查化学反应速率的相关判断与计算,以及利用平衡移动的原理分析、解决实际问题.现就化学平衡图象的考点进行探究和总结,共同破解图像试题的解题攻略.
一、图像类型
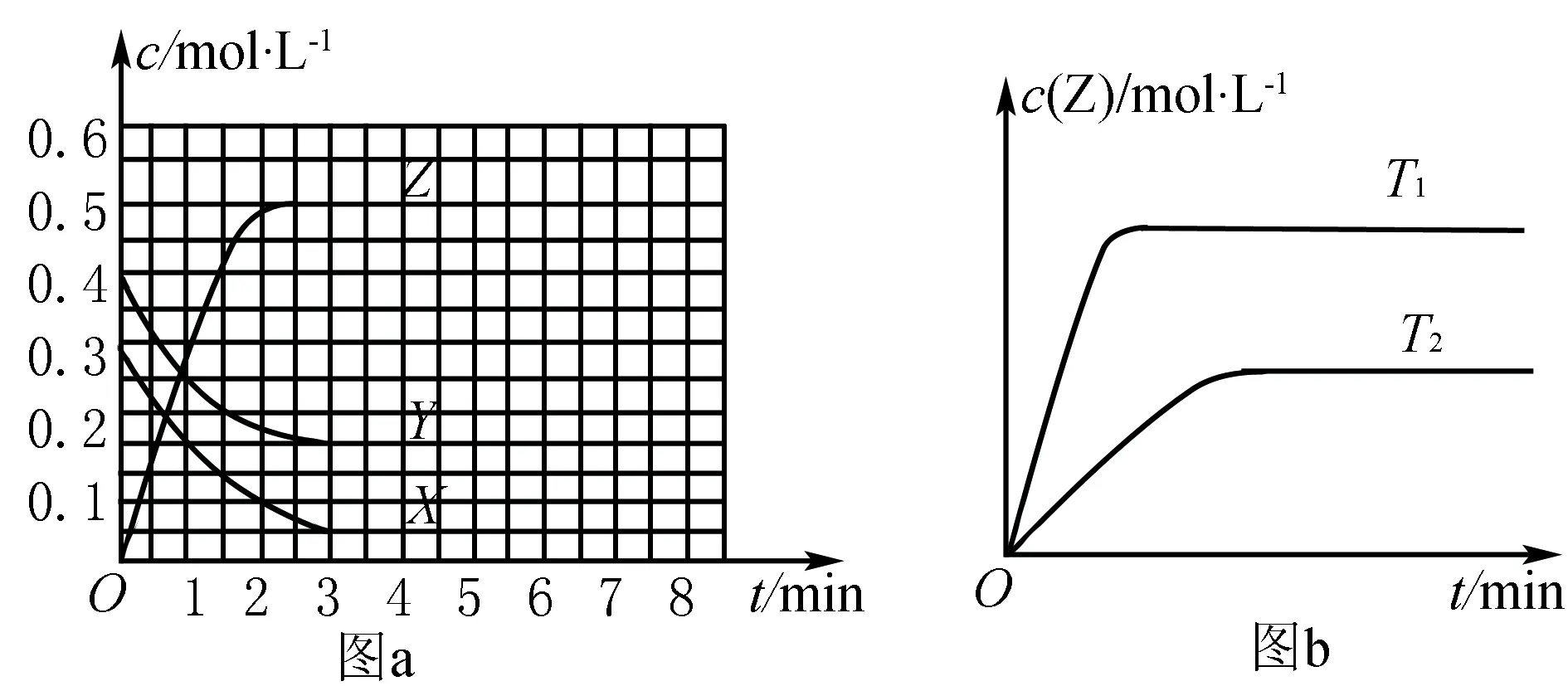
1.浓度—时间图

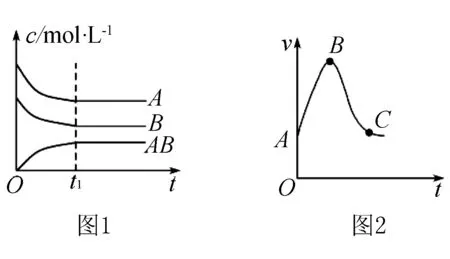
2.速率—时间图
如Zn与足量盐酸的反应,反应速率随时间的变化出现如图2所示的情况,解释原因:AB段(v渐增),因反应为放热反应,随着反应的进行,温度渐高,导致反应速率增大;BC段(v渐小),则主要原因是随反应的进行,溶液中c(H+)逐渐减小,导致反应速率减小.故分析时要抓住各阶段的主要矛盾,认真分析.
3.含量—时间—温度(压强)图
常见形式有如下几种(C%指生成物的质量分数;B%指某反应物的质量分数)
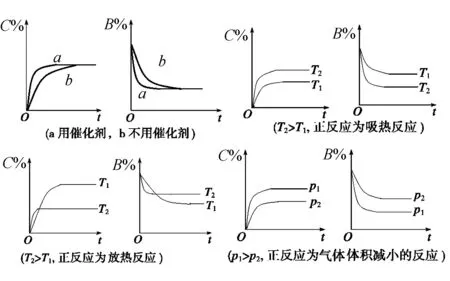
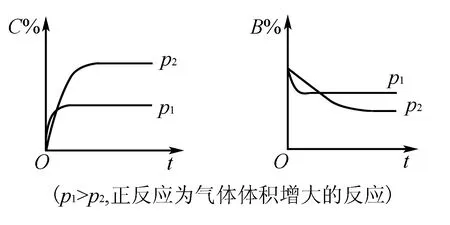
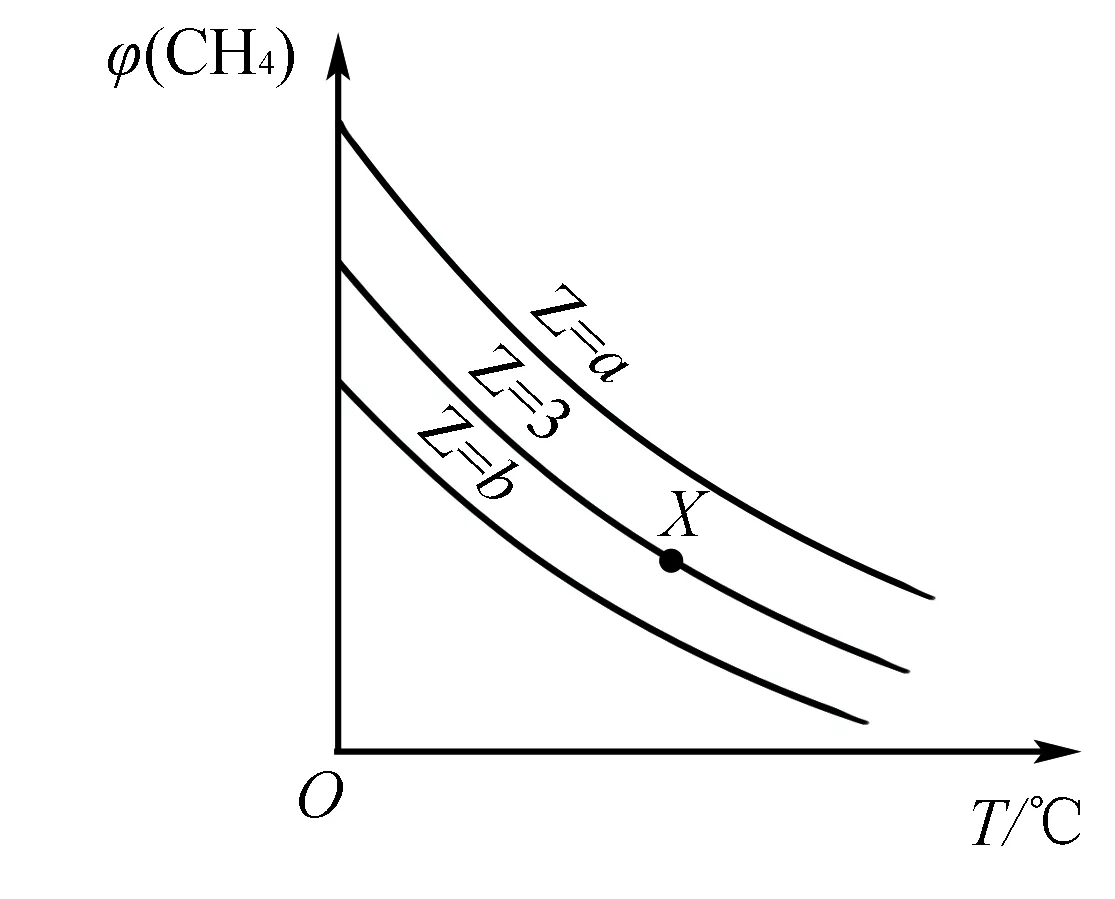
4.恒压(温)线(如图3所示)
该类图的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横坐标为温度(T)或压强(p),常见类型如图3所示.
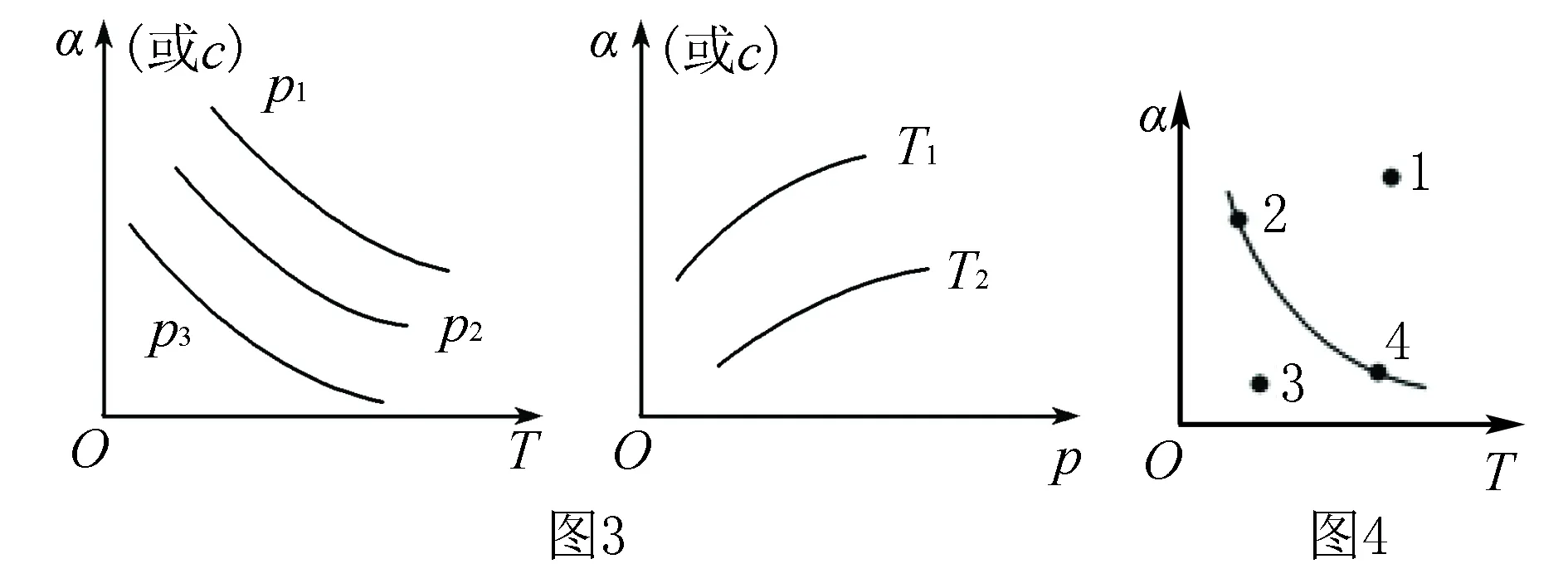
5.其他
如图4所示曲线是其他条件不变时,某反应物的最大转化率(α)与温度(T)的关系曲线,图中标出的1、2、3、4四个点,表示v正>v逆的点是3,表示v正 化学平衡图像题的解题步骤:有关化学平衡、化学反应速率的图表题一直是高考关注的热点,在审题时,一般采用“看特点,识图像,想原理,巧整合”四步法. 第一步:看特点.即分析可逆反应化学方程式,观察物质的状态、气态物质分子数的变化(正反应是气体分子数增大的反应,还是气体分子数减小的反应)、反应热(正反应是放热反应,还是吸热反应)等. 第二步:识图像.即识别图像类型,横坐标和纵坐标的含义、线和点(平台、折线、拐点等)的关系.利用规律“先拐先平,数值大”判断,即曲线先出现拐点,先达到平衡,其温度、压强越大. 第三步:想原理.联想化学反应速率、化学平衡移动原理,特别是影响因素及使用前提条件等. 第四步:巧整合.图表与原理整合.逐项分析图表,重点看图表是否符合可逆反应的特点、化学反应速率和化学平衡原理.即: 1.紧扣特征,弄清可逆反应的正反应是吸热还是放热,体积增大、减小还是不变,有无固体、纯液体物质参与反应等. 2.先拐先平,在含量(转化率)—时间曲线中,先出现拐点的则先达到平衡,说明该曲线反应速率快,表示温度较高、有催化剂、压强较大等. 3.定一议二,当图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线. 4.三步分析法,一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向. 图5 A.该反应的焓变ΔH>0 B.图中Z的大小为a>3>b D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小 A.发生反应时,各物质的反应速率大小关系为:v(X)=v(Y)=2v(Z) B.图6中反应达到平衡时,Y的转化率为37.5% C.T0℃时,该反应的平衡常数为33.3 D.该反应正反应的反应热ΔH<0 这类试题的知识点是高考必考的重难点内容,近几年高考对化学反应速率和化学平衡的考查比较稳定,题型有选择题和填空题,重点考查化学反应速率和化学平衡的基本概念、影响因素、实验分析和设计、速率及转化率和平衡常数的计算.侧重解析化学平衡图像的读图,析图,搜集获取信息,采集处理数据等,需特别关注平衡常数表达式及其计算和化学平衡图像的综合应用. 参考文献: [1]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.化学反应原理[M].北京:人民教育出版社,2004. [2]新课标导学系列丛书编委会.走向高考——高考一轮总复习[M].南昌:江西教育出版社,2012.二、具体步骤

三、解题技巧
四、典型例题