例析弱电解质电离常数的应用
2018-05-09张新中
张新中
(江苏省邗江中学 225100)
一、根据电离常数比较酸(碱)性强弱
电离常数的大小可以反映弱电解质的酸(碱)性强弱.K越大,酸(碱)性越强.
例1 已知部分弱酸的电离平衡常数如下表:

弱酸醋酸次氯酸碳酸亚硫酸电离平衡常数(25℃)Ka=1.75×10-5Ka=2.98×10-8Ka1=4.3×10-7Ka2=5.61×10-11Ka1=1.54×10-2Ka2=1.02×10-7
下列离子方程式正确的是( ).

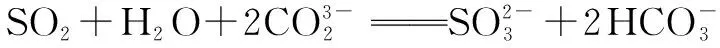



二、根据电离常数判断盐的水解程度
根据电离常数可判断出酸、碱性的强弱,从而可判断出盐类水解的强弱,即弱酸、弱碱的电离常数越大,则其离子的水解程度越小.
例2 已知,25℃时几种弱酸的电离常数如下:

弱酸电离常数弱酸电离常数H2CO3K1=4.3×10-7K2=5.6×10-11H2C2O4(草酸)K1=5.9×10-2K2=6.4×10-5H3PO4K1=7.1×10-3K2=6.3×10-8K3=4.2×10-13H3C6H5O7(柠檬酸)K1=7.4×10-4K2=1.7×10-5K3=4.0×10-7
下列有关推断正确的是( ).
A.溶液的pH大小有:K3PO4>K2HPO4>KH2PO4
C.等浓度的NaHCO3、NaHC2O4的溶液中:前者pH大
D.H3C6H5O7与Na2CO3溶液反应的产物为Na3C6H5O7、CO2、H2O

三、根据电离常数判断稀释过程中浓度比值变化
对于弱电解质稀释时微粒浓度比值的变化,可根据稀释过程中平衡常数不变,将比值问题构造成平衡常数有关的代数式进行简化判断,然后根据电离平衡移动进行分析.
例3 常温下,向0.1 mol·L-1的草酸(H2C2O4)溶液中加水,在稀释过程中,下列物理量始终增大的是( ).
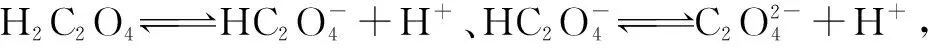
四、根据电离常数计算c(OH-)、c(H+)或pH 弱酸弱碱
例4 常温下NH3·H2O的Kb=1.6×10-5,下列关于氨水的说法不正确的是( ).
A.滴有酚酞的氨水中加入醋酸铵溶液,颜色变浅
B.0.01 mol·L-1的氨水中,c(OH-)=4.0×10-3mol·L-1
D.常温下测量NH4Cl溶液的pH,可以判断NH3·H2O是否属于弱电解质
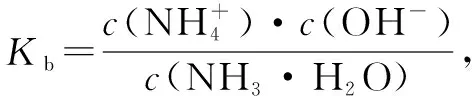
五、根据弱电解质的电离常数计算盐的水解常数
水解平衡可由酸、碱与水的电离平衡相减得来,因此水解常数则是这两个电离平衡常数的比值.
例5 已知25℃时,NH3·H2OKb=1.77×10-5;H2CO3Ka1=4.30×10-7、Ka2=5.61×10-11.25℃时有关NH4HCO3溶液的说法中正确的是( ).
A.呈弱酸性
B.c(OH-)+c(NH3·H2O)=c(H+)+c(H2CO3)
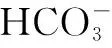
六、根据弱电解质的电离常数与溶度积常数共同判断沉淀在酸中的溶解性
判断沉淀是否溶解于酸,应根据电离平衡与沉淀的溶解平衡相加(或减)得到化学方程式,然后计算其平衡常数,再进行判断.
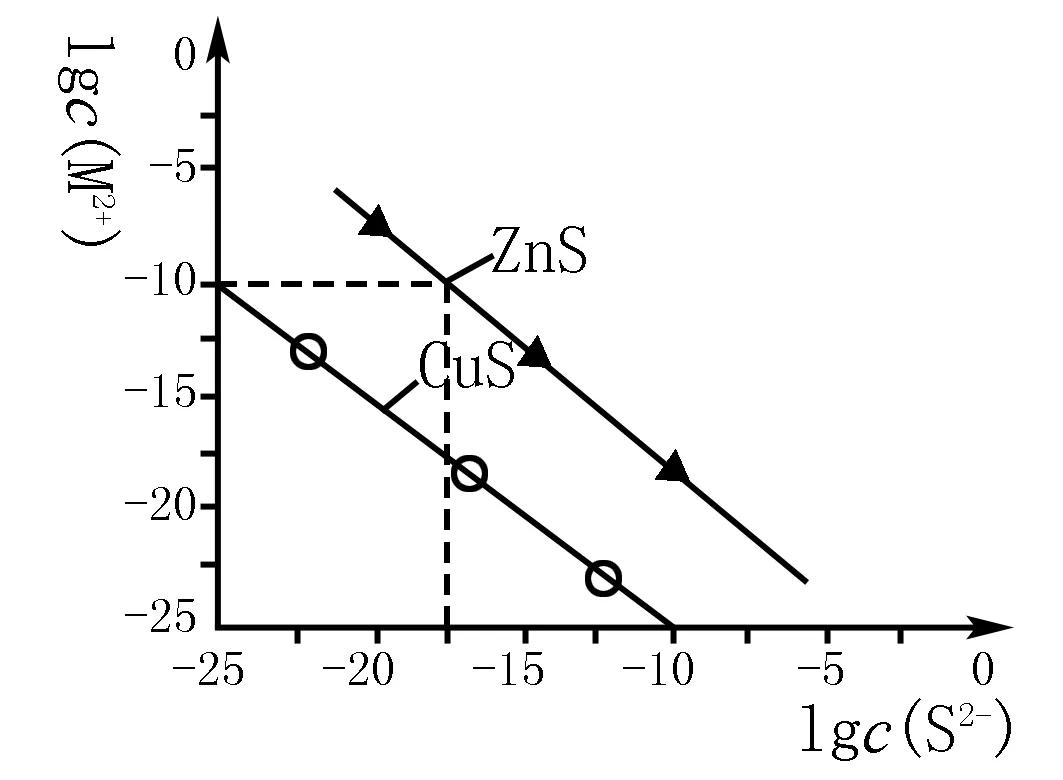
例6 25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( ).
A.Na2S溶液中:

B.25℃时Ksp(ZnS)约为1×10-27.5
C.25℃时,H2S饱和溶液:[c(H+)]2·c(S2-)=1.0×10-22,将少量CuS固体加入到稀硫酸中,CuS不溶解
D.向Cu2+浓度为10-5mol·L-1的工业废水中加入ZnS粉末,会有CuS沉淀析出.

参考文献:
[1]何彩霞.整体把握和实施观念建构的化学教学研究——以高中化学必修1“离子反应”单元为例[J].中学化学教学参考,2011(07).
