分析包装条件对小黄鱼优势腐败菌的影响
2018-05-07黄佳奇向迎春邵颖杨水兵胡亚芹
黄佳奇,向迎春,邵颖,杨水兵,胡亚芹,,*
(1.浙江大学生物系统工程与食品科学学院,浙江杭州310058;2.浙江大学舟山海洋研究中心,浙江舟山316021)
水产品是人类不可或缺的食品之一,2016年全国全年水产品产量近7 000万吨,比上年增长3.0%[1],伴随着生活水平的提高,大众对水产品的需求和要求也将越来越高。水产品含水量高、含氮物质丰富,加上鱼鳃、内脏处黏液是天然的微生物培养基,极易滋生腐败微生物和病原菌,使鱼体产生酸败味和腥臭味[2],这成为影响水产品品质的首要因素。上世纪末有学者研究发现,贮藏初期某些微生物数量和比例并不占明显优势,但随着贮藏时间的延长,这些微生物易适应环境变化而大量繁殖,在数量与比重上占绝对优势,其他菌种所占比例明显减少或不再繁殖,据此提出了优势腐败菌(Specific spoilage organisms,SSOs)的概念[3]。随后有关水产食品SSOs的研究如火如荼,甚至扩展到其他食品领域,如肉类、果蔬类[4-6]等。
SSOs的种类与多种因素有关,最重要的是包装条件和温度[7]。SSOs鉴定方法有两种,培养基分离鉴定和分子生物学鉴定,前一种方法需要利用培养基进行单菌落分离,操作复杂且无法检测不可培养微生物[8],但目前仍广泛应用。高通量测序作为一种新型分子生物学技术较多地应用于腐败菌菌相的检测,能一次并行对几十万到几百万条DNA分子进行序列测定。小黄鱼作为中国三大海产品之一,极易发生腐败变质,而其相关研究却非常少。本课题以小黄鱼为原料,采用培养基分离法和高通量测序技术,探究包装条件对4℃冷藏(4℃更接近实际情况)小黄鱼SSOs的影响,为后期针对性抑菌,延长小黄鱼货架期提供理论依据。
1 材料与方法
1.1 材料与试剂
舟山小黄鱼(50 g/尾~70 g/尾):购于浙江省舟山市沈家门码头,选取的小黄鱼外形完整,无明显机械损伤,色泽较为艳丽。采用碎冰泡沫箱包装并在5 h内运输至杭州。
大豆酪蛋白琼脂培养基(Soybean-Casein Digest Agar Medium,TSA)、假单胞选择性培养基(Pseudomonas CFC Selective Agar,CFC)、结晶紫中性红胆盐葡萄糖琼脂(Violet Red Bile Glucose Ager,VRBGA)、贝尔德-帕克琼脂(Baird-Parker Ager,BP)、乳酸菌培养琼脂(Man Rogosa Sharpe Ager,MRS):青岛海博生物技术有限公司;离心柱细菌基因组DNA提取试剂盒:天根生化科技有限公司;2×Planta Max Master Mix:南京诺唯赞生物科技有限公司。
1.2 仪器设备
YS-DQ-400立式真空包装机:杭州永创智能设备有限公司;DT-6D气调包装机:大江机械设备有限公司;I Mix均质机:法国InterLab有限公司;HE-120核酸电泳仪:上海天能科技有限公司;VS-F PCR仪:杭州瀚基科技有限公司;5418R冷冻离心机:德国Eppendorf公司。
1.3 方法
1.3.1 样品制备
小黄鱼用清水清洗后,分别用无菌袋、真空袋和气调包装盒(气体比例为N2∶CO2=1∶1)包装,每种包装条件下各8批,每批3条鱼均独立包装,置于4℃冰箱,每隔1天取出2条小黄鱼分别进行感官评价和菌落总数测定。
1.3.2 菌落总数测定
参照国标GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》[9],于无菌条件下切取5.0 g腐败鱼皮(这里的鱼皮是指用镊子撕下来后,鱼皮和鱼肉都有,内脏因为不食用不考虑计数)置于均质袋中,加入45 mL无菌生理盐水,均质5 min,进行梯度稀释,选取适宜的稀释度吸取1 mL,TSA培养基倾注摇匀,每个梯度做3个平行,置于27℃条件下培养48 h[10],选取菌落数在30~300之间的平板作为有效平板,样品中细菌总数(Total viable count,TVC)用每克样品中菌落形成单位表示(CFU/g)。
1.3.3 感官评定
感官评价参考Li[11]的方法并稍作改动。由12名实验室成员组成评定小组,以新鲜小黄鱼作为对照,从色泽、质构、气味角度进行感官评价,其中外观色泽占20%,黏液量、背部组织和腹部组织各占15%,气味占35%,去掉最高分和最低分后计算加权平均分。其中以5分为感官接受临界点(货架期),低于5分表示鱼已腐败不可食用。小黄鱼感官评定表见表1。
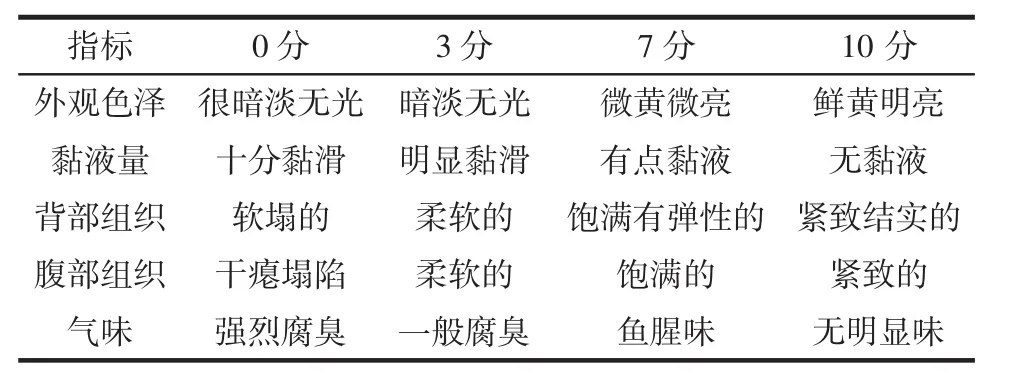
表1 小黄鱼感官评定表Table 1 Sensory evaluation standards of little yellow croaker
1.3.4 DNA提取与扩增
提取:参考黄林和Parlapani[4,12]的方法并作改动。感官评分达到5分时,取该贮藏天数的小黄鱼样品,前处理同1.3.2操作。培养基分离法:每个稀释度取200 μL菌液,分别涂布于事先晾干的培养基中(TSA、CFC、BP、MRS、VRBGA、孟加拉红),每个梯度做 3个平行。培养条件设置如下:TSA 25℃培养48 h;CFC 25℃培养 48 h;MRS 25℃培养 72 h;VRBGA 37℃培养 24 h;BP 37℃培养48 h;孟加拉红37℃培养72 h。选取有一定菌落且不互相重叠的平板,根据色泽、形态、隆起度、光滑度等挑取典型的单菌落,反复进行平板划线,得到纯化的单菌落后保存接种至30 mL营养肉汤中,并于27℃下培养18 h。扩增后的单菌液用于DNA提取。高通量测序法;直接取小黄鱼样品细菌稀释液进行DNA提取。两者均使用Tiangen细菌DNA提取试剂盒进行DNA提取。
扩增:培养基分离法以 27f(5’-AGAGTTTGATCCTGGCTCAG-3’)与 1492r(5’-GGTTACCTTGTTACGACTT-3’)为引物:高通量测序法以338f(5'-ACTCCTACGGGAGGCAGCAG-3') 与 806r (5'-GGACTACHVGGGTWTCTAAT-3')为引物。两者反应体系均为:2×Planta Max Master Mix 25 μL,引物各 2 μL,模板3 μL,ddH2O 18 μL;聚合酶链式反应(Polymerase Chain Reaction,PCR)条件为:95℃预变性3 min,95℃变性30 s,54℃退火 30 s,72℃延伸 1 min,变性退火延伸重复35个循环,最后72℃彻底延伸5 min。PCR产物采用0.8%琼脂糖凝胶电泳检测。
1.3.5 测序与分析
培养基分离法:将纯度合格的DNA样品送至上海生工有限公司测序。使用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)中的BLAST对各菌株序列分析比对,选取同源性在98%以上的菌株序列。
高通量测序法:测序、序列优化、可操作分类单元(Operational Taxonomy Unit,OTU)种属鉴定和分类分析委托南京诺唯赞生物科技有限公司进行,参考数据库为 RDP 数据库(Ribosomal Database Project)、Greengenes数据库和NCBI 16SMicrobial数据库。
2 结果与分析
2.1 感官评分
感官评价是判断食品品质的重要手段之一,根据人们的味觉、嗅觉、视觉、触觉等对食品的色香味形等进行主观评分,根据评分结果判断食品优劣程度[13]。3种包装条件下小黄鱼的感官评分如图1所示。

图1 不同包装条件下冷藏小黄鱼感官评分变化情况Fig.1 Sensory evaluation of refrigerated little yellow croaker under various conditions during storage
空气、真空和气调包装下小黄鱼的货架期分别为4、6、10 d。第 0天时鱼肉的评分为(9.30±0.86)分,等级为非常新鲜,随着贮藏时间的延长,新鲜度逐渐降低。空气组小黄鱼的从贮藏第2天开始腐臭味逐渐增强,表皮逐渐变黏稠;真空组小黄鱼的腐臭味从第4天出现,并逐渐增强,其表皮黏液量也逐渐增多,而组织结构相关的评分变化很小;气调组小黄鱼其组织结构因失水而皱缩导致弹性下降,腐臭味从第6天开始出现,但腐臭味强度不及另外两组,整个贮藏期间都没有明显的黏液产生(P<0.05)。
结果表明包装条件对小黄鱼货架期有明显的影响,不同包装条件主要为O2和CO2含量的差异,即O2和CO2含量会影响微生物的种类和代谢速率,从而造成货架期的不同[14]。
2.2 菌落总数测定
3种包装条件下小黄鱼菌落总数随贮藏时间的变化情况如图2所示。
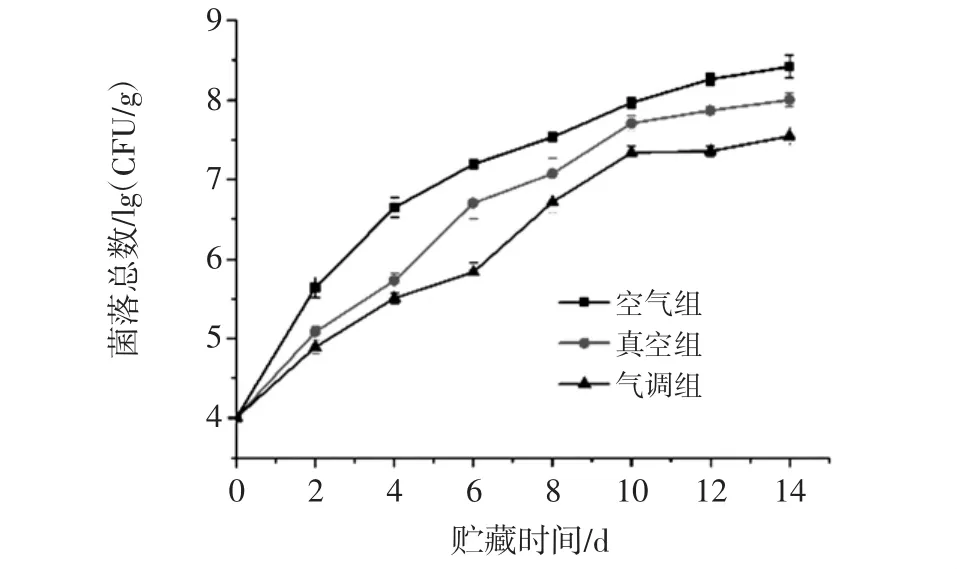
图2 3种包装条件下冷藏小黄鱼菌落总数随贮藏时间的变化情况Fig.2 Changes of total valuable counts of refrigerated little yellow croaker under various conditions during storage
初始状态下的菌落总数为4.01 lg(CFU/g),贮藏前10天里菌落总数呈指数式增长,第10到14天增长速度明显放缓。贮藏末期空气组、真空组和气调组小黄鱼的菌落总数分别达到 8.42、8.00、7.55 lg(CFU/g)。在贮藏2 d至6 d内,空气组小黄鱼的菌落总数呈现快速增长并逐步放缓的趋势,显示微生物数量渐趋饱和状态;真空组和气调组小黄鱼的菌落总数增长出现了明显的放缓,真空组在第4天出现明显的拐点,气调组在第6天出现明显的拐点,随后菌落总数又呈现快速增长,原因可能是这段贮藏期内,微生物因缺少O2、高浓度CO2这等限制因素,导致缺氧而无法存活或转而厌氧呼吸。出现拐点表示厌氧微生物在没有需氧微生物的竞争后占据主导地位,开始新一轮强烈的代谢活动。推测在贮藏后期3种包装条件下的腐败菌菌相组成会存在比较大的差异。菌落总数结合感官评分可以看出,在感官评价终点时(得分≤5),对应的腐败微生物数量均介于 6.5 lg(CFU/g)~7.5 lg(CFU/g)之间,感官评分与菌落总数之间存在着显著的相关性(P<0.05)。
2.3 DNA提取与扩增
培养基分离法:空气组从VRBGA、CFC和MRS中分别分离出3株、1株和1株腐败菌,编号A1~A5;真空组从VRBGA、CFC和MRS中分别分离出3株、2株和1株腐败菌,编号V1~V6;气调组从VRBGA、CFC和MRS中分别分离出2株、1株和1株菌,编号M1~M4,其他选择性培养基中均没有微生物生长。单菌培养提取DNA,PCR扩增16S rDNA后,产物用琼脂糖凝胶电泳检测如图3所示。

图3 培养基分离法筛选的腐败菌16s rDNA电泳图Fig.3 Electrophoregram of bacterial 16s r DNA

图4 16S rDNA V3~V4可变区电泳图Fig.4 Electrophoregram of V3~V4 variable DNA area
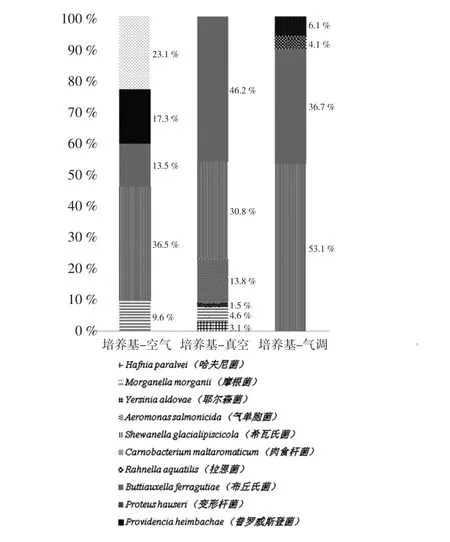
图5 培养基分离测得3种包装下的优势腐败菌组成Fig.5 Composition of SSOs in 3 conditions by culture-dependent method

图6 高通量测序法测得3种包装下的优势腐败菌组成Fig.6 Composition of SSOs in 3 conditions by culture-independent method
高通量测序法:将3种包装条件下小黄鱼表皮腐败菌悬液直接进行DNA提取,并PCR扩增V3~V4可变区,产物用琼脂糖凝胶电泳检测如如图4所示。
2.4 腐败菌检测结果分析
培养基分离法空气包装(Culture dependent method-Aerobic condition,CA)、真空包装(Culture dependent method-VP condition,CV)和气调包装(Culture dependent method-MAP condition,CM)小黄鱼 SSOs组成如图5所示;高通量测序法空气包装(High-throughput sequencing-Aerobic condition,HA),真空包装(High-throughput sequencing-VP condition,HV) 和气调包装(High-throughput sequencing-MAP condition,HM)小黄鱼SSOs组成图6所示,高通量测序结果只显示占比1%以上的腐败微生物。结果显示高通量测序法测得的腐败微生物数量和种类要远超培养基分离法,且包装条件也会对SSOs组成产生较大差异,空气条件下SSOs以需氧型为主,真空和气调包装下的SSOs主要以兼性厌氧型为主。
Shewanella glacialipiscicola是唯一一种所有条件下都检测到的腐败菌,培养基分离法检测该腐败菌所占比例要高于高通量测序法,可能是培养基过滤了不可培养腐败菌。希瓦氏菌属是生鲜肉食品常见的SSOs之一,在自然界中分布广泛,其适应力强,可通过调整其嗜盐能力来适应环境,是自然条件下海鲈鱼[10]、大菱鲆[15],真空包装白虾[16],气调包装三文鱼[17]等的SSO。S.glacialipiscicola作为优势腐败菌只被发现于大黄鱼中[18],考虑到大黄鱼和小黄鱼的亲缘关系和活动范围,这种菌株可能具有物种特异性和地区性。Carnobacterium maltaromaticum分布范围仅次于S.glacialipiscicola,除HA外,其他条件下均被检测到。该腐败菌属兼性厌氧型,在多种食品中均被发现为优势腐败菌,如鸡肉、三文鱼、南美对虾等[19-21],其在无氧条件下致腐能力较强,而在有氧条件下,其代谢活动较弱[22],因此真空包装和气调包装下该腐败菌所占比例要远高于空气包装。
空气包装下的变形杆菌属是另一种常见的腐败菌株,会对人体造成不适。Proteus Hauseri只作为生牛肉的SSO被报道[23],因此推测该种菌以人体为媒介在捕捞和运输过程中污染小黄鱼,该菌在CA下和高通量测序法下能被检测到,但在空气包装下所占比例要高于其它包装,推测其在厌氧条件下活动能力不强,加上培养基的过滤使其未在CV和CM下被检测到。Providencia heimbachae至今没有在鱼类中作为优势腐败菌被发现,但在人体排泄物中有报道[24],因此这种腐败菌污染途径可能与P.Hauseri类似。Planococcus migula只在HA下被发现,且占比达29.8%,该菌种广泛分布于海洋,但至今未有文献报道其为优势腐败菌,该腐败菌需在一定的盐浓度下生长,推测培养基的盐浓度未达到其要求而无法培养,有待进一步研究论证。
真空包装下的Aeromonas salmonicida是另一种普遍的厌氧腐败菌,其在HV条件下所占比例远大于CV,但其竞争能力较弱故作为SSO存在的时间较短[14,25],因此在气调包装的第10天已经被其他微生物所竞争淘汰而未能检测到。
气调包装下的两种检测方法间的差异性最小,C.maltaromaticum和S.glacialipiscicola两者之和占80%以上。Bacillus Cohn只在HM条件下检测到,该菌属在许多种类的食品中都有发现,特别是面团、面包、鸡蛋等[26-27],但鲜有作为水产品SSOs而被报道,张雯等发现某些芽孢杆菌对大黄鱼SSOs有一定的拮抗作用[28]。
培养基分离法检测到的一些占比较低的腐败菌在高通量测序下占比例均小于1%,而高通量测序法下一些腐败菌并未由培养基分离得到,可能的原因是该腐败菌无法在培养基上生长,有待进一步研究。由于这些腐败菌占比较低故不考虑其为冷藏小黄鱼的SSOs。
3 结论
包装方式影响小黄鱼的腐败菌种类,进而影响代谢,导致货架期的不同。检测方法影响SSOs种类和比例,主要原因是高通量测序法可以检测不可培养微生物,总体而言高通量测序法在检测腐败菌组成上的准确性要高于培养基分离法。如何减缓腐败速率是未来水产保鲜的重点研究方向之一,获得小黄鱼SSOs种类为后期针对性研究抑菌剂,如壳聚糖、Nisin及其衍生物等,提供了重要的理论基础。
参考文献:
[1]中华人民共和国国家统计局.2016年国民经济和社会发展统计公报[EB/OL].2017-02-28 http://www.stats.gov.cn/tjsj/zxfb./2017 02/t20170228_1467424.html
[2]沈月新.水产食品学[M].北京:中国农业出版社,2001
[3]Gram L,Trolle G,Huss H H.Detection of specific spoilage bacteria from fish stored at low(0℃)and high(20℃)temperatures[J].International Journal of Food Microbiology,1987,4(1):65-72
[4]黄林,陈全胜,张燕华,等.冷却猪肉优势腐败菌分离鉴定及致腐能力测定[J].食品科学,2013(1):205-209
[5]包英才,王丹,赵晓燕,等.鲜切青椒优势腐败菌的分离纯化及鉴定[J].食品工业科技,2013(3):332-334
[6]俞龙浩,贺旺林,李晶晶,等.真空包装哈尔滨红肠菌相分析及优势腐败菌初步鉴定[J].现代食品科技,2015(3):66-70
[7]Casaburi A,Piombino P,Nychas G,et al.Bacterial populations and the volatilome associated to meat spoilage[J].Food Microbiology,2015,45,Part A:83-102
[8]Parlapani F F,Meziti A,Kormas K A,et al.Indigenous and spoilage microbiota of farmed sea bream stored in ice identified by phenotypic and 16S rRNA gene analysis[J].Food Microbiology,2013,33(1):85-89
[9]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准食品微生物学检验菌落总数测定GB 4789.2-2016[S].北京:中国标准出版社,2017
[10]唐文静,王楚文,柳云龙,等.冷藏海鲈鱼优势腐败菌的筛选和鉴定[J].食品科学,2016(3):170-174
[11]Li T,Hu W,Li J,et al.Coating effects of tea polyphenol and rosemary extract combined with chitosan on the storage quality of large yellow croaker(Pseudosciaena crocea)[J].Food Control,2012,25(1):101-106
[12]Parlapani F F,Boziaris I S.Monitoring of spoilage and determination of microbial communities based on 16S rRNA gene sequence analysis of whole sea bream stored at various temperatures[J].LWTFood Science and Technology,2016,66(Supplement C):553-559
[13]董开成,杨水兵,余海霞,等.不同预冻条件对小黄鱼品质的影响[J].现代食品科技,2015(2):225-231
[14]Schirmer B C,Heiberg R,Eie T,et al.A novel packaging method with a dissolving CO2headspace combined with organic acids prolongs the shelf life of fresh salmon[J].International Journal of Food Microbiology,2009,133(1/2):154-160
[15]崔正翠,许钟,杨宪时,等.冷藏大菱鲆细菌组成变化和优势腐败菌[J].食品科学,2011(13):184-187
[16]Wang L,Liu Z,Dong S,et al.Effects of vacuum and modiied atmosphere packaging on microbial flora and shelf-life of pacific white shrimp (Litopenaeus vannamei)during controlled freezing-point storage at-0.8°C[J].Food Science and Technology Research,2014,20(6):1141-1152
[17]Powell S M,Tamplin M L.Microbial communities on Australian modified atmosphere packaged Atlantic salmon[J].Food Microbiology,2012,30(1):226-232
[18]Ge Y,Zhu J,Ye X,et al.Spoilage potential characterization of Shewanella and Pseudomonas isolated from spoiled large yellow croaker(Pseudosciaena crocea)[J].Letters in Applied Microbiology,2017,64(1):86-93
[19]Macé S,Cardinal M,Jaffrès E,et al.Evaluation of the spoilage potential of bacteria isolated from spoiled cooked whole tropical shrimp(Penaeus vannamei)stored under modified atmosphere packaging[J].Food Microbiology,2014,40:9-17
[20]Mejlholm O,Bøknæs N,Dalgaard P.Shelf life and safety aspects of chilled cooked and peeled shrimps(Pandalus borealis)in modified atmosphere packaging[J].Journal of Applied Microbiology,2005,99(1):66-76
[21]Macé S,Joffraud J,Cardinal M,et al.Evaluation of the spoilage potential of bacteria isolated from spoiled raw salmon(Salmo salar)fillets stored under modified atmosphere packaging[J].International Journal of Food Microbiology,2013,160(3):227-238
[22]Groth Laursen B,Bay L,Cleenwerck I,et al.Carnobacterium divergens and Carnobacterium maltaromaticum as spoilers or protective cultures in meat and seafood:phenotypic and genotypic characterization[J].Systematic and Applied Microbiology,2005,28(2):151-164
[23]Kurcubic V S,Maškovic P Z,Veskovic-Moracˇanin S D,et al.Influence of the herb extract on inhibition of beef meat spoilage-Potential source of natural preservative:CEFood[C].Serbia:2012-Proceedings of 6th Central European Congress on Food,2012,553-558
[24]O'Hara C M,Steigerwalt A G,Green D,et al.Isolation of Providencia heimbachae from human feces[J].Journal of Clinical Microbiology,1999,37(9):3048-3050
[25]Qian Y,Xie J,Yang S,et al.In vivo study of spoilage bacteria on polyphenoloxidase activity and melanosis of modified atmosphere packaged Pacific white shrimp[J].Food Chemistry,2014,155:126-131
[26]Techer C,Baron F,Delbrassinne L,et al.Global overview of the risk linked to the Bacillus cereus group in the egg product industry:identification of food safety and food spoilage markers[J].Journal of Applied Microbiology,2014,116(5):1344-1358
[27]Valerio F,De Bellis P,Di Biase M,et al.Diversity of spore-forming bacteria and identification of Bacillus amyloliquefaciens as a species frequently associated with the ropy spoilage of bread[J].International Journal of Food Microbiology,2012,156(3):278-285
[28]张雯,倪莉,陈雅静,等.枯草芽孢杆菌BS08对大黄鱼腐败菌的抑制及培养基优化[J].中国食品学报,2013(8):102-109
