线纹海马活性多肽的体外抗氧化活性评价
2018-05-07陈笛陈健高健曹献英
陈笛,陈健,高健,曹献英
(海南大学食品学院,海南海口570228)
抗氧化肽(Antioxidative Peptides,AP)是生物活性肽(Bioactive Peptides,BP)中具有抑制脂质过氧化和清除体内自由基功效的肽类总称[1-2]。来源于食源蛋白的AP,不仅具有不错的抗氧化活性和极高的安全性,而且可以溶于油水两相,因而在抗氧化类保健食品、生物医药及化妆品领域有较为广阔应用前景[3]。因此,利用食源蛋白制备的抗氧化肽不但可以提高人类的健康品质,而且无副作用。研究发现,一些肽的活性与其分子量、氨基酸种类、排列方式及构象有着密切关系[4]。
近年来,随着人们对海马研究的深入,海马作为制备功能食品的原料受到越来越多的关注。目前研究对海马的研究只限于药理活性和初步加工方面,如保护神经元细胞[5],增强免疫力作用[6],抗血栓作用[7]等作用。本试验选用海南养殖的线纹海马作为制备抗氧化活性肽的原料,采用超氧阴离子、DPPH自由基和羟自由基的清除率作为体外抗氧化活性指标,考查不同分子量范围内多肽的抗氧化效果,为在工业化生产海马类产品提供借鉴。
1 材料与方法
1.1 材料与试剂
线纹海马:海南龙盛生物科技发展有限公司;中性蛋白酶 BR(50 U/mg)、碱性蛋白酶 BR(200 U/mg)、木瓜蛋白酶BR(800 U/mg):北京索莱宝生物;牛血清蛋白、铁氰化钾(329.25)、卡那霉素(582.58 Da)、杆菌肽(1 422.69 Da)、溶菌酶(14 400 Da)、Sephadex G25、结晶紫、硫酸亚铁等:南宁中诺生物工程有限责任公司。
1.2 仪器与设备
DYYB-10真空冷冻干燥机:上海德洋意邦仪器;FZ102微型植物试样粉碎:上海科恒实业;AUW22分析天平:日本岛津仪器有限公司;Master Series超纯水系统:上海和泰仪器有限公司;LNK860自动凯氏定氮仪:山东绿能仪器科技;IKARRU10旋转蒸发仪:金坛市盛蓝仪器;EMF-50LE立式压力蒸汽灭菌锅:艾德生仪器。
1.3 方法
1.3.1 海马多肽的制备
先对线纹海马预处理,将其清洗干净,冻结后冷冻干燥,将冻干后的海马粉碎后过40目筛,得到的即为海马冻干粉。将海马冻干粉参照索氏提取法进行脱脂处理,方法参照GB/T 9695.7-2008《肉与肉制品总脂肪含量测定》。脱脂条件为提取剂:石油醚(60℃~90 ℃),水浴温度:65 ℃,料液比:1∶8(g/mL),脱脂时间:4 h。称取1.5 g经脱脂处理的海马粉置于烧杯中,加入30 mL超纯水后,95℃水浴加热10 min。待样品冷却至所需的酶解温度后,酸碱调节至所需pH值,再加入E/S为3%的碱性蛋白酶进行酶解,酶解3 h后,90℃水浴15 min,水浴冷却至室温,酸碱调节至中性后,使用超纯水定容至50 mL。将酶解液于9 000 r/min离心20 min,倾出上清液冷藏备用。
1.3.2 Sephadex G25凝胶层析分离条件的确定
所采用的填料类型为湿法自然沉降法,柱子规格为φ1.0 cm×50 cm,脱气处理的超纯水为洗脱剂。考查不同洗脱流速、上样体积和上样浓度对层析分离效果的影响,从而确定最佳分离条件。
1.3.3 海马多肽的分离
采用湿法自然沉降法装填Sephadex G25凝胶柱,用脱气处理的超纯水平衡装好的凝胶柱。将酶解液浓缩调整至上样浓度25 mg/mL,上样量为0.1 mL,洗脱剂为脱气处理的超纯水,洗脱流速为0.4 mL/min,设定紫外检测器检测波长为215 nm,绘制洗脱曲线。并分别按 35 min~40 min、40 min~45 min、45 min~50 min和50 min~55 min 4个时间段分管收集洗脱液,冷冻干燥后的样品配制成1.0 mg/mL,进行体外抗氧化活性测定。
1.3.4 DPPH自由基清除率的测定
取1 mL样品溶液与1 mL 50 mmol/L的DPPH无水乙醇溶液混匀,25℃避光水浴30 min,测定其在517 nm波长下的吸光度[10]。按照下式计算样品液的清除率。
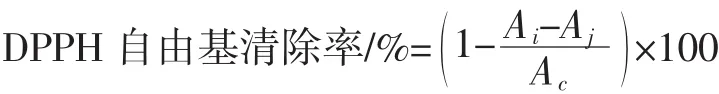
式中:Ai为样品溶解加入DPPH溶液的吸光度;Ac为无水乙醇代替样品溶液加入样品溶液的吸光度;Aj为无水乙醇代替DPPH溶液加入样品溶液的吸光度。
1.3.5 超氧阴离子清除率的测定
分别取1.5 mL 50 mmol/L的Tris-HCl缓冲液(pH8.2)、0.1 mL样品溶液和0.1 mL 45 mmol/L的邻苯三酚迅速混匀,立即在325 nm波长下,每隔30秒读取吸光度,并以时间为横坐标,吸光度为纵坐标绘制吸光度的变化曲线,计算吸光度的变化率F1。以超纯水代替样品作对照,计算吸光度的变化率F0[10]。按照下式计算样品液的清除率。

式中:F1为样品溶解阻止邻苯三酚自氧化的速率;F0为邻苯三酚自氧化速率。
1.3.6 羟自由基清除率的测定
向25 mL容量瓶中分别加入3.5 mL 0.02 mmol/L的结晶紫溶液、2.5 mL 5 mmol/L的FeSO4溶液、1.0 mL 1%的H2O2溶液和2.5 mL Tris-HCl缓冲液(pH5.5),混匀后用超纯水定容后摇匀,静置5min后,再加入1.25mL样品溶液,静置10 min后,在588 nm波长处测定其吸光度A2。按照下式计算样品液的清除率[10]。
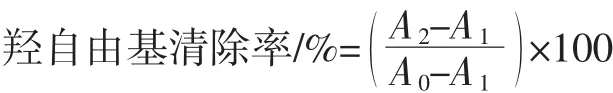
式中:A0为容量瓶中不加 FeSO4和 H2O2;A1为容量瓶中不加样品溶液。
2 结果与分析
2.1 Sephadex G25凝胶层析柱分离效果的影响因素
2.1.1 洗脱流速对Sephadex G25凝胶层析柱分离效果的影响
采用脱气后的超纯水为洗脱剂,在海马酶解液蛋白浓度为25 mg/mL,上样量为0.1 mL,设定紫外检测器的波长为215 nm,调节流速分别为0.3 mL/min和0.4 mL/min分别进行洗脱,根据洗脱图谱分析分离效果最佳的洗脱流速见图1。
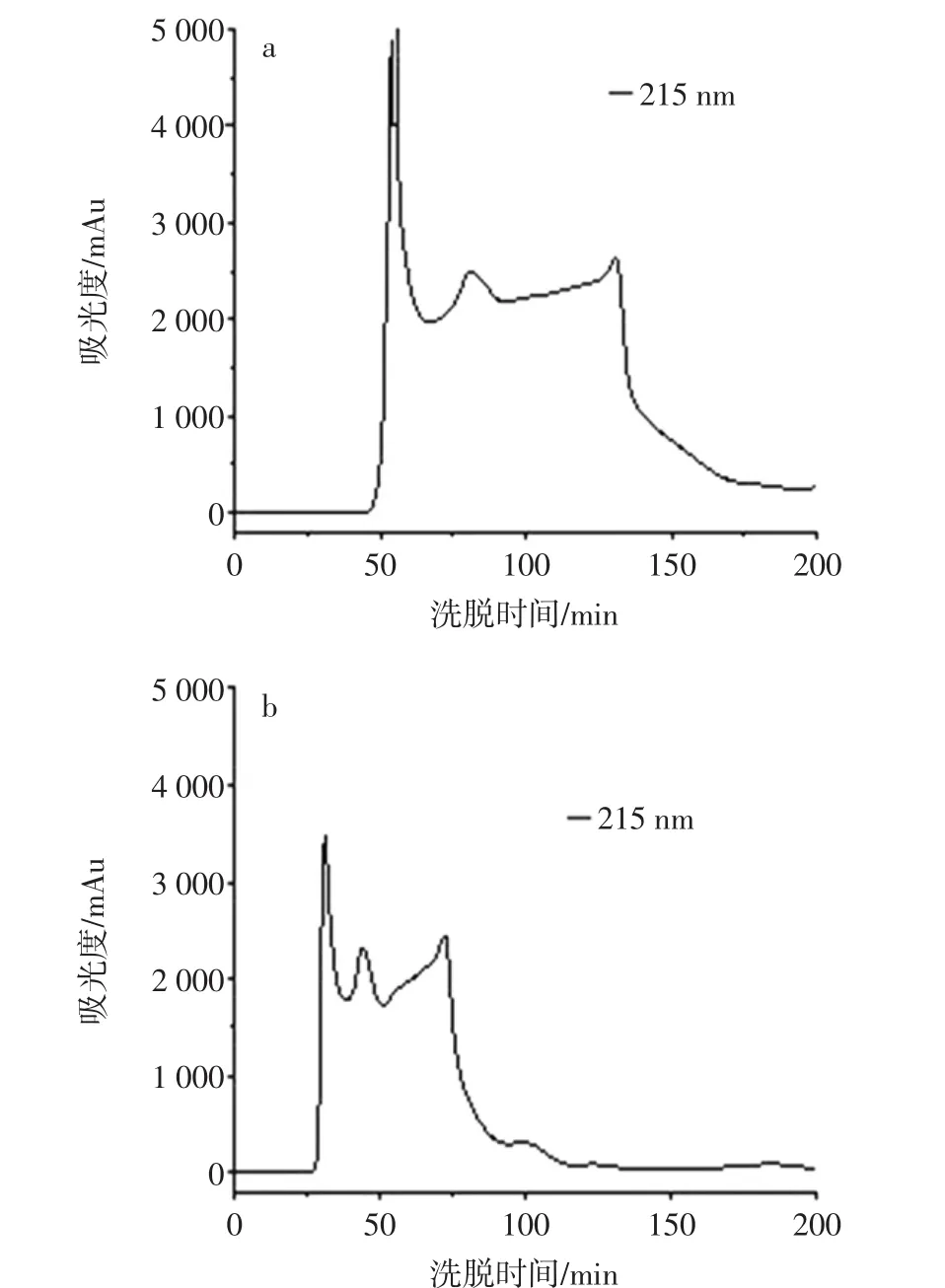
图1 不同洗脱流速对Sephadex G25层析柱分离效果的影响Fig.1 Effect of different elution flow rates on Sephadex G25 column separation
由图1可知,提高洗脱液流速会使产物提前出峰,从而减少洗脱时间,这是因为提高洗脱液流速可以提高凝胶空隙中样品中各组分物质的流动速度,从而缩短出峰时间。0.3 mL/min下的分离效果不佳,其原因是流速过小导致样品中组分扩散作用加剧,从而影响组分分离效果。洗脱剂流速是影响Sephadex G25凝胶层析柱分离效果的因素之一,过大的流速会导致各组分间的分离效果不明显,但过小的流速会因为组分间的扩散作用加剧而影响分离效果,同时,小流速下也会使分离时间加长以及降低洗脱产物的浓度,加大去除溶剂的成本,浪费时间和能源成本[11]。考虑到各组分的分离效果及分离时间,选择0.4mL/min作为洗脱液流速。
2.1.2 上样量对Sephadex G25凝胶层析柱分离效果的影响
在海马酶解液蛋白浓度为25 mg/mL,洗脱流速为0.4 mL/min,设定紫外检测器波长为215 nm,调节上样量分别为0.10、0.15 mL和0.20 mL分别进行洗脱,根据洗脱图谱分析分离效果最佳的上样量见图2。
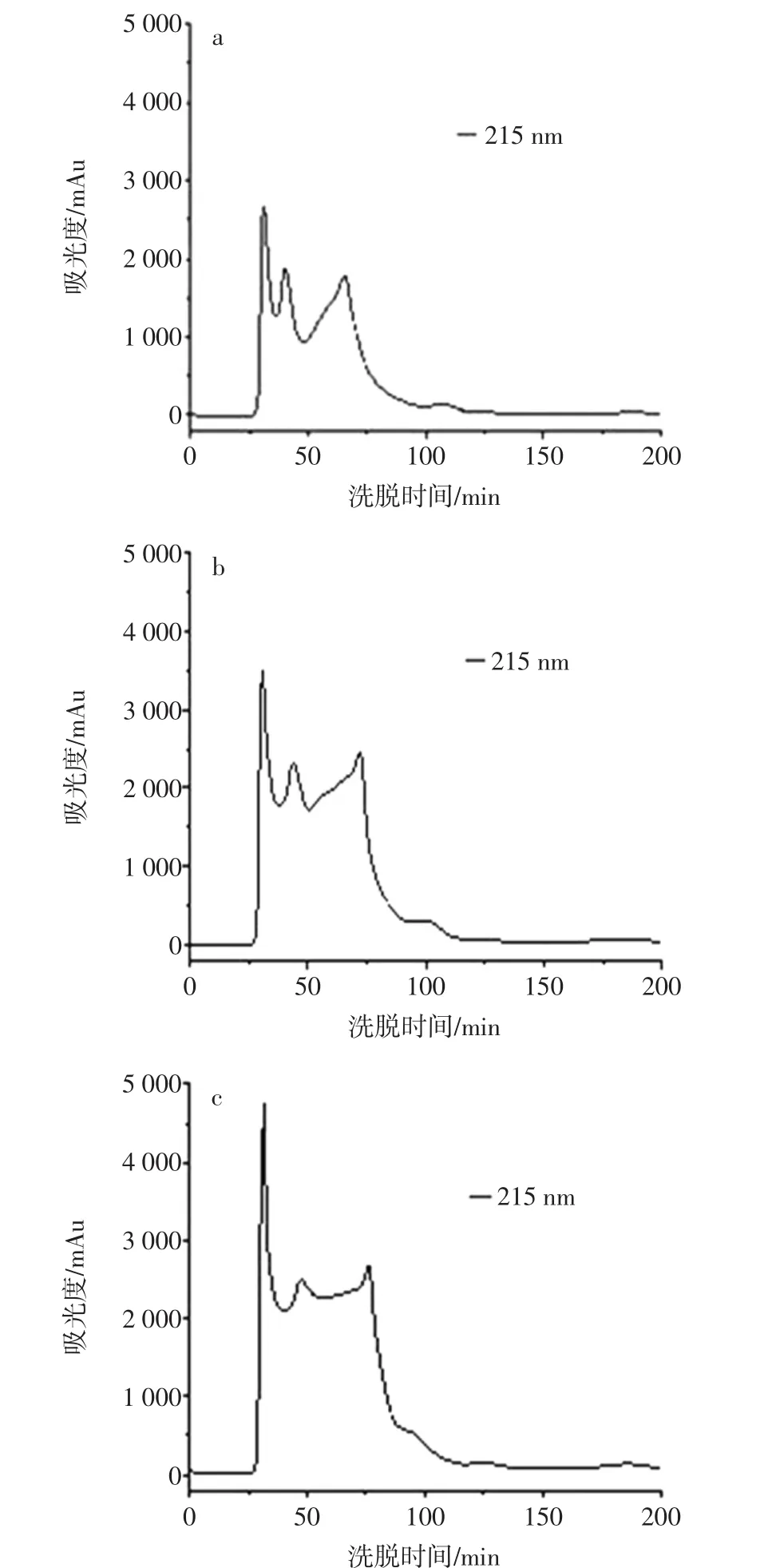
图2 不同上样量对Sephadex G25层析柱分离效果的影响Fig.2 Effect of different loading on Sephadex G25 column separation
由图2可知,增加上样量,层析柱的分离效果有所下降,当上样量为0.15 mL和0.20 mL时,峰高趋平,分离效果差。上样量为0.10 mL时,分离效果最好。这是因为上样量对层析分离效果也有较大的影响,如果上样过多,则在有限的柱效下不同组分物质分离不完全,导致分离效果差;上样过少,纯化得到的各组分量少,试验效率低[11]。
2.1.3 上样浓度对Sephadex G25凝胶层析柱分离效果的影响
采用脱气后的超纯水为洗脱剂,在洗脱流速为0.4 mL/min,上样量为0.10 mL,设定紫外检测器波长为215nm,调节海马酶解液蛋白浓度分别为10、25 mg/mL和50 mg/mL分别进行洗脱,根据洗脱图谱分析分离效果最佳的上样浓度见图3。
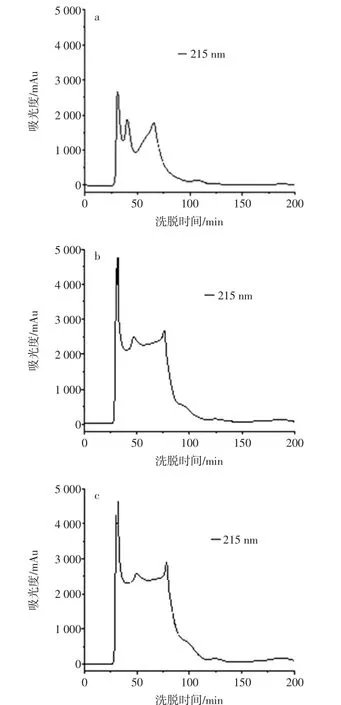
图3 不同上样浓度对Sephadex G25层析柱分离效果的影响Fig.3 Effect of different loading concentration on Sephadex G25 column separation
由图3可知,增大上样浓度,会降低层析柱的分离效果,当上样浓度增加至25 mg/mL时,吸光度响应值明显增高,分离效果有所下降,但可提高洗脱物质浓度,提高试验效率。但是当上样浓度增加至50 mg/mL时,会明显降低层析柱的分离效果。在凝胶层析分离过程中会不断稀释样品,因此需要在不影响分离效果的情况下尽可能增大上样样品的浓度。但是,增加上样浓度时,样品的黏度随之增加,影响样品中各组分物质在凝胶中的流动,从而降低凝胶层析的分辨率。因此,选择25 mg/mL为上样浓度。
2.2 酶解液及各洗脱组分对3种自由基清楚效果
2.2.1 酶解液及各洗脱组分对DPPH自由基清除效果
酶解液及不同组分对DPPH自由基清除率见图4。
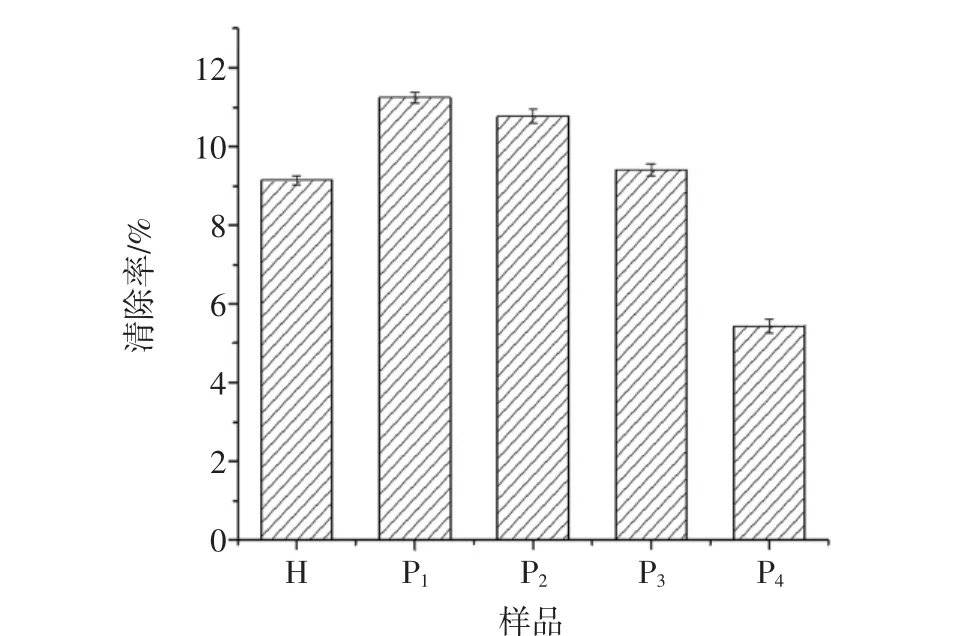
图4 酶解液及不同组分对DPPH自由基清除率Fig.4 DPPH free radical scavenging rate of the hydrolyzate and the different components
图 4结果表明,P1(0.43 kDa~1.09 kDa) 和 P2(1.09 kDa~2.78 kDa)对DPPH自由基的清除率分别为11.25%和10.77%,明显高于酶解液及其他组分,而P1的活性又略高于P2。P1组分对DPPH自由基的清除率约为P4组分的2倍,这说明低分子量的线纹海马多肽对DPPH自由基的清除能力表现更优异。其中,H(酶解液)对DPPH自由基的清除能力也优于P4,这是因为粗酶液中含有P1和P2组分,使得其表现出较好的清除效果。
2.2.2 酶解液及各洗脱组分对超氧自由基清除效果
酶解液及不同组分对超氧自由基清除率见图5。
由图5结果表明,P1(0.43 kDa~1.09 kDa)和P2(1.09 kDa~2.78 kDa)对超氧自由基的清除率分别为67.35%和61.73%,明显高于酶解液及其他组分,而P1的活性略强于P2。P4的清除能力明显低于其他组分,P1组分对超氧自由基的清除率约为P4组分的2倍,这说明低分子量的线纹海马多肽对超氧自由基的清除能力表现更优异。
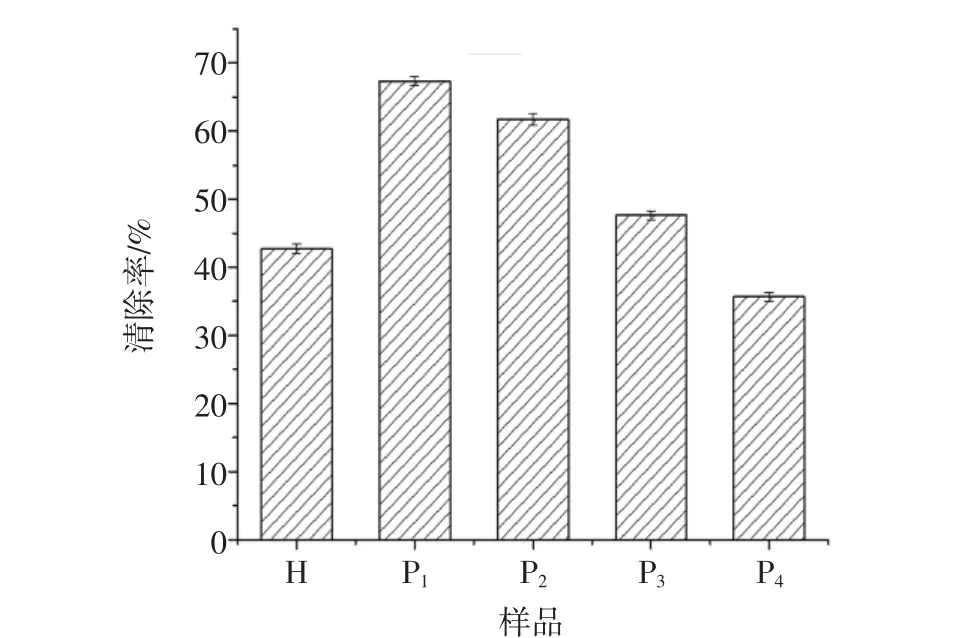
图5 酶解液及不同组分对超氧自由基清除率Fig.5 Superoxide free radical scavenging rate of the hydrolyzate and the different components
2.2.3 酶解液及各洗脱组分对羟自由基清除效果
酶解液及不同组分对羟自由基清除率见图6。
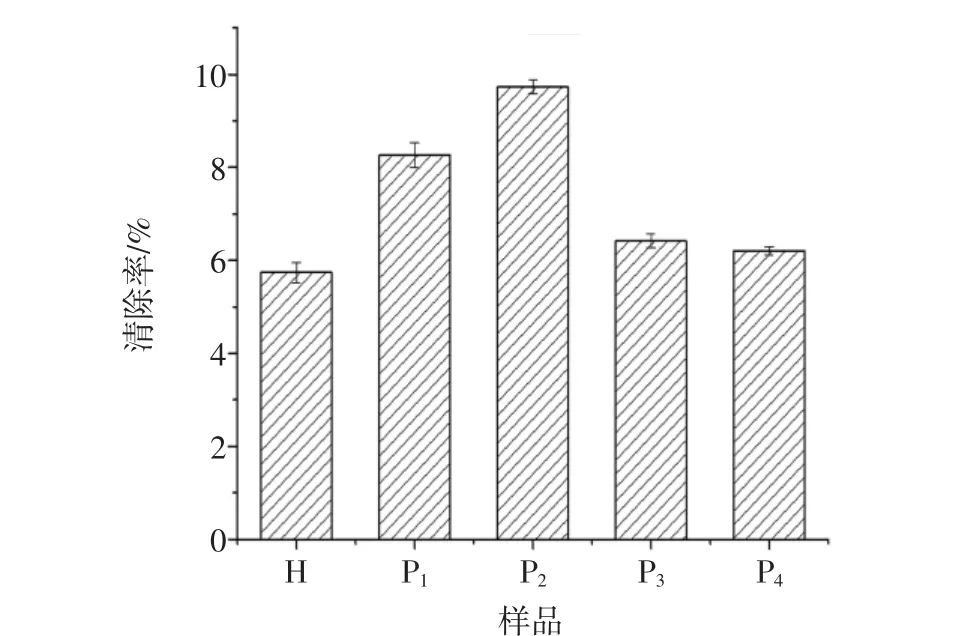
图6 酶解液及不同组分对羟自由基清除率Fig.6 Hydroxyl radical scavenging rate of the hydrolyzate and the different components
由图6结果表明,P1(0.43 kDa~1.09 kDa)和 P2(1.09 kDa~2.78kDa)对羟自由基的清除率分别为8.27%和9.73%,明显高于酶解液及其他组分,P1的活性反而弱于P2,这说明P2中包含多种对羟自由基清除能力较好的肽类物质。而其他组分对羟自由基的清除能力均表现一般。
通过以上试验结果可以看出,P1(0.43 kDa~1.09 kDa)和P2(1.09 kDa~2.78 kDa)对DPPH、超氧和羟自由基的清除能力均优于其他组分,而P1和P2的分子量又低于P3和P4,这与国内外的相关报道相一致。Jeon等采用从金枪鱼中提取的蛋白酶水解鳕鱼制得5 kDa约是10 kDa组分的抗氧化能力的2倍,表明了小分子量肽具有更好的抗氧化性能力[12]。Kim等分别采用多种蛋白酶水解牛皮明胶制得的P1(1.5 kDa~4.5 kDa)的抗氧化效果明显优于P2(4.5 kDa)组分[13-14]。林琳等水解鱿鱼皮胶原蛋白分离出3个组分P1(2 kDa)、P2(2 kDa~6 kDa)和P3(10 kDa),其中P1组分对超氧和羟自由基的清除效果显著优于P2和P3组分[15]。Onuh等报道了小分子量肽的氧自由基清除能力优于大分子量,并推测可能是小分子量肽更容易与自由基结合发挥供电子的能力[16]。韦绪芹等指出,AP的活性与其分子量大小密切相关,研究证明,低分子量多肽的抗氧化活性要比高分子量的活性好,低分子量多肽可能更有效地通过生物膜,并接近作用靶标清除自由基[8]。Fernanda等采用Alcalase酶解亚麻籽蛋白分离出6个肽段组分,F6(<1 500 Da)组分的氧自由基清除效果明显高于其他组分[17]。
3 结论
本文采用Sephadex G25凝胶层析法对线蚊海马蛋白酶解液进行分离纯化,最终确定0.4 mL/min的洗脱流速、25 mg/mL的上样浓度和0.10 mL的上样量为最佳分离条件;多肽分子量0.43 kDa~2.78 kDa范围内的组分对DPPH自由基、超氧阴离子和羟自由基的清除能力明显强于分子量大于2.78 kDa的组分。其中,P1(0.43 kDa~1.09 kDa)组分对DPPH和超氧自由基的清除能力约是P4(7.09 kDa~18.07 kDa)组分的2倍。
参考文献:
[1]张晖,唐文婷,王立,等.抗氧化肽的构效关系研究进展[J].食品与生物技术学报,2013,32(6):1673-1689
[2]张君慧,张晖,王兴国,等.抗氧化活性肽的研究进展[J].中国粮油学报,2008,23(6):227-233
[3]李振华,龚吉军,赵延华,等.抗氧化肽的研究进展[J].食品研究与开发,2011,32(6):157-161
[4]Li R,Yang Z S,Sun Y,et al.Purification and antioxidant property of antioxidative oligopeptide from short-necked clam(Ruditapes philippinarum)hydrolysate in vitro[J].Journal of aquatic food product technology,2013,10:556-565
[5]张朝晖,徐国钧,徐路珊,等.五种海马提取物对L-谷氨酸致大鼠神经元钙内流的拮抗作用[J].中国海洋药物,1994,52(4):6-9
[6]倪庆桂,张朝晖,李文琪.海马小鼠对60Co-γ照射的防护作用[J].中国中药杂志,1997,22(12):750-751
[7]冯星,巫志峰,杨柳.中药海马提取物对试验性脑缺血再灌注损伤的药理作用[J].湖南师范大学学报(医学版),2005,2(1):1-4
[8]韦绪芹,张建华,占文婷,等.海洋生物源抗氧化活性肽的制备和构效关系[J].安徽农业科学,2015,43(25):15-20
[9]Shelly H,Lei Z,Li J R.et al.Development of antioxidant rich peptides from milk protein by microbial proteases and analysis of their effects on lipid peroxidation in cooked beef[J]Food Chemistry,2009,117:438-443
[10]姜展志.海马骨粉多肽制备及其抗氧化活性研究[D].宁波:宁波大学,2014
[11]罗文峰.乌骨鸡多肽的抗氧化活性及抗氧化肽的分离纯化研究[D].广州:华南理工大学,2010
[12]Jeon Y J,Byum H G,Kim S K.Improvement of functional properties of cod frame protein hydrolysates using ultifiltration membranes[J].Process biochemistry,1999,35(5):471-478
[13]Kim S K,Kim T K,Byum H G.Purification and characterization of antioxidative peptides from bovine skin[J].Biochemistry and Molecular Biology Reports,2001,34(3):219-224
[14]Kim S K,Kim Y T,Byun H G,et al.Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska pollack skin[J].Agric Food Chem,2001,49:1984-1989
[15]林琳,李八方.鱿鱼皮胶原蛋白水解肽抗氧化活性研究[J].中国海洋药物杂志,2006,25(4):48-51
[16]Onuh J O,Girgih A T,Aluko R E,Aliani M.In vitro antioxidant properties of chicken skin enzymatic protein hydrolysates and membrane fractions[J].Food Chemistry,2014,150:366-373
[17]Fernanda Guimaraes D S,Blanca H L,Lourdes A,et al.Identification of peptides released from flaxseed(Linum usitatissimum)protein by Alcalase R hydrolysis:Antioxidant activity[J].LWT-Food Science and Technology,2017,76:140-146
