WHBE兔与日本大耳白兔腹泻型肠易激综合征模型的肠道菌群研究
2018-05-04徐孝平徐剑钦黄俊杰刘军平陈方明蔡兆伟蔡月琴潘永明
徐孝平,徐剑钦,黄俊杰,刘军平,陈方明,蔡兆伟,蔡月琴,潘永明
(浙江中医药大学动物实验研究中心/比较医学研究所,杭州 310053)
肠易激综合征(irritable bowel syndrome,IBS)是一种临床常见的胃肠功能紊乱性疾病。主要表现为慢性腹痛、腹胀伴排便习惯改变及大便性状异常,但缺乏临床能发现的可解释上述症状的器质性病变。IBS的患病率呈逐年上升趋势,相关流行病学调查显示IBS的患病率为10%~20%[1],目前IBS的病因及具体的病理生理机制并不十分清楚,研究认为可能与精神心理异常、胃肠运动障碍、内脏感觉异常、脑肠轴调节异常、胃肠道感染及肠道菌群失调等多方面因素有关。越来越多的研究显示,肠道菌群在IBS疾病的发生发展中扮演着重要角色[2]。
目前IBS动物模型制作大致可分为两类[3],一类以刺激中枢为靶点,如采用母婴分离、束缚加制动应激、冰水刺激或神经中枢内注射促肾上腺皮质激素释放因子(corticotrophin releasing factor, CRF)等;另一类以刺激外周为靶点,一般发生在胃肠道感染后发生的持续性的胃肠道功能异常,如短暂的旋毛虫感染、直肠内注射化学刺激物三硝基苯磺酸(trinitrobenzenesulfonic acid solution, TNBS)、乙酸灌胃等。尽管如此,IBS还尚无统一公认的动物模型,但由于IBS受社会—心理—神经内分泌—免疫等多因素下的致病条件,IBS造模因素已从单一因素逐渐转向复合因素的造模方法,但大多以大鼠为模型动物,但近来也已有报道用兔为模型动物建立IBS模型[4-5]。WHBE兔是本中心从日本大耳白兔(Japanese white rabbit, JW兔)生产群中发现并定向培育而建立的新实验兔封闭群,本项目组前期运用湿热应激加灌服番泻叶煎剂的方法,已成功建立了稳定的IBS模型,并发现WHBE兔对环境应激敏感,容易出现IBS症状[4]。结合前期的工作,本课题组认为应用兔作为IBS模型动物可能具有以下几点优势:(1)兔体内代谢旺盛,产热多,汗腺少,耐热力差,并对湿热环境温度变化敏感,符合IBS中医“情志致病”的条件;(2)体型适中、单笼饲养,便于开展血液、粪便等样品的多次采集;(3)兔脑体积大小适中,易于与IBS相关的脑区影像学检查,有利于从脑-肠轴角度探讨IBS;(4)相比大鼠,兔盲肠发达和代谢快,用番泻叶刺激可加速肠道功能紊乱,易于IBS发生,符合IBS中医“肝郁乘脾”的致病机理。因此,本研究在前期IBS造模基础上,运用16S rDNA高通量测序并分析,观察WHBE兔和JW兔IBS造模前后肠道菌群的变化及相互的差异,探讨肠道菌群在IBS疾病发生发展过程中的作用及影响,探讨WHBE兔在IBS发生中是否存在更为特殊的肠道菌群结构变化,为WHBE兔在IBS研究中的应用提供实验依据。
1 材料与方法
1.1 实验动物
普通级WHBE兔和JW兔各16只,体重为2.0~2.5 kg,雌雄各半,肛门四周干净,无排软便、稀便,由新昌县大市聚镇欣健兔场提供【SCXK(浙)2015-0004】,饲养于浙江中医药大学动物实验研究中心普通环境设施中【SYXK(浙)2013-0184】,室温(23±2)℃,相对湿度60%~70%,所有操作均通过浙江中医药大学实验动物管理和伦理委员会批准(IACUC批准文号:ZSLL-2016-131)。
1.2 主要仪器和试剂
仪器:GZX -9240 MBE数显鼓风干燥箱(上海博迅,中国),TJ6K天子天平(常熟双杰,中国),E12140电子分析天平(OHAUS,美国),L96G梯度型PCR仪(朗基科仪,中国),MiSeq测序系统(Illumina,美国)。试剂和药品:Premix Ex TaqTM Hot Start Version(Takara,RR030 A),DL2000 DNA Marker(Takara,3427),自制番泻叶煎剂(0.3 g生药/mL)。
1.3 兔IBS模型的建立
WHBE兔和JW兔经适应性饲养2周后,按体重随机分成4组,每组8只,雌雄各半,即WHBE兔正常对照组(WHBE rabbit NC group)、WHBE兔IBS模型组(WHBE rabbit IBS model group)、JW兔正常对照组(JW rabbit NC group)、JW兔IBS模型组(JW rabbit IBS model group)。按文献[4]建立实验兔IBS模型,IBS模型组实验兔在温度为37~39℃,相对湿度为100%的环境下每天上午开始湿热应激4 h,连续应激7 d,湿热期间不予饮食。第7天下午开始经口灌服10 mL/kg致泻剂番泻叶煎剂(0.3 g生药/mL),直至第14天结束,同时在造模期间饲料减半。正常对照组不做湿热应激,第7天开始经口灌服10 mL/kg的蒸馏水,直至第14天结束。
1.4 指标观察
1.4.1 实验动物观察
实验期间观察动物的精神活动状态、饮水、饮食、粪便等一般情况,并记录体重、腹围长度,计算腹围指数和变化率,腹围指数=腹围长度/体重,变化率=(造模后 -造模前)/造模前×100%。
1.4.2 粪便含水量观察
造模期间每天观察实验兔的粪便情况,并在造模0、5、9、14 d时收集粪便,称取湿重后,置于100℃恒温烘箱中烘干4 h后称重,计算粪便含水量,即(粪便湿重-粪便干重)/粪便湿重×100%。
1.4.3 结肠转运功能
兔实验前禁食,将实验兔固定于固定架上,然后用自制推夹器将直径6 mm的钢珠放入距肛门8~9 cm直肠内,此时开始计时,观察直肠内钢珠排出的时间。
1.4.4 结肠组织病理学观察
动物处死后取部分结肠,立即用生理盐水冲洗,肉眼初步观察有无器质性病变;用4%中性甲醛固定24 h后,常规脱水,石蜡包埋,切片,进行HE染色,光镜下观察结肠组织病理学变化。
1.5 兔结肠内容物的16S rDNA测序
造模14 d后麻醉处死动物,立即将兔腹部剃毛并用碘酒-酒精反复擦拭皮肤后,放在无菌操作工作台内,沿腹中线切开打开腹腔,取兔结肠上端的内容物,置入无菌冻存管中,-80℃保存。用DNA抽提试剂盒提取肠道内容物总DNA。使用Phusion酶扩增相应高可变区,使用DNA模板50 ng,25 μL的PCR体系,扩增25~35个循环。所用引物序列为319F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。一轮扩增反应之后,在正反向引物两端分别加上不同的adapters和barcodes,再进行扩增。扩增完成的PCR产物纯化之后进行上机测序。
1.6 统计学分析和生物信息学分析
1.6.1 统计学分析
1.6.2 生物信息学分析
对测得的原始数据进行质量优化,舍弃低质量序列,连接序列,过滤连接的序列,获得最终用于分析的序列。使用UPARSE软件,按97%的相似度对所有优化序列进行OUT(operational taxonomy units)划分。使用Mothur软件,分别计算菌群多样性指数Shannon、丰度指数Chao1。使用MetaStat软件,在门和属两个水平分析对比各组的多个样本,找出各组中百分比含量具有显著差异的微生物类型,默认阈值为0.05。
2 结果
2.1 WHBE兔和JW兔IBS模型腹围指数变化率和粪便含水量的变化
在湿热5 d后模型组动物体重增长缓慢,灌服致泻剂后出现粪便变软,粘液便,造模14 d时IBS模型组动物出现粪便不成形、稀便、摄食量减少和活动减少等症状。与正常对照组比,WHBE兔IBS模型组和JW兔IBS模型组分别在造模后第5天开始和第9天开始腹围指数变化率均明显升高(P<0.05,P<0.01),且造模第14天时WHBE兔IBS模型组的腹围指数变化率明显高于JW兔IBS模型组(P<0.05),见图1A;另外,与正常对照组比,WHBE兔和JW兔IBS模型组粪便含水量均显著升高(P<0.05,P<0.01),见图1B。
2.2 WHBE兔和JW兔IBS模型结肠运转功能的变化
与正常对照组比,造模14 d后WHBE兔和JW兔IBS模型组的结肠运转时间均明显减少(P<0.05,P<0.01)。见图2。
2.3 结肠组织病理学观察
肉眼大体观察显示,各组实验兔的结肠黏膜无明显充血、水肿或溃疡,病理HE染色显示,结肠组织中未见明显的弥漫性炎症细胞浸润等组织学的异常改变。
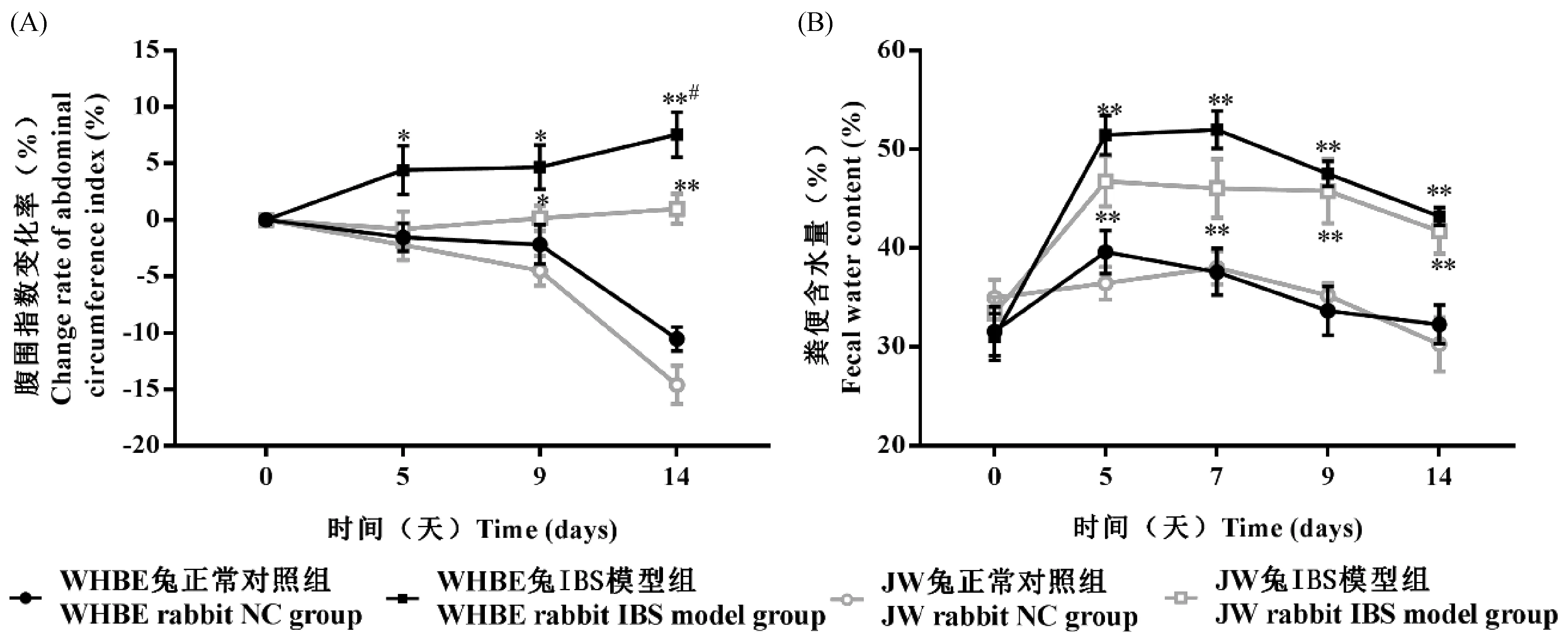
注:与正常对照组比,*P <0.05,**P <0.01;WHBE兔和JW兔比较,# P <0.05。图1 WHBE兔和JW兔IBS模型腹围指数变化率和粪便含水量的变化Note.*P<0.05,**P<0.01, compared with the normal control group.#P<0.05, WHBE rabbits compared with JW rabbits.Fig.1 Changes of abdominal circumference index and fecal water content in the WHBE rabbits and JW rabbits with IBS
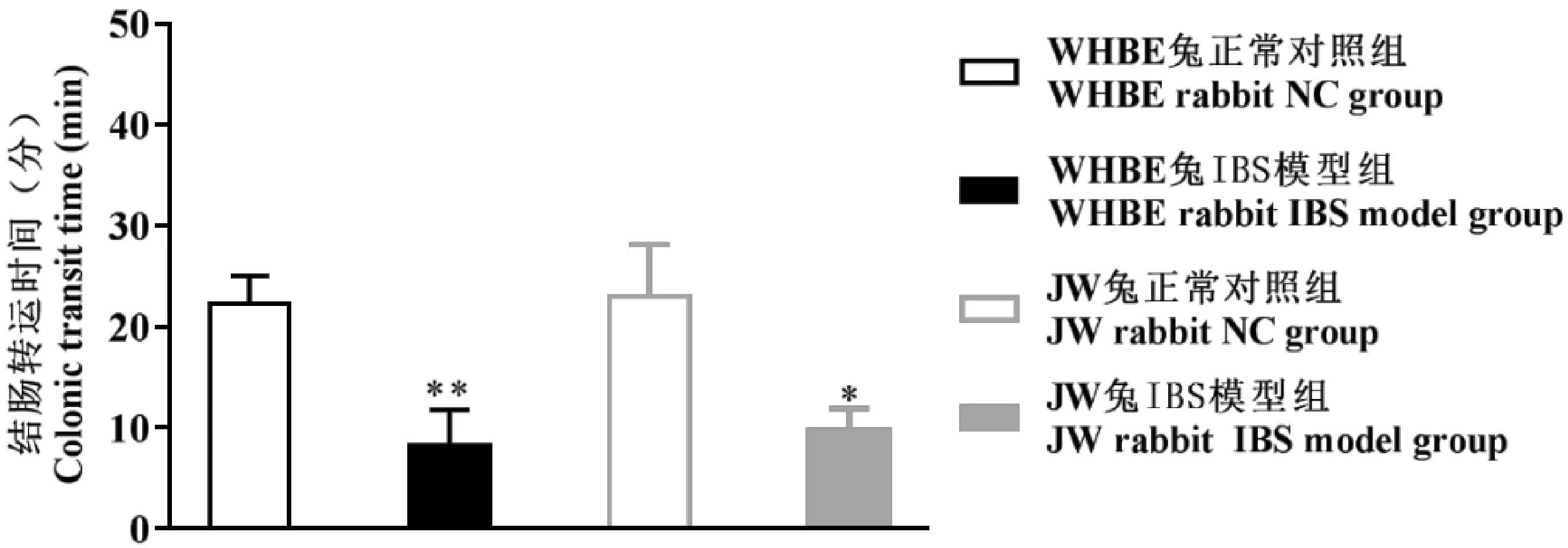
注:与正常对照组比,*P< 0.05,**P< 0.01;WHBE兔和JW兔比较,# P< 0.05。图2 WHBE兔和JW兔IBS模型结肠转运时间的变化Note.*P<0.05,**P<0.01, compared with the normal control group.#P<0.05, WHBE rabbits compared with JW rabbits.Fig.2 Changes of colonic transit time in the WHBE rabbits and JW rabbits with IBS
2.4 WHBE兔和JW兔的肠道菌群Alpha多样性分析
OTU数量(相似水平97%以上)可以代表样品物种的丰度。结果显示,WHBE兔正常对照组OTU数量最多,且WHBE兔IBS模型OTU数量有所减少,但JW兔正常对照组和IBS模型组OTU数量差异不大。同时,Alpha多样性通常用于度量群落生态中物种的丰富度,是反映丰富度和均匀度的综合指标。Shannon指数是评估微生物多样性的重要指数之一,它的值越大,说明微生物群落多样性越高。Chao1指数在生态学中常用来估计物种总数,数值越大代表群落丰度越高。与正常对照组比,WHBE兔和JW兔IBS模型组肠道菌群Shannon指数和Chao1指数均显著下降(P<0.05),另外,与JW兔相比,WHBE兔正常对照组和IBS模型组肠道菌群Shannon指数、Chao1指数均低于JW兔,但差异无显著性。见表1。
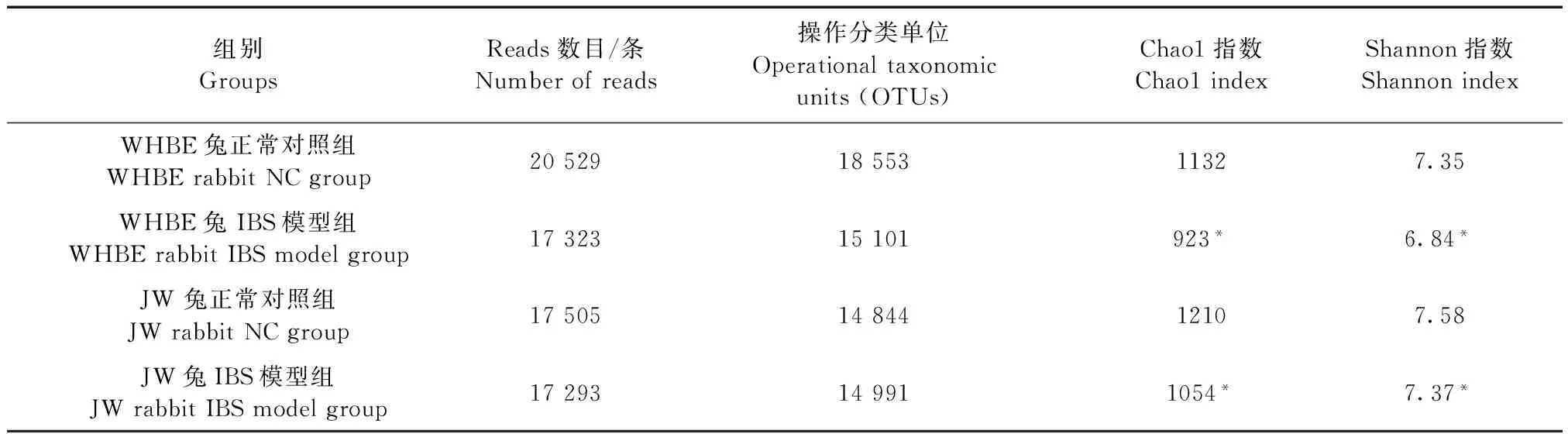
表1 WHBE兔和JW兔的肠道菌群Alpha多样性分析Tab.1 Alpha diversity analysis of intestinal microflora in the WHBE rabbits and JW rabbits
注:与正常对照组比,*P<0.05,**P<0.01;WHBE兔和JW兔比较,#P<0.05。
Note.*P<0.05,**P<0.01, compared with the normal control group.#P<0.05, WHBE rabbits compared with JW rabbits.
2.5 在门分类学水平上WHBE兔和JW兔肠道菌群相对丰度的比较
根据OTU分类分析的结果,由图3 A可知WHBE兔和JW兔肠道菌群在门水平菌群组成分布主要有14种,其中占比重较多的前7种细菌门依次为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、软壁菌门(Tenericutes)、蓝菌门(Cyanobacteria)、放线菌门(Actinobacteria),分别占所有菌群的99.57%和99.75%。其中厚壁菌门、拟杆菌门在WHBE兔或JW兔的整个兔肠道菌群中占主要部分(分别约94.93%和96.20%),是肠道菌群中的绝对优势菌群。
与正常对照组比,WHBE兔IBS模型组厚壁菌门、疣微菌门和绿弯菌门(Chloroflexi)明显下降(P<0.05,P<0.01),而拟杆菌门明显升高(P<0.01),其余各菌门差异无显著性(P> 0.05),JW兔IBS模型组各菌门差异无显著性P> 0.05);另外,WHBE兔正常对照组厚壁菌门明显低于JW兔正常对照组(P<0.05),而WHBE兔正常对照组拟杆菌门和疣微菌门明显高于JW兔正常对照组(P<0.05,P<0.01),其余各菌门差异均无显著性(P> 0.05)。此外,WHBE兔IBS模型组与JW兔IBS模型组除厚壁菌门和拟杆菌门存在差异外(P<0.01),其余各菌门差异均无显著性(P> 0.05)。见图3B-3E。
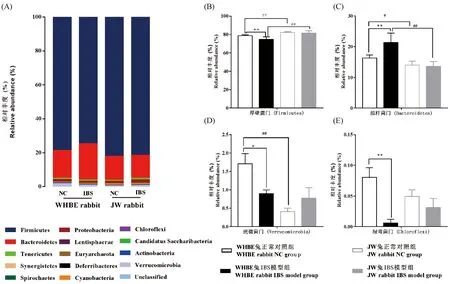
注:与正常对照组比,*P <0.05,**P <0.01;WHBE兔和JW兔比较,#P <0.05,##P <0.01。图A:各组在门水平的分类对比图;图B-E为各组有差异性菌群,依次为厚壁菌门、拟杆菌门、疣微菌门和绿弯菌门。图3 WHBE兔和JW兔在门水平上的微生物组成比较Note.*P<0.05,**P<0.01, compared with the normal control group. #P<0.05,##P <0.01, WHBE rabbits compared with JW rabbits. Fig. A, Comparison chart of classification of each group at phylum level. Fig. B-E, differential microflora in each group, in order of Firmicutes, Bacteroidetes, Verrucomicrobia, and Chloroflexi.Fig.3 Comparison of microbial composition of WHBE rabbits and JW rabbits at phylum level
2.6 在属分类学水平上各WHBE兔和JW兔肠道菌群相对丰度的比较
WHBE兔和JW兔肠道菌群种类在属水平共有112种,其中WHBE兔正常对照组发现89个属,WHBE兔IBS模型组发现106个属,JW兔正常对照组发现106个属,JW兔IBS模型组发现94个属,见图4。与正常对照组比,WHBE兔IBS模型组rc4-4菌属显著上升(P<0.05),而Akk菌属(Akkermansia)和链球菌属(Streptococcus)显著下降(P<0.05);JW兔IBS模型组优杆菌属(Eubacterium)、罕见小球菌属(Subdoligranulum)显著上升(P<0.05),乳酸杆菌属(Lactobacillus)、粪杆菌属(Coprobacter)、韦荣球菌属(Veillonella)和链球菌属(Streptococcus)均显著下降(P<0.05);另外,WHBE兔正常对照组优杆菌属(Eubacterium)、粪杆菌属(Coprobacter)、Akk菌属(Akkermansia)均显著高于JW兔正常对照组(P<0.05,P<0.01),而Odoribacter菌属、韦荣球菌属(Veillonella)、链球菌属(Streptococcus)、颤螺旋菌属(Oscillospira)、Pseudoflavonifractor菌属的相对丰度均显著低于JW兔正常对照组(P<0.05,P<0.01);此外,WHBE兔IBS模型组rc4-4菌属、粪杆菌属(Coprobacter)、梭菌属(Clostridium)均显著高于JW兔IBS模型组(P<0.05,P<0.01),而多尔氏菌属(Dorea)、粪球菌属(Coprococcus)和罕见小球菌属(Subdoligranulum)均显著低于JW兔模型对照组(P<0.05)。见图5。
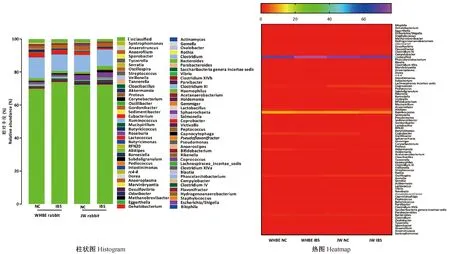
图4 WHBE兔和JW兔在属水平上的微生物组成比较Fig.4 Comparison of microbial composition in the WHBE rabbits and JW rabbits at genus level
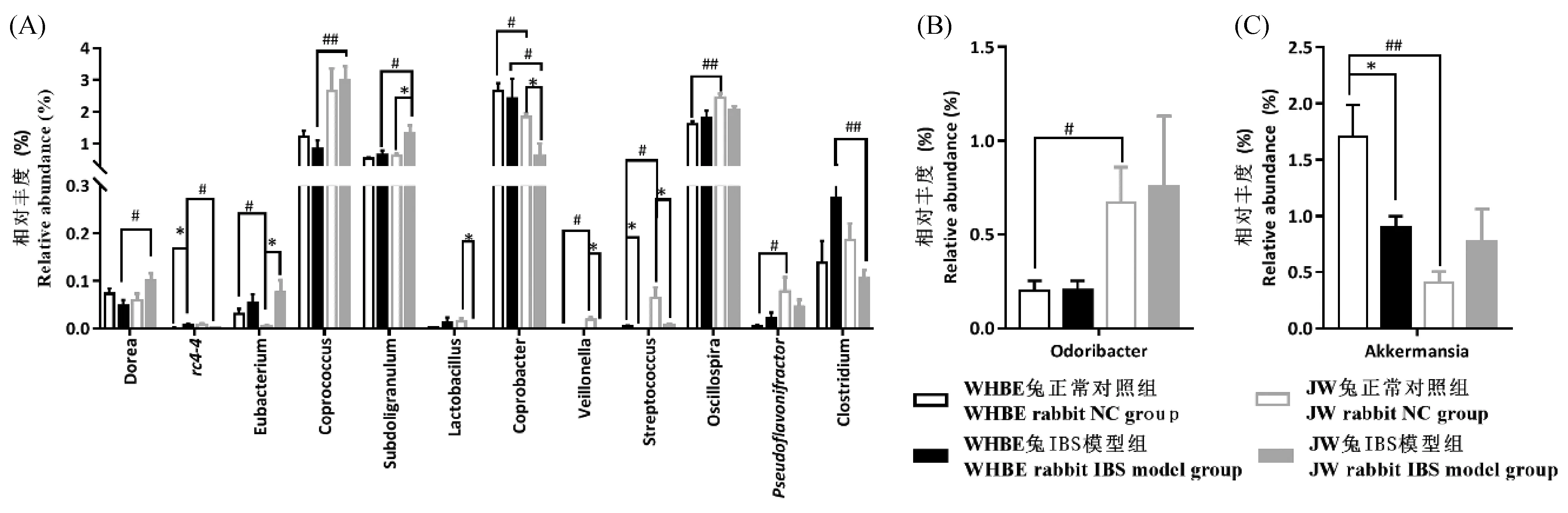
注:与正常对照组比,*P <0.05,**P <0.01;WHBE兔和JW兔比较,#P <0.05,##P <0.01。图A-C依次为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)中的差异菌属。图5 WHBE兔和JW兔在属水平上的差异性菌属Note.*P<0.05,**P<0.01, compared with the normal control group.#P<0.05,##P<0.01, WHBE rabbits compared with JW rabbits. Fig. A-C are the differential genera Firmicutes, Bacteroidetes and Verrucomicrobia, respectively.Fig.5 Differential genera of the WHBE rabbits and JW rabbits at genus level
3 讨论
众所周知,肠道菌群在IBS的发生发展中起着重要的作用。肠道菌群失调,可通过增加肠道产气,引起肠道动力紊乱,诱发肠黏膜免疫异常及提高内脏敏感性多途径引起其发病。疾病动物模型作为研究疾病发生机制和药物筛选的重要载体,本课题组前期发现WHBE兔应对外界环境因素刺激后肠道反应明显,本研究在此基础上成功复制了WHBE兔和JW兔IBS模型,但WHBE兔IBS模型不仅在腹围指数变化明显优于JW兔,同时在粪便含水量、结肠转运功能等指标的反应一致性和稳定性均优于JW兔,证实了WHBE兔对肠道反应敏感,相对更易诱发IBS。同时病理显示结肠组织未见明显的病理改变,这也符合IBS是一种功能性疾病的表现。
16S rDNA高通量测序分析被广泛用于微生物多样性及其定量、定性的分析,其中菌群多样性是用于表示群落生态中物种的丰富度,是反映丰富度和均匀度的综合指标。IBS与肠道微生态的研究表明IBS存在肠道菌群多样性下降的现象。同样,本研究结果也发现WHBE兔和JW兔IBS模型组Shannon指数和Chao1指数均明显降低,表明IBS模型菌群多样性明显降低。更有趣的是,正常状态下,WHBE兔Shannon指数和Chao1指数均低于JW兔,推测WHBE兔肠道菌群多样性存在偏低的现象,更易发生菌群紊乱,这也为WHBE兔对环境因素刺激肠道反应敏感提供有力的证据。
现有研究表明[6],在门的水平上正常人类肠道常见的菌门包括厚壁菌门、拟杆菌门、变形菌门、梭杆菌门、放线菌门、疣微菌门等,分别占到了总数的57.81%、35.74%、2.69%、1.9%、0.87%、0.26%,且厚壁菌门和拟杆菌门为优势菌群,占肠道菌群的93.55%。同样,发现WHBE兔和JW兔肠道中最常见的有7种菌门依次为厚壁菌门、拟杆菌门、变形菌门、疣微菌门、软壁菌门、蓝菌门、放线菌门,其中厚壁菌门、拟杆菌门为兔肠道优势菌群,分别占肠道菌群的94.93%和96.20%,可见WHBE兔的优势菌群与人类肠道菌群最为接近。研究发现,正常状态下WHBE兔厚壁菌门比例明显低于JW兔,并在IBS模型WHBE兔进一步出现下降,同时拟杆菌门比例明显升高,这与临床研究显示腹泻型IBS患者直肠粘膜存在厚壁菌门比例出现下降和拟杆菌门比例显著升高相一致[7];并发现拟杆菌的增加可促进过度发酵,引起肠道胀气增多,发生腹胀、不适等IBS症状[8],这与本研究发现WHBE兔IBS模型腹围指数明显增加相一致,同时WHBE兔IBS模型中还存在疣微菌门和绿弯菌门比例的下降。但JW兔IBS模型中各菌门总体丰度变化差异不明显,提示IBS模型WHBE兔肠道微生物菌群结构容易发生明显改变,导致菌群多样性降低,是导致IBS易感的原因之一。近来发现肠道菌群在调控大脑活动和情绪方面起着重要的作用,并可通过免疫-神经递质、HPA轴来发挥效应[9],在抑郁症患者中厚壁菌门丰度降低和拟杆菌门丰度升高[10],而这与IBS模型中WHBE兔厚壁菌门丰度低、拟杆菌门丰度高十分相似,结合前期研究证实WHBE兔IBS模型存在HPA轴紊乱和5-HT水平的升高[11],并表现出活动减少、表情抑郁、结肠转运功能加快的临床表征,表明WHBE兔IBS的产生与5-HT分泌增加,增加结肠的收缩,进而加快结肠转运速度,诱发IBS有关,这也符合临床IBS患者情志改变的特点,说明IBS的临床表现与肠道菌群有关。
进一步研究发现, WHBE兔IBS模型厚壁菌门的消化菌科rc4-4菌属升高,链球菌属降低以及疣微菌门Akk菌属降低;而rc4-4菌属被证实在IBS肠道高敏感大鼠中升高相一致[12]。Akk菌是新一代益生菌,于2004年由Derrien等[13]将其在人体肠道中分离出来,Akk菌依附肠道黏膜而生,Akk菌可以使用肠道黏膜上的黏蛋白作为其能源,通过竞争作用保护肠道免受病原体侵害[14]。Akk菌还可能参与了恢复肠道黏蛋白储备的机制[15],肠道中Akk菌的下降可能导致黏膜层的变薄,从而导致肠道屏障功能减弱。因此,WHBE兔正常情况下肠道中Akk菌的比例相对较高,被外界环境因素干扰后出现下降的现象,从而打破了原先存在的菌群平衡,导致肠道屏障功能减弱,腹胀明显,是诱发IBS的关键菌之一。而在JW兔IBS模型中厚壁菌门的优杆菌属、罕见小球菌属比例升高,而乳酸杆菌属、粪杆菌属和链球菌属比例下降;同样在IBS患者粪便也存在乳酸杆菌属、粪球菌属减少[7]。而且在IBS模型WHBE兔厚壁菌门的消化菌科rc4-4菌属、粪杆菌属、梭菌属均高于JW兔,多尔氏菌属、粪球菌属和罕见小球菌属则低于JW兔。也符合临床腹泻型IBS患者粪便中杆菌属升高,多尔氏菌属、粪球菌属和罕见小球菌属则减少[7],从这些菌群改变来看,WHBE兔IBS的程度确实比JW兔表现更为严重。另外,也发现WHBE兔和JW兔IBS模型中Parabacteroides菌属比例均有降低趋势,Noor等[16]研究IBS患者及正常人的粪便菌群发现,正常人Parabacteroides菌属有较高水平的表达,推测Parabacteroides菌属可能与肠易激综合征的发生有关。此外,从这两种实验兔品系来看,WHBE兔厚壁菌门的优杆菌属、粪杆菌属、AKK菌属均高于JW兔,而韦荣球菌属、链球菌属、颤螺旋菌属、瘤胃球菌科的Pseudoflavonifractor菌属则低于JW兔,以及拟杆菌门紫单胞菌科Odoribacter菌属也低于JW兔,表明这两种实验兔的肠道菌群存在明显的差异,特别是韦荣球菌属、颤螺旋菌属、瘤胃球菌属等菌群均具有产生短链脂肪酸的功能,而短链脂肪酸能保护肠道屏障功能,但在WHBE兔肠道中这些菌群均明显低于JW兔,更有力说明WHBE兔易患肠道疾病的风险性明显增加。
综上所述,IBS模型兔存在肠道菌群失调,导致菌群多样性降低;WHBE兔和JW兔IBS模型肠道菌群变化均具有其自身特点,且具有明显的差异性。
参考文献(References)
[1] Henström M, D’Amato M. Genetics of irritable bowel syndrome [J]. Mol Cell Pediatr. 2016, 3(1): 7.
[2] Jalanka-Tuovinen J, Salojärvi J, Salonen A, et al. Faecal microbiota composition and host-microbe cross-talk following gastroenteritis and in postinfectious irritable bowel syndrome [J]. Gut, 2014, 63(11): 1737-1745.
[3] 徐俊荣, 罗金燕. 肠易激综合征动物模型研究进展 [J]. 基础医学与临床, 2006, 26(8): 902-904.
Xu JR, Luo JY. Progress in building animal model of irritable bowel syndrome [J]. Basic Clin Med, 2006, 26(8):902-904.
[4] 潘永明, 张利棕, 陈民利, 等. WHBE兔脾虚型肠易激综合征模型的建立[J]. 实验动物与比较医学, 2008, 28(5): 313- 317.
Pan YM, Zhang LZ, Chen ML, et al. Study on irritable bowel syndrome model of spleen deficiency type in WHBE rabbits [J]. Lab Anim Comp Med, 2008, 28(5): 313-317.
[5] 王金贵, 王艳国, 骆雄飞,等. 摩腹法对肠易激综合征白兔模型不同脑区激活特征的影响[J]. 天津中医药, 2008, 25(5): 377-379.
Wang JG, Wang YG, Luo XF, et al. Influence of rubbing abdomen on regional encephalic activation in rabbits with irritable bowel syndrome [J]. Tianjin J Tradit Chin Med, 2008, 25(5): 377-379.
[6] 胡建广, 钟小仕, 闫静, 等. 高通量测序分析老年血液透析患者肠道菌群的改变 [J]. 中国中西医结合肾病杂志, 2017, 18(2): 127-131.
Hu JG, Zhong XS, Yan J, et al. Evaluation of intestinal microflora by high-throughput gene sequencing in elderly HD patients [J]. Chin J Integr Tradit Western Nephrol, 2017, 18(2):127-131.
[7] 李刚平. 中国腹泻型肠易激综合征患者肠道菌群的特点研究[D]. 华中科技大学, 2015.
Li GP. Characteristics of gut microbiota in Chinese patients with irritable bowel syndrome with diarrhea [D]. Huazhong University of Science and Technology, 2015.
[8] Martens EC, Koropatkin NM, Smith TJ, et al. Complex glycan catabolism by the human gut microbiota: the Bacteroidetes Sus-like paradigm [J]. J Biol Chem. 2009, 284(37): 24673-24677.
[9] Wang Y, Kasper LH. The role of microbiome in central nervous system disorders [J]. Brain behav Immun, 2014, 38: 1-12.
[10] 蒋海寅.人类肠道微生物群落菌群多样性变化与抑郁症的相关性研究 [D]. 浙江大学, 2015.
Jiang HY. Diversity of gut microbiota associated with patients with major depressive disorder [D]. Zhejiang University, 2015.
[11] 赵泓舒, 蔡月琴, 潘永明, 等. 肠易激综合征模型WHBE兔神经-体液-内分泌系统调节的变化 [J]. 中国比较医学杂志. 2013, 23(2): 26-31.
Zhao HS, Cai YQ, Pan YM, et al. Changes in the regulation of nerurohumoral- endocrine system in the WHBE rabbit with irritable bowel syndrome [J]. Chin J Comp Med, 2013, 23(2):26-31.
[12] 林泽斯. 仁术肠乐干预肠道菌群改善母婴分离IBS大鼠肠道高敏感的机制研究 [D]. 广州中医药大学, 2016.
Lin ZS. Effect on visceral hyperalgesia of NMS-induced IBS model through modulating gut microbiota and its metabolism [D]. Guangzhou University of Chinese Medicine, 2016.
[13] Derrien M, Vaughan EE, Plugge CM, et al. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium [J]. Int J Syst Evol Microbiol, 2004, 54(Pt 5): 1469-1476.
[14] Belzer C1, de Vos WM. Microbes inside-from diversity to function: the case of Akkermansia [J]. ISME J, 2012, 6(8): 1449-1458.
[15] Derrien M, Belzer C, de Vos WM. Akkermansia muciniphila and its role in regulating host functions [J]. Microb Pathog, 2017, 106: 171-181.
[16] Noor SO, Ridgway K, Scovell L, et al. Ulcerative colitis and irritable bowel patients exhibit distinct abnormalities of the gut microbiota [J]. BMC Gastroenterol, 2010, 10: 134.
