移植不同饲料利用效率猪的粪便可定向改变伪无菌小鼠的生长性能
2018-05-04李天天何贝贝李娜刘婷时梦肖英平杨华展德文王军军
李天天,何贝贝,李娜,刘婷,时梦,肖英平,杨华,展德文,王军军*
(1. 北京食品营养与人类健康高精尖创新中心,中国农业大学动物科技学院, 北京 100193; 2. 浙江省农业科学院农产品质量标准研究所,杭州 310021; 3. 斯贝福(北京)生物技术有限公司,北京 102101)
饲料利用效率关乎动物生产效益和节粮减排等重要问题,同时也是评价动物生产性能的常用指标,间接表明了动物对能量和蛋白质的利用效率。然而在生产中,即使是同一品种、同一批次的猪在饲料利用效率方面也有着很大的变异,这些变异主要源于个体遗传背景间的细微差异、妊娠期或新生期造成的表观遗传修饰以及肠道微生物菌群组成变异[1]。其中,肠道微生物被认为既在宿主健康中发挥着重要作用,同时也影响着饲料的消化以及营养物质的吸收和能量供应[2-3]。因此,肠道微生物组成结构与饲料利用效率间可能存在着特定的关联关系与影响规律。
然而,由于肠道菌群组成复杂、有成熟培养方法的微生物又不到10%[4],使得逐一研究这些微生物的功能变得不太可能。虽然通过交互共生培养法可以同时培养并研究多种肠道微生物[5],但是这种体外培养方法又忽略了肠道菌群在动物体内对营养物质消化、吸收及其对机体代谢调控的作用。粪菌移植技术与无菌动物培育技术的逐渐成熟,为进行相关研究奠定了较好的技术基础[6]。
因此,本实验拟通过构建不同饲料利用效率猪的模型,并将其粪菌移植到经混合抗生素处理的伪无菌小鼠体内,探讨不同饲料利用效率猪的粪便微生物对伪无菌小鼠生长表型的影响规律及其可能机制,以期为从肠道微生态调节的角度改善猪的饲料利用效率奠定一定的理论依据。
1 材料与方法
1.1 实验动物
28日龄断奶的无特定病原菌(SPF)C57BL/6 J小鼠36只来源于斯贝福(北京)生物技术有限公司【SCXK(京)2014-0006】。小鼠饲养在无菌隔离包内,自由采食无菌的标准颗粒鼠粮并24 h自由饮水。室内温度保持恒温23℃,相对湿度为63%,昼夜12 h循环灯光。实验小鼠饲养及组织取材均于斯贝福(北京)生物技术有限公司设备内进行【SYXK(京)2014-0037】。本实验所有操作均符合中华人民共和国《实验动物管理条例》和中国农业大学实验动物福利和伦理相关规定。
选取36头28 kg左右的阉公猪(杜×长×大)为材料,在营养代谢室中进行42 d单笼饲养,自由采食饮水。本实验所有操作均符合中国农业大学实验动物福利和伦理相关规定。生长猪动物实验在国家饲料工程技术研究中心/农业部饲料工业中心丰宁动物实验基地进行。
1.2 方法
1.2.1 不同饲料利用效率生长猪模型的构建及样品采集
选取同一品种(杜×长×大)相近体重(28.31±0.91 kg)的阉公猪36头,适应一周后进行42 d单笼饲养,自由采食及饮水。每周以动物个体为单位分别记录每头猪的采食量与体重,计算饲料转化率以及日增重;实验结束前1周使用全收粪法测定不同饲料转化效率猪的营养物质表观消化率。5 d收集期结東后, 将5 d的鲜粪样品以动物为单位集中在一起经充分混合后,于60~65℃烘干至恒重。样品干燥后粉碎,过40目筛,装袋待测。根据饲料转化效率和日增重排序(以饲料转化率为主因素并综合考虑日增重),从36头猪中选出饲料利用效率高、中、低的生长猪各6头,采集挑选出的18头生长猪新鲜粪便,液氮速冻后放于-80℃冰箱中保存。
1.2.2 伪无菌小鼠模型的构建
实验采取雌雄分养,每个笼子6只小鼠,参照Wang等[7]的方法,采用广谱抗生素处理小鼠以构建无菌小鼠模型。具体方法为:在小鼠饮用水中加入0.5 g/L万古霉素、1 g/L硫酸新霉素、1 g/L甲硝唑和1 g/L氨苄西林,自由口服28 d。参照Pang等[8]的方法,制备移植供体猪的粪便微生物。具体方法为:将猪的新鲜粪便迅速悬浮于预还原处理过的无菌生理盐水中(每克粪便加入4 mL生理盐水,即稀释5倍),漩涡混匀1 min,静置1 min,快速吸取上清,盛于1.5 mL灭菌处理过的离心管中于-20℃保存用于菌群移植。取上述抗生素处理的小鼠,分成3组,每组雌雄各6只,采用灌胃针分别用不同饲料利用效率猪粪便菌悬液进行灌胃,每次0.2 mL,连续灌注7 d。接种后连续饲养 21 d,实验结束前称取每组小鼠的体重及采食量,用于计算饲料转化率,并取小鼠粪便用于高通量测序分析。
1.2.3 DNA提取和16S rRNA基因扩增
用QIAamp DNA Stool Mini Kit(Qiagen 公司)试剂盒抽提不同饲料利用效率生长猪和受体小鼠的粪便总基因组DNA。采用引物:3′-TAC GGR AGG CAG CAG-5′和5′-AGG GTA TCT AAT CCT-3′对猪粪便16S rRNA 基因V3-V4区进行扩增,测序由北京计算中心完成。采用引物3′-CCTACGGGAG GCAGCAG-5′和5′-GGACTACVSGGGTATCTAAT-3′对小鼠粪便16S rRNA 基因V3-V4区进行扩增,测序由上海锐翌生物科技有限公司完成。16S rRNA 基因 V3-V4 区的测序均采用 Illumina Hiseq 高通量测序平台。
1.2.4 营养物质表观消化率的测定
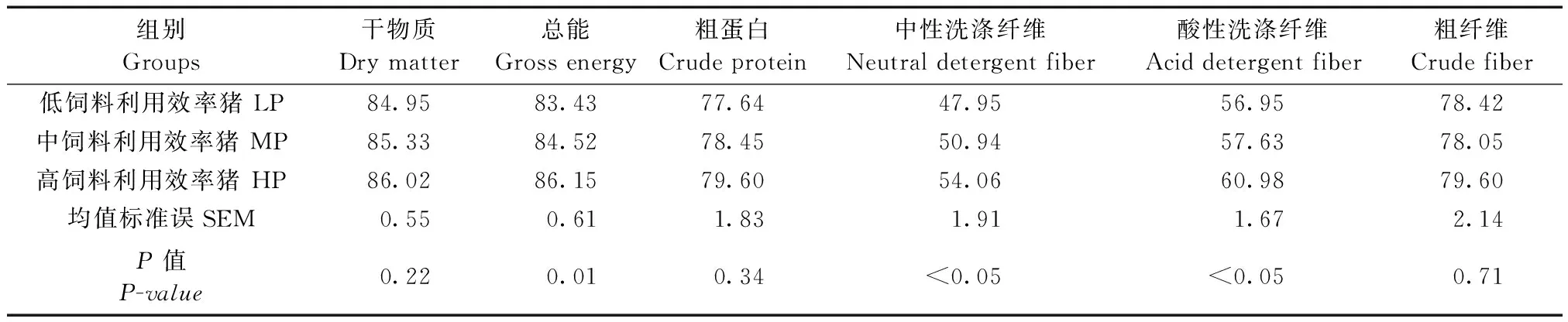
总能测定按照国际标准ISO9831∶1998推荐方法,使用氧弹式测热仪(Parr Instruments,Moline,IL)测定;使用GB/T6435—1986方法测定粪样的干物质含量;粪样中粗蛋白的含量依照AOAC(1990)的相关标准测定;中性洗涤纤维(NDF)依照BG/T 20806-2006的方法测定;酸性洗涤纤维(ADF)依照BG/T 20805-2006的方法测定。某种营养物质的表观消化率=100% - 粪样中某养分含量/饲料中某养分含量×100%。
1.3 统计学分析
2 结果
2.1 不同饲料利用效率的生长猪模型建立
用全程饲料转化率(feed conversion ratio, FCR)排序,FCR越低,表示饲料利用效率越高,反之亦然。以FCR为主,剔除日增重过小的猪只,分为高饲料利用效率猪(HP)、中饲料利用效率猪(MP)和低饲料利用效率猪(LP)三组,每组6只。分组后高、低饲料利用效率组的FCR差异有显著性(P<0.05)。
2.2 接受不同饲料利用效率猪粪便移植后受体小鼠的生长性能
实验结束前一周移植高饲料利用效率猪粪便菌群的小鼠日增重和饲料利用效率显著高于移植低饲料利用效率猪粪便菌群的小鼠,表明粪菌移植导致了生长性能表型的再现,即:高饲料利用效率受体小鼠的周增重与料重比都显著优于低饲料利用效率的受体小鼠。见表1
2.3 不同饲料利用效率猪的肠道微生物结构分析
通过对供体猪粪便微生物高通量测序结果进行alpha多样性分析,发现高饲料利用率组代表丰度的ACE指数和Chao 1指数及代表多样性的辛普森指数和香农指数都显著高于低饲料利用效率组,可知高饲料利用效率猪粪便中微生物的物种丰富度和多样性明显高于低饲料利用效率猪,见表2。对从不同饲料利用效率猪的粪便样品中获得的OTU(操作分类单位,operational taxonomic units)在属水平上进行物种注释,如图1所示,高饲料利用率组的生长猪粪便中拟杆菌属(Bacteroides)比例比低饲料利用效率猪低5.7%(P<0.05),拟普雷沃菌属(Alloprevotella)丰度比低饲料利用效率猪低4.2%(P<0.05),密螺旋体属(Treponema)丰度比低饲料利用效率猪低6.9%(P<0.05),而产气短杆菌(Methanobrevibacter)丰度则显著高于低饲料利用效率猪(P<0.05)。
2.4 接受不同饲料利用效率猪粪便移植后受体小鼠的粪便微生物结构分析
通过对受体小鼠粪便微生物高通量测序结果进行alpha多样性分析,发现高饲料利用率组辛普森指数和香农指数显著高于低饲料利用效率组,可见受体小鼠的微生物丰富度和多样性受到了供体猪的定向改变。而且,移植高、低饲料利用效率粪便的两组小鼠肠道菌群差异明显。如图2所示,高饲料利用效率受体小鼠的肠球菌(Enterococcus)和阿克曼氏菌(Akkermansia)比例显著高于低饲料利用效率受体小鼠,分别为8.7%(P<0.001)和6.5%(P<0.05)。而Lactobacillus则为低饲料利用效率受体小鼠优势菌群,占61.6%,远高于高饲料利用效率受体小鼠的14.5%(P<0.001)。
2.5 不同饲料利用效率猪的营养物质消化率
不同饲料利用效率猪营养物质表观消化率结果见表3。由表3可以看出,HP组总能表观消化率显著高于LP组(P=0.01),而干物质和粗蛋白消化率统计学差异不显著(P>0.05)。与此同时,HP组的中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)的表观消化率也显著高于LP组(P<0.05),表明HP组总能的提高与纤维的消化率提高呈正相关,提示肠道微生物可能在纤维降解功能发挥了一定的作用。
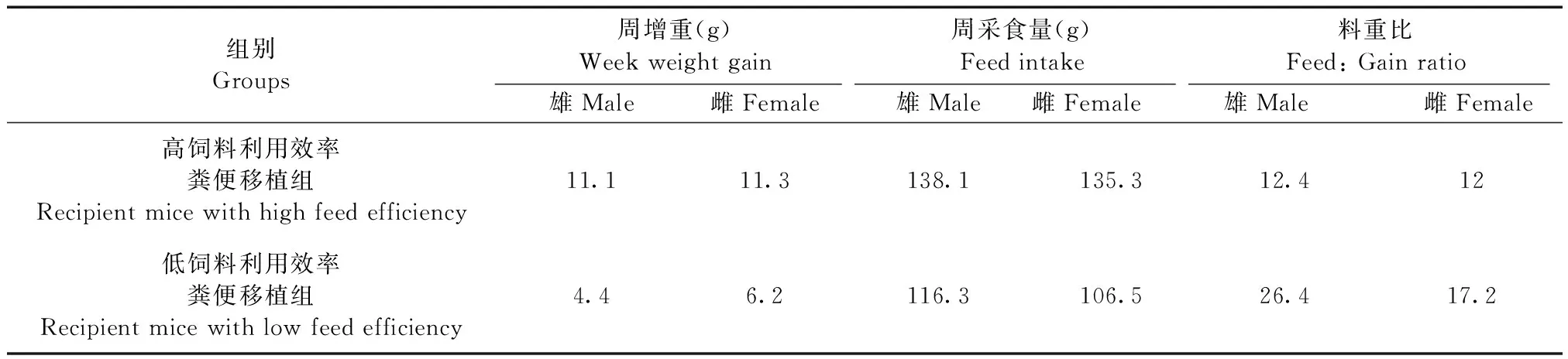
表1 不同饲料利用效率受体鼠的生长性能Tab.1 Growth performance of recipient mice with different feed efficiency
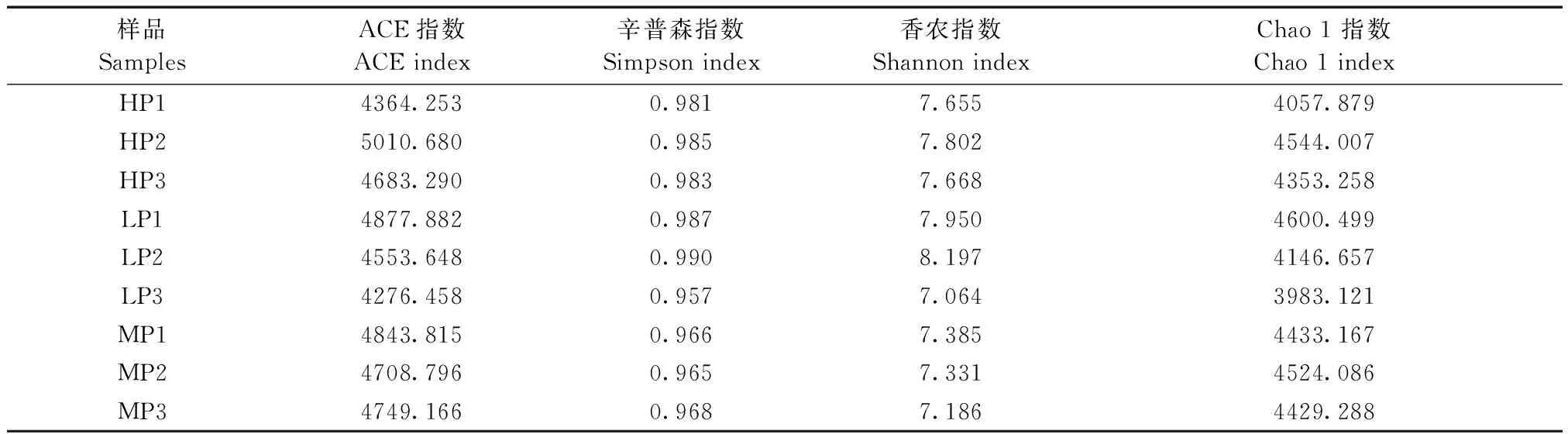
表2 不同饲料利用效率猪粪便微生物的物种丰富度和微生物多样性Tab.2 Microbial species richness and diversity of pigs with different feed efficiency
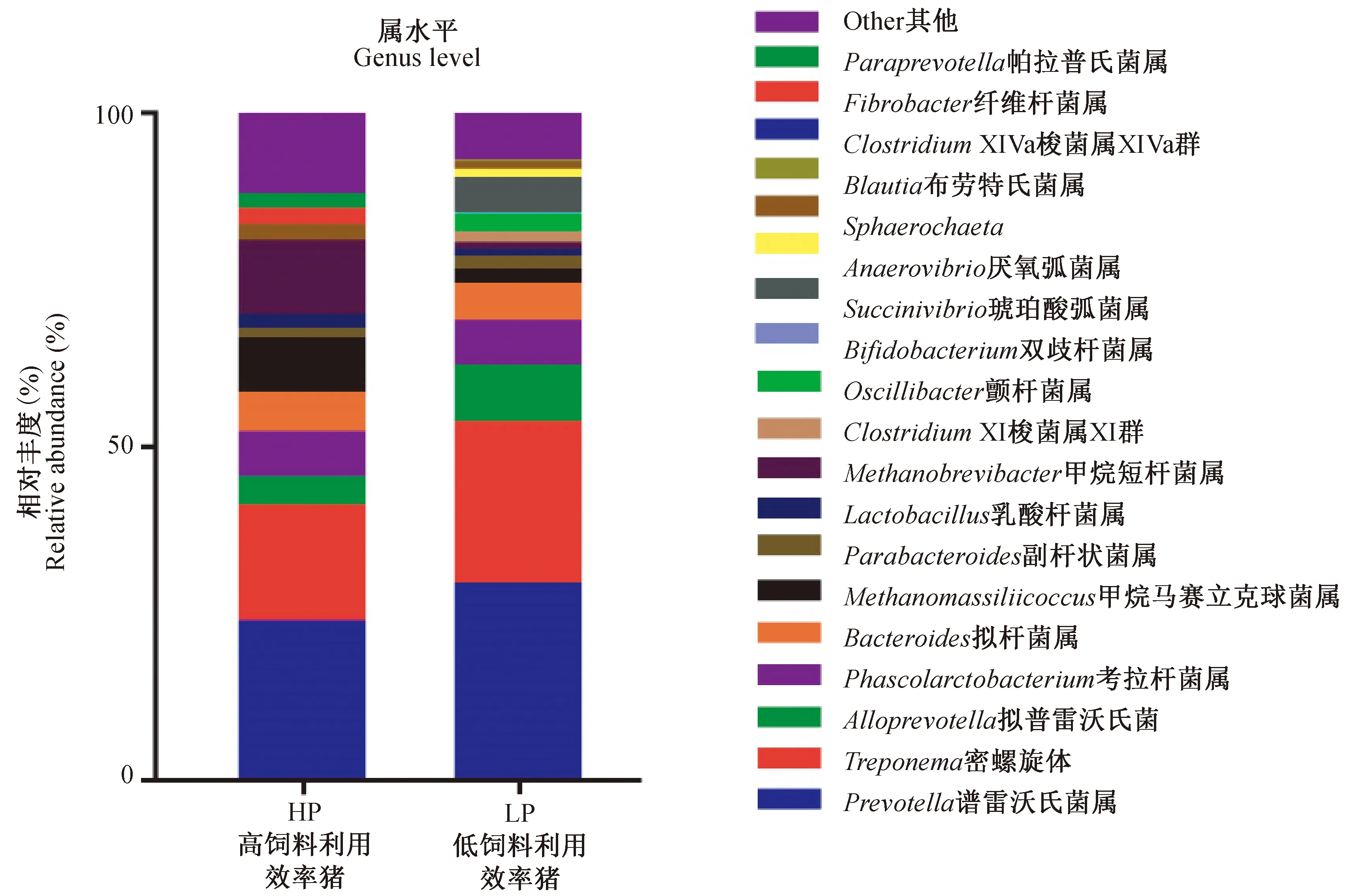
图1 高低饲料利用效率生长猪的粪便微生物组成差异Fig.1 Fecal microbiota composition of pigs with different feed efficiency at genus level
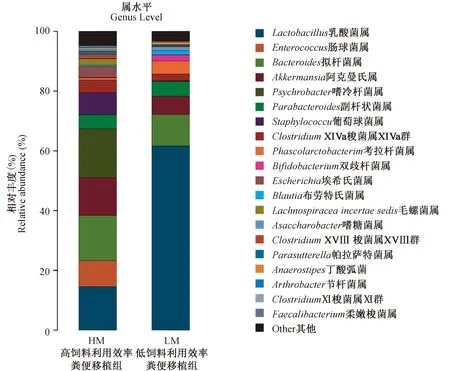
图2 高低饲料利用效率受体小鼠的粪便微生物组成差异Fig.2 Fecal microbiota composition of recipient mice at genus level
组别Groups干物质Drymatter总能Grossenergy粗蛋白Crudeprotein中性洗涤纤维Neutraldetergentfiber酸性洗涤纤维Aciddetergentfiber粗纤维Crudefiber低饲料利用效率猪LP84.9583.4377.6447.9556.9578.42中饲料利用效率猪MP85.3384.5278.4550.9457.6378.05高饲料利用效率猪HP86.0286.1579.6054.0660.9879.60均值标准误SEM0.550.611.831.911.672.14P值P-value0.220.010.34<0.05<0.050.71
3 讨论
本研究通过构建不同饲料利用效率猪的模型,挑选出不同饲料利用效率猪的粪便进行粪菌移植,受体伪无菌小鼠在移植后三周重现了其对应供体猪的生长性能和饲料利用效率表型。并初步从猪和小鼠的肠道微生物组成结构、不同饲料利用效率猪养分消化率及其与肠道微生物关系的角度对其可能机制进行了探讨。
之前的研究表明:不同品种猪粪便微生物的差异特性,可经粪菌移植向无菌小鼠部分转移,特别是肠道形态和酶活,都和供体猪一致[9]。如Yan等[10]发现与瘦肉型猪(约克夏)和其对应受体无菌小鼠相比,地方猪种(荣昌猪)和其对应的受体无菌小鼠有着较高的体脂、慢肌纤维比例并增强了腓肠肌的脂肪生成作用。而这些差异都被认为是肠道微生物发挥了主要作用。本实验中,受体小鼠定向重现了供体猪的生长表型,即接受高饲料利用效率猪粪便移植的受体小鼠在采食量、日增重及饲料利用率方面都高于接受低饲料利用效率猪粪便移植的受体小鼠。这与前期大量的人-鼠粪菌移植实验结果相吻合,即肠道微生物移植具有表型重现的介导作用[11-12]。
移植不同饲料利用效率猪的粪便在定向改变受体小鼠生长性能的同时,也定向改变了受体小鼠的微生物丰富度和多样性。香农指数和辛普森指数用来解释微生物菌种的多样性,其值越高表明肠道微生物组成越复杂,菌种之间的相互依赖和制衡能力越强,表示菌群在有外界环境波动或遭受应激刺激时能更好的应对不良因素对机体造成的负面影响,从而起到缓解机体应激的作用[13-15]。本研究中,高饲料利用效率猪及其受体小鼠的微生物丰富度和多样性都显著高于低饲料利用效率的猪及其受体小鼠,表明其在养殖环境下抗应激和不良因素的能力较强,对于其提高饲料利用效率有促进作用。此外,在鸡的研究也表明不同饲料转化率鸡空肠和盲肠的菌群存在差异,饲料转化率高的鸡盲肠菌群丰富度和多样性较高,并且推断可能会影响动物的生长性能[1]。
高饲料利用效率猪的总能消化率显著高于低饲料利用效率猪(P<0.05),且总能消化率的提升主要来源于纤维(NDF和ADF)的消化率提升与供能。由于纤维类物质不被小肠消化,进入大肠后主要由大肠微生物发酵产生短链脂肪酸,可提供机体10%~15% 的维持净能[2],所以肠道微生物对纤维消化率的贡献至关重要。通过分析不同饲料利用效率猪的肠道微生物结构发现:产气短杆菌,作为一种利用乙酸的甲烷菌,其在高饲料利用效率猪肠道中的丰度显著高于低饲料利用效率的猪,前期研究发现在瘦肉型猪中产甲烷菌的数量较高,且与较高的纤维消化率直接相关[16-18],表明其提高了高饲料利用效率猪的纤维利用率。而当粪菌移植到受体伪无菌小鼠后,移植了高饲料利用效率猪粪菌的受体鼠其肠球菌丰度显著高于低饲料利用效率的受体鼠,这与之前的研究相符,即在日粮中添加肠球菌有助于提高生长性能,并降低腹泻发生率[19-20]。同时,高饲料利用效率受体鼠的阿克曼氏菌含量显著高于低饲料利用效率受体鼠,研究发现阿克曼氏菌有助于代谢健康,葡萄糖代谢稳态以及预防肠道炎症,并发现在肥胖人群中含量低于正常人群,提示其调节脂肪代谢的作用[21-23];这表明高饲料利用效率受体鼠的肠道健康和代谢状况较好,且较少转化能量为脂肪,从而提高了能量的利用效率。值得注意的是,低饲料利用效率受体鼠的乳酸菌含量远超高饲料利用效率的受体鼠,但是其过高的含量大大降低了其微生物多样性,不利于动物的生产性能,虽然大量研究表明乳酸菌可以促进免疫系统成熟和肠道健康[24],进而促进动物的生产性能[25-26];但是双盲实验中发现在健康人群中添加乳酸菌基本没有效果[27],表明在洁净环境中乳酸菌对生产性能可能没有帮助。
总之,本研究在构建不同饲料利用效率猪模型的基础上,通过粪菌移植在伪无菌小鼠中成功重现了供体猪的微生物组成结构、生长性能表型,验证了肠道微生物在营养物质利用和机体代谢中起重要调节作用的科学假设,并初步揭示了肠道微生物组成与能量消化率、生长性能间的关联关系,为生产实践中从肠道微生态调节的角度改善猪群的整体饲料利用效率奠定了一定的理论基础。
参考文献(References)
[1 ] Stanley D, Denman SE, Hughes RJ, et al. Intestinal microbiota associated with differential feed conversion efficiency in chickens [J]. Appl Microbiol Biot, 2012, 96(5): 1361-1369.
[2 ] 朱伟云, 余凯凡, 慕春龙, 等. 猪的肠道微生物与宿主营养代谢 [J]. 动物营养学报, 2014,26(10): 3046-3051.
Zhu WY, Yu KF, Mu CL,et al. Gut microbiota and host nutrition metabolism in pigs [J]. Chin J Animal Nutrit, 2014,26(10): 3046-3051.
[3 ] Shanahan F. The host-microbe interface within the gut [J]. Best Pract Res Clin Gastroenterol, 2002,16(6): 915-931.
[4 ] Alain K, Querellou J. Cultivating the uncultured: limits, advances and future challenges [J]. Extremophiles, 2009,13(4): 583-594.
[5 ] Egan M, Motherway MOC, Kilcoyne M, et al. Cross-feeding by Bifidobacterium breve UCC2003 during co-cultivation with Bifidobacterium bifidum PRL2010 in a mucin-based medium [J]. BMC Microbiol, 2014, 14(1): 282.
[6 ] Aroniadis OC, Brandt LJ. Fecal microbiota transplantation: past, present and future [J]. Curr Opin Gastroen, 2013,29(1): 79-84.
[7 ] Wang Z, Klipfell E, Bennett BJ, et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease [J]. Nature, 2011, 472(7341): 57.
[8 ] Pang X, Hua X, Yang Q, et al. Inter-species transplantation of gut microbiota from human to pigs [J]. ISME J, 2007, 1(2): 156.
[9 ] Diao H, Yan H, Xiao Y, et al. Intestinal microbiota could transfer host gut characteristics from pigs to mice [J]. BMC Microbiol, 2016, 16(1): 238.
[10] Yan H, Diao H, Xiao Y, et al. Gut microbiota can transfer fiber characteristics and lipid metabolic profiles of skeletal muscle from pigs to germ-free mice [J]. Sci Rep, 2016, 6: 31786.
[11] Walker AW, Parkhill J. Fighting obesity with bacteria [J]. Science, 2013, 341(6150): 1069-1070.
[12] Ridaura VK, Faith JJ, Rey FE, et al. Gut microbiota from twins discordant for obesity modulate metabolism in mice [J]. Science. 2013, 341(6150): 1241214.
[13] Shanahan F. Probiotics in perspective [J]. Gastroenterology, 2010, 139(6): 1808-1812.
[14] Hooper LV, Macpherson AJ. Immune adaptations that maintain homeostasis with the intestinal microbiota [J]. Nat Rev Immunol, 2010, 10(3): 159.
[15] 何贝贝, 李天天, 朱玉华, 等. 不同生长性能猪肠道菌群差异分析 [J]. 动物营养学报, 2014, 26(8): 2327-2334.
He BB, Li TT, Zhu YH,et al. Differential analysis of intestinal microflora in pigs with different growth performance [J]. Chin J Animal Nutrit, 2014, 26(8): 2327-2334.
[16] Guevarra RB, Kim J, Nguyen SG, et al. Comparison of fecal microbial communities between white and black pigs [J]. J Appl Biol Chem, 2015, 58(4): 369-375.
[17] Luo Y, Chen H, Yu B, et al. Dietary pea fiber increases diversity of colonic methanogens of pigs with a shift from Methanobrevibacter to Methanomassiliicoccus-like genus and change in numbers of three hydrogenotrophs [J]. BMC Microbiol, 2017, 17(1): 17.
[18] Luo Y, Su Y, Wright AG, et al. Lean breed Landrace pigs harbor fecal methanogens at higher diversity and density than obese breed Erhualian pigs [J]. Archaea, 2012, 2012(5): 605289.
[19] Hu Y, Dun Y, Li S, et al. Dietary Enterococcus faecalis LAB31 improves growth performance, reduces diarrhea, and increases fecal Lactobacillus number of weaned piglets [J]. PLoS One, 2015, 10(1): e0116635.
[20] Li P, Niu Q, Wei Q, et al. Microbial shifts in the porcine distal gut in response to diets supplemented with Enterococcus Faecalis as alternatives to antibiotics [J]. Sci Reports, 2017, 7: 41395.
[21] Anhê FF, Roy D, Pilon G, et al. A polyphenol-rich cranberry extract protects from diet-induced obesity, insulin resistance and intestinal inflammation in association with increased Akkermansia spp. population in the gut microbiota of mice [J]. Gut, 2015, 64(6): 872-883.
[22] Dao MC, Everard A, Aron-Wisnewsky J, et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology [J]. Gut,2016, 65: 426-436.
[23] Shin NR, Lee JC, Lee HY, et al. An increase in the Akkermansia spp. population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice [J]. Gut, 2014, 63(5): 727-735.
[24] Kumar A, Vlasova AN, Liu Z, et al. In vivo gut transcriptome responses to Lactobacillus rhamnosus GG and Lactobacillus acidophilus in neonatal gnotobiotic piglets [J]. Gut Microbes, 2014, 5(2): 152-164.
[25] Lan R, Tran H, Kim I. Effects of probiotics supplementation in different nutrient density diets on growth performance, nutrient digestibility, blood profiles, fecal microflora and noxious gas emission in weaning pigs [J]. J Sci Food Agric, 2017, 97(4): 1335-1341.
[26] Lan RX, Koo JM, Kim IH. Effects of Lactobacillus acidophilus supplementation in different energy and nutrient density diets on growth performance, nutrient digestibility, blood characteristics, fecal microbiota shedding, and fecal noxious gas emission in weaning pigs [J]. Animal Feed Sci Technol, 2016, 219: 181-188.
[27] West NP, Pyne DB, Cripps A, et al. Gut balance, a synbiotic supplement, increases fecal Lactobacillus paracasei but has little effect on immunity in healthy physically active individuals [J]. Gut Microbes, 2012, 3(3): 221-227.
