硫辛酸合成酶在Leprdb/db小鼠肝肾中的表达
2018-05-04彭强赵英政闫婷婷翟晓楠张旭旭易宪文张合喜徐光翠
彭强,赵英政,闫婷婷,翟晓楠,张旭旭,易宪文,张合喜,徐光翠
(新乡医学院公共卫生学院,河南 新乡 453003)
肥胖和糖尿病严重威胁人类健康,2016年的一项研究显示我国肥胖人口数全球第一, 18岁及以上成年人中糖尿病患病率高达11.6%[1-2]。瘦素受体缺陷的Leprdb/db小鼠由于阻断了其瘦素信号通路,使食物摄入量增加,产热量下降,导致小鼠肥胖,其发病过程与人类的2型糖尿病的发生过程类似[3]。硫辛酸(lipoic acid)是一种强抗氧化剂,临床上已用于防治糖尿病周围神经病变。硫辛酸是在线粒体内由硫辛酸合成酶(lipoic acid synthase, LIAS)合成,其作用与硫辛酸合成酶的表达密切相关。目前关于瘦素和硫辛酸合成酶的作用关系还不清楚,Leprdb/db小鼠体内LIAS蛋白表达的研究尚未见报道。本实验通过检测Leprdb/db小鼠糖脂代谢相关指标及肝、肾中LIAS蛋白的表达,探讨阻断瘦素信号通路导致的小鼠糖脂代谢紊乱是否与LIAS蛋白的表达量相关,为明确硫辛酸在调控糖脂代谢中的作用机理,探索肥胖和糖尿病的防治新策略提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级Leprdb/+及Leprdb/db小鼠来自Jackson实验室(北卡罗来纳大学易宪文教授赠送)。动物饲养于SPF级动物房【SYXK(豫) 2014-0005】,自由摄食(上海斯莱康SPF级小鼠专用饲料)和饮水,室温20~25℃,相对湿度60%~70%,昼夜明暗交替时间12 h /12 h。所有动物实验操作将遵守新乡医学院实验动物伦理管理条例。
1.1.2 试剂和仪器
总胆固醇试剂盒(南京建成,中国,批号20170708)、甘油三脂试剂盒(南京建成,中国,批号20170708)、高密度脂蛋白试剂盒(南京建成,中国,批号20161229)、低密度脂蛋白试剂盒(南京建成,中国,批号20161228)、谷丙转氨酶(ALT)试剂盒(南京建成,中国,批号20170719)、谷草转氨酶(AST)试剂盒(南京建成,中国,批号20170719),磷酸酶抑制剂、RIPA裂解液、线粒体分离试剂盒、BCA蛋白浓度测定试剂盒(上海碧云天,中国),蛋白质marker (北京全式金,中国),兔多抗LIAS抗体(Proteintech,美国),兔多抗GAPDH抗体(杭州贤至,中国);强生稳豪型血糖仪 (强生,美国),低温离心机(Eppendorf,德国,5424R),电泳仪(北京六一,中国,JY300C),多功能酶标仪(Thermo,美国,EnSpireTM2300)。
1.2 方法
1.2.1 线粒体的制备
选取10周龄的Leprdb/+及Leprdb/db雄性小鼠各8只,即为Leprdb/+组和Leprdb/db组。禁食8 h后,测量两组小鼠体重,同时,采用强生稳豪型血糖仪测定小鼠空腹血糖(fasting plasma glucose,FPG)。经乙醚麻醉,腹主动脉采血后,处死动物,分离肝、肾并称重。取肝右叶及左肾组织于4%多聚甲醛固定,其余肝、肾组织-80℃保存。取200 mg肝、肾组织,用玻璃匀浆器于冰水浴中匀浆20次。用线粒体分离试剂盒采用差速离心法提取肝、肾组织线粒体。
1.2.2 肝肾组织病理学检查
组织固定24 h后,酒精梯度脱水,常规石蜡包埋,切片(4 μm),苏木素-伊红(HE)染色,封片后光镜下观察两组肝、肾组织病理变化并拍照。
1.2.3 血清生化指标检测
分离血清,按试剂盒说明书进行操作,采用酶标仪检测血清中总胆固醇(CHO)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL),谷丙转氨酶(ALT),谷草转氨酶(AST)含量。
1.2.4 Western blot法检测肝、肾组织线粒体内LIAS蛋白的表达
取已制备的线粒体,加入200 μL临用前添加了苯甲基磺酰氟(PMSF)(终浓度为1 mmol/L)的线粒体裂解液。裂解后的蛋白样品采用BCA法进行蛋白定量。参照解现星等[4]的方法检测肝、肾组织线粒体内LIAS蛋白。蛋白变性后,采用SDS-聚丙烯酰胺凝胶电泳分析。用电转膜仪转到PVDF膜上,用含5% 脱脂奶粉的封闭液(TBST)室温封闭2 h,按1∶2000加入LIAS抗体,按1∶1000加入GADPH抗体,4℃ 孵育过夜。TBST充分洗涤PVDF膜,按1∶8000的稀释倍数加入二抗,37℃孵育2 h,再次用TBST洗涤,用ECL显色并曝光,采用BandScan分析胶片灰度值。
1.3 统计学处理
2 结果
2.1 Leprdb/+和Leprdb/db小鼠体重及其脏器系数比较
与Leprdb/+小鼠比较,Leprdb/db小鼠体重、肝重、肝器系数及肾重均明显升高,而肾器系数降低,差异有显著性(P<0.05)。见表1。
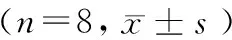
表1 Leprdb/+和Leprdb/db小鼠体重、肝肾重量及其脏器系数比较Tab.1 Comparison of body weight, liver, kidney weight and their organ coefficients in the Leprdb/+and Leprdb/dbmice(n=8,
注:*与Leprdb/+组比较,*P<0.05。
Note. Compared with theLeprdb/+mice,*P<0.05.
2.2 Leprdb/+和Leprdb/db小鼠肝肾组织病理学观察
由图1可见,对照组Leprdb/+小鼠肝、肾组织结构完整,无明显病理学改变;而Leprdb/db小鼠肝细胞出现脂肪变性,肾小球肥大,基地膜增厚,系膜区增宽,系膜细胞和系膜基质增多等病理学改变。
2.3 Leprdb/+和Leprdb/db小鼠生化指标的测定
表2可见,空腹血糖Leprdb/db小鼠明显高于Leprdb/+小鼠,两者相比较差异有显著性(P<0.01);与Leprdb/+小鼠比较,Leprdb/db小鼠CHO、TG、LDL,ALT均明显升高差异有显著性(P<0.05)。
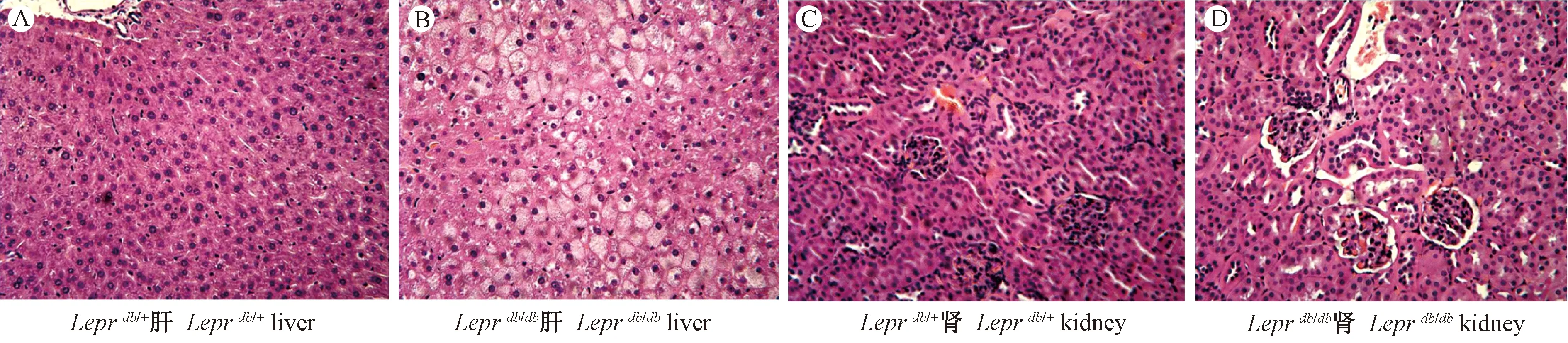
图1 Leprdb/+和Leprdb/db两组小鼠肝、肾细胞形态病理观察(HE染色,×100)Fig.1 Pathological observation of cellular morphology from liver and kidney tissues in the Leprdb/+and Leprdb/dbmice(HE staining, ×100)

动物组Animalgroups空腹血糖FPG(mmol/L)总胆固醇CHO(mmol/L)甘油三脂TG(mmol/L)高密度脂蛋白HDL(mmol/L)低密度脂蛋白LDL(mmol/L)谷草转氨酶AST(U/L)谷丙转氨酶ALT(U/L)Leprdb/+组5.63±1.612.56±0.540.70±0.193.36±0.420.21±0.0324.83±9.2912.66±4.39Leprdb/db组14.42±4.60**4.89±1.29*1.43±0.31*2.91±0.431.35±0.61*25.47±5.7750.20±16.52**
注:与Leprdb/+组比较,*P<0.05;与Leprdb/+组比较,**P<0.01。
Note.Compared with theLeprdb/+mice,*P<0.05. Compared with theLeprdb/+mice,**P<0.01.
2.4 Western blot 法检测Leprdb/+和Leprdb/db小鼠肝肾线粒体中LIAS蛋白表达
Western blot检测结果显示,Leprdb/db小鼠在肝肾线粒体中LIAS蛋白表达量均高于Leprdb/+小鼠,差异均有显著性(P<0.05)。见图2、3。
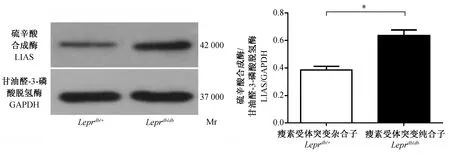
注:*与Leprdb/+组比较,*P<0.05。下图同。图2 Western blot法检测Leprdb/+和Leprdb/db小鼠肝线粒体中LIAS蛋白表达Note. compared with the Leprdb/+ mice. The same in the following FigFig. 2 Expressions of LIAS in mitochondria of Leprdb/+and Leprdb/db mouse liver tissues by western blot analysis
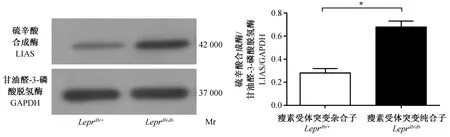
图3 Western blot 法检测Leprdb/+和Leprdb/db小鼠肾线粒体中LIAS蛋白表达Fig.3 Expressions of LIAS in mitochondria of Leprdb/+and Leprdb/db mouse renal tissues by western blot analysis
3 讨论
随着生活水平的提高,饮食过剩和运动不足使肥胖成为全球性流行病,而肥胖容易引起胰岛素抵抗,导致糖尿病[5]。糖尿病是以慢性高血糖为特征的一种代谢性疾病,其中2 型糖尿病占该病的95%,已成为严重威胁人类健康的常见慢性疾病,在全世界范围内的发病率呈现逐年增长趋势。对肥胖、糖尿病及其并发症的研究已成为生物医学研究的热点。
Leprdb/db小鼠是leptin受体基因缺陷导致先天肥胖并呈现2 型糖尿病特征的模型动物。该小鼠位于4 号染色体的瘦素受体基因发生突变,主要表现为下丘脑缺陷,对饱感物质(瘦素) 缺乏反应,具有高血糖、高胰岛素血症、糖代谢异常等特征,与人类2 型糖尿病临床症状极为相似,是研究人类2 型糖尿病良好的动物模型[6]。
实验动物脏器重量和脏器系数是鉴定动物遗传质量的重要依据,反应了模型动物的生物学特性及相应脏器的损害[7]。本研究结果显示,Leprdb/db小鼠体重、肝、肝器系数及肾重量明显大于Leprdb/+组小鼠,而肾器系数小于Leprdb/+组小鼠,与吕晶晶等[9]研究结果一致[8]。2型糖尿病动物模型会出现胰岛增生肥大的病理改变,糖尿病肾病是典型的糖尿病并发症,也是造成慢性肾功能衰竭的常见原因。本研究发现Leprdb/db小鼠血清AST明显升高。AST主要分布在肝细胞浆和肝细胞线粒体中,是反映肝损伤的一个重要指标,它的升高提示肝细胞损伤达到了细胞器水平。Leprdb/db小鼠出现了糖尿病发展过程中肝、肾的典型病理改变,镜下可见Leprdb/db小鼠肝细胞出现脂肪变性,肾小球肥大,基底膜增厚,系膜区增宽,包括系膜细胞和系膜基质增多等形态学改变。
血糖是评价糖尿病的重要指标,高血糖是由于对胰岛素作用的抵抗以及胰岛素分泌代偿不足造成的。2型糖尿病是一种机体对胰岛素抵抗而引起的病变,而胰岛素抵抗常引起脂质代谢异常。因为胰岛素有促进脂蛋白分解的作用,当胰岛素抵抗时,富含甘油三酯的脂蛋白在血中堆积,包括乳糜微粒、极低密度脂蛋白、中密度脂蛋白等,导致患者血液中的甘油三酯明显升高,同时,低密度脂蛋白胆固醇、极低密度脂蛋白胆固醇也会不同程度的升高。脂肪代谢紊乱对糖尿病及其并发症的发生有着重要的作用。本研究结果显示Leprdb/db小鼠空腹血糖明显高于Leprdb/+小鼠,Leprdb/db小鼠CHO、TG、LDL均明显升高,这与文献报道结果一致[8,10]。
硫辛酸是由线粒体中硫辛酸合成酶 (LIAS)产生的强抗氧化剂,可以清除体内多种自由基并能还原其他抗氧化剂,在体内抗氧化系统调控中发挥重要作用[11-13]。由于其在线粒体内生成,可通过抗氧化而发挥保护线粒体作用,同时参与能量代谢,是几种线粒体酶如丙酮酸脱氢酶复合酶的辅酶,因而硫辛酸合成酶对糖尿病及其慢性并发症发挥重要调控作用[14]。本研究利用Western blot法检测Leprdb/+和Leprdb/db小鼠肝肾线粒体中LIAS蛋白表达,发现Leprdb/db小鼠的肝肾线粒体中LIAS蛋白表达量均高于Leprdb/+小鼠,差异有显著性,表明LIAS蛋白在Leprdb/db小鼠和Leprdb/+小鼠中有着不同表达,其在瘦素受体缺陷导致的糖脂代谢紊乱中可能发挥调节作用。
综上,瘦素受体缺陷的Leprdb/db小鼠存在糖脂代谢紊乱,肝、肾细胞病理损伤;Leprdb/db小鼠肝、肾线粒体中LIAS蛋白表达明显高于Leprdb/+小鼠。提示对LIAS蛋白表达的调控有望成为防治肥胖和糖尿病的新策略。
参考文献(References)
[1] NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in diabetes since 1980: a pooled analysis of 751 population-based studies with 4.4 million participants [J]. Lancet (London, England), 2016, 387(10027): 1513-1530.
[2] Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults [J]. JAMA, 2013, 310(9): 948-959.
[3] 刘芳,杨华,周文江,等.诱发性2型糖尿病小鼠模型与自发性db/db小鼠特性的比较 [J].中国实验动物学报,2014,22(06): 54-59.
Liu F, Yang H, Zhou WJ, et al. Comparison of the characteristics of induced and spontaneous db/db mouse models of type 2 diabetes mellitus [J]. Acta Lab Anim Sci Sin, 2014, 22(06): 54-59.
[4] 解现星,张涛,赵爽,等.苏子油对肥胖大鼠 肝脏极低密度脂蛋白 合成关键 基因 表达的 影响. 中国实验动物学报,2015,23(05):474-478.
Xie XX, Zhang T, Zhao S, et al. Effect of perilla oil on the key gene expression regulating hepatic VLDL synthesis in obese rats [J]. Acta Lab Anim Sci Sin, 2015, 23(05): 474-478.
[5] 吴静,王华旻,李晶,等.db /db小鼠的实验室应用 [J]. 生理科学进展,2013,44(1): 12-18.
Wu J, Wang HM, Li J, et al. The research applications of db/db mouse [J]. Prog Physiol Sci, 2013, 44(1): 12-18.
[6] Portha B. Programmed disorders of beta-cell development and function as one cause for type 2 diabetes? The GK rat paradigm [J]. Diab Metab Res Rev, 2005, 21(6): 495-504.
[7] 田小芸,恽时锋,周森妹,等.C57BL/KsJ-db/db、+/db小鼠主要脏器重量及脏器系数的测定[J]. 中国比较医学杂志,2006,16(4): 220-222.
Tian XY, Yun SF, Zhou SM, et al. The weight of main organs and organ coefficient in db/db and +/db mice[J]. Chin J Comp Med, 2006, 16(4): 220-222.
[8] 吕晶晶,王彩霞,魏娜,等.自发性2 型糖尿病小鼠db /db的生物学特性 [J].沈阳药科大学学报, 2013, 30(6): 455-459.
Lyu JJ, Wang CX, Wei N, et al. Study on biological characteristics of spontaneous type 2 diabetic db /db mice [J]. J Shenyang Pharmaceutical University, 2013, 30(6): 455-459.
[9] Homo-Delarche F, Calderari S, Irminger J C, et al. Islet inflammation and fibrosis in a spontaneous model of type 2 diabetes, the GK rat [J]. Diabetes, 2006, 55(6): 16-25.
[10] 江丽青,王晓武,谭延振,等.GDF11对II型糖尿病小鼠心肌损伤的保护作用 [J].中国实验动物学报,2017, 25(4): 362-367.
Jiang LQ,Wang XW,Tan YZ,et al. Protective effect of growth differentiation factor 11 on myocardial injury in type II diabetic mice [J]. Acta Lab Anim Sci Sin, 2017, 25(4): 362-367.
[11] Packer L, Kraemer K, Rimbach G. Molecular aspects of lipoic acid in the prevention of diabetes complications [J]. Nutrition, 2001, 17(10): 888-895.
[12] Liu J. The effects and mechanisms of mitochondrial nutrient alpha-lipoic acid on improving age-associated mitochondrial and cognitive dysfunction: an overview [J]. Neurochem Res, 2008, 33(1): 194-203.
[13] Jones W, Li X, Qu ZC, et al. Uptake, recycling, and antioxidant actions of α-lipoic acid in endothelial cells [J]. Free Radical Biol Med, 2002, 33(1): 83-93.
[14] Ames BN. Review article: Delaying the mitochondrial decay of aging—a metabolic tune-up [J]. Ann New York Acad Sci, 2004, 1019(5-6): 331-338.
