细菌纤维素固定化漆酶对活性艳蓝KN-R脱色的研究1
2018-05-03吴月红袁海彬
吴月红, 袁海彬, 洪 枫, 陈 琳*
(1. 东华大学 生态纺织教育部重点实验室,上海 201620;2. 东华大学 化学化工与生物工程学院,上海 201620)
印染废水严重污染水体环境[1-2]。蒽醌染料是一种广泛使用的染料,但其结构很稳定,不易脱色[3]。目前常用的脱色方法有物理法、化学法和生物法等[4],生物酶法由于绿色环保的特点备受关注[5]。漆酶(Laccase;EC 1.10.3.2.)是一种含铜的多酚氧化还原酶[6],该酶对染料脱色的研究较多[7-8]。在反应过程中,漆酶以氧气作为第二底物被还原成水[9-11]。在细菌纤维素(Bacterial Cellulose, BC)固定化漆酶方面的相关研究较多:袁海彬等[12]采用不同菌株来源的BC固定化漆酶并比较了固定化酶的催化效率;Zou等[13]使用BC微球为载体固定化漆酶,Chen等[14]用BC模块固定化真菌漆酶并对该固定化酶进行了表征;固定的漆酶可用于处理染料废水[15-16]。BC是一种生物合成的纤维素高聚物,具有可生物降解、多孔和比表面积大等特性[17],是一种理想的固定化载体。
本文以 BC膜固定化漆酶,并进行填柱组装生物反应器,研究该固定化酶及生物反应器对蒽醌染料——活性艳蓝KN-R的降解脱色效果。与之前的报道相比,本研究是首次采用以BC膜固定化的漆酶填充组装生物反应器,并对活性艳蓝KN-R进行脱色。在物理吸附和生物酶降解共同作用下,大大增加了脱色效果。
1 实验
1.1 材料与试剂
漆酶购自山东苏柯汉生物工程股份有限公司,由白腐真菌发酵而来,酶活655.6 U/g;2,2ʼ-连氮-双(3-乙基苯并噻唑-6-磺酸)(简称 ABTS)购自上海源叶生物科技有限公司;活性艳蓝 KN-R染料购自国药集团化学试剂有限公司,配制200 mg/L活性艳蓝KN-R储备液待用。其它所用试剂均为分析纯。
BC膜由实验室发酵制备而来:将斜面保藏的木醋杆菌(Komagataeibacter xylinus ATCC 23770)用接种环接入种子培养基中,在30℃和160 r/min的摇床中活化培养20 h,然后按5%(V/V)的接种量接入发酵培养基,最后放入30℃恒温培养箱中静置发酵培养12 d,木醋杆菌将在气液界面分泌纤维素形成细菌纤维素膜。实验所用培养基组成为:葡萄糖25 g/L,蛋白胨5 g/L,酵母粉3 g/L,培养基配好后用柠檬酸将pH值调至5.0,在115℃高压灭菌锅下灭菌30 min。
将获得的细菌纤维素膜用0.5%(w/V)的氢氧化钠水溶液在80℃下浸泡2 h,分别连续处理3次以上,再用去离子水浸泡2 d以上,纯化后的膜放入4℃冰箱储存备用。称取1 g漆酶(酶活为655.6 U/g)溶于10 mL NaAC-HAC(0.2 mol/L,pH5.0)水溶液中配置漆酶溶液,放入4℃冰箱待用。
1.2 漆酶的固定化及酶活测定
将细菌纤维素膜剪成大小均匀的块状(1 cm×1 cm)在冷冻干燥机中冻干,冻干后的膜块浸没于漆酶溶液中,在恒温振荡水浴锅中,于室温和100 r/min速率下吸附2 h以上,酶分子通过物理吸附负载到细菌纤维素膜上,完成固定化,取出后用NaAc-HAc缓冲溶液漂洗3次,于4℃冰箱中保存。
游离酶活力的测定:ABTS为反应底物[18],反应体系总体积为3 mL,包含1 mL NaAc-HAc缓冲溶液(0.2 mol/L,pH5.0),1 mL ABTS(1 mM,εABTS=36 000 M-1cm-1),和1 mL适量稀释漆酶水溶液,在紫外-可见分光光度计中于420 nm处测其3 min内吸光值的变化,计算斜率k值,求其酶活。固定化酶酶活测定体系包含1 mL NaAc-HAc缓冲溶液(0.2 mol/L,pH5.0),1 mL ABTS(1 mM)和适量质量固定化酶。一个酶活单位定义为每分钟内生成1 μmol ABTS游离基所需的酶量。游离酶及固定化酶的计算公式如下式(1)所示。
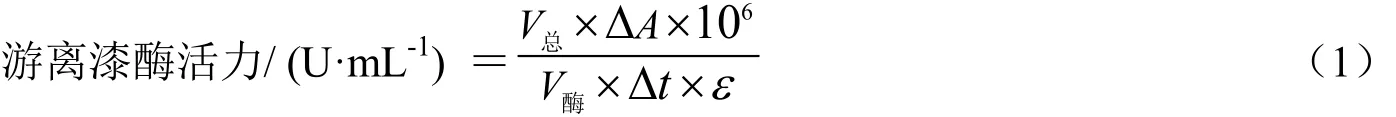
其中:V总为反应体系的总体积,V酶为反应酶液的体积,Δt=3 min,ΔA=3 min内吸光值的变化量,ε=3.6×104M-1cm-1。
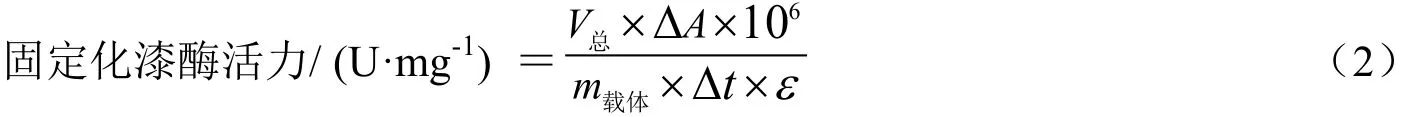
其中:V总为反应体系的总体积,m载体为固定化酶载体的质量,Δt=3 min,ΔA=3 min内吸光值的变化量,ε=3.6×104M-1cm-1。
1.3 固定化漆酶对活性艳蓝KN-R溶液的脱色
将5.0 g固定化酶湿膜块填充到层析柱中(1.6×40 cm),塞紧,每次填充的高度保持一致,在柱中缓慢加入15 mL浓度为50 mg/L的活性艳蓝KN-R染料水溶液,脱色后的溶液将从层析柱底部流出。在597 nm处测得染料溶液脱色之前的吸光度为A0,脱色之后的吸光度为A1,根据公式(3)算出脱色率:

1.4 活性艳蓝KN-R脱色前后的紫外可见吸收光谱
用固定化酶对活性艳蓝KN-R溶液进行脱色,将脱色前后的溶液在紫外-可见分光光度计中进行200~700 nm全波长扫描,观察溶液脱色前后的吸收峰变化。
1.5 固定化漆酶对活性艳蓝KN-R的降解动力学
将湿重为1.5 g的固定化酶加入15 mL浓度为50 mg/L的活性艳蓝KN-R溶液中进行脱色,分别测定10、30、60、120、180、360、720和1440 min时溶液的吸光度,根据活性艳蓝KN-R的标准曲线计算出不同时间段脱色后溶液的浓度,然后分别进行一级和二级动力学方程模拟。
1.6 BC 膜对活性艳蓝KN-R的吸附等温线
配制浓度为10、20、50、100、150和200 mg/L的活性艳蓝KN-R溶液,取湿重为5 g的细菌纤维素膜块分别加入到15 mL各个浓度的活性艳蓝KN-R溶液中,室温下进行脱色,测定活性艳蓝KN-R脱色后的溶液的吸光度,根据活性艳蓝KN-R溶液的标准曲线计算出脱色后的溶液的浓度,然后分别进行Langmuir吸附等温线和Freundlich吸附等温线模拟。
1.7 不同因素对活性艳蓝KN-R脱色率的影响
将湿重为5.0 g的BC膜吸附不同酶活浓度的游离酶,制备固定化酶后,将总酶活为0、14.2、28.3、56.8、84.9、113.2和141.6 U的固定化酶分别放入15 mL活性艳蓝KN-R溶液中,反应总体系均为25 mL,探究不同的固定化酶的活力对脱色率的影响。加入与固定化酶酶活相同的游离酶对活性艳蓝 KN-R脱色,比较固定化酶与游离酶在降解率和反应速率上的差异。
将湿重分别为0.5、1.0、2.5、5.0、7.5和10 g的固定化酶膜块填充到层析柱中,探究不同的层析柱填充量对脱色率的影响。
配制浓度为10、20、50、100、150和200 mg/L的活性艳蓝KN-R染料溶液,探究不同的染料浓度对脱色率的影响。
调节活性艳蓝KN-R溶液的pH分别为3、5、7、9和11,探究不同的pH对脱色率的影响。
将湿重为5.0 g的固定化酶对活性艳蓝KN-R溶液重复脱色5次,探究固定化酶的重复使用性。
2 结果与讨论
2.1 活性艳蓝KN-R脱色前后的紫外可见吸收光谱
图1为活性艳蓝KN-R脱色前后的紫外可见吸收光谱图。
从图 1可以看出,部分脱色的活性艳蓝KN-R溶液在可见和紫外光区的吸收峰都减小,完全脱色的活性艳蓝KN-R溶液的吸收峰则几乎完全消失,说明染料的发色基团被破坏,活性艳蓝KN-R发生了降解而脱色。
2.2 固定化漆酶对活性艳蓝KN-R的降解动力学
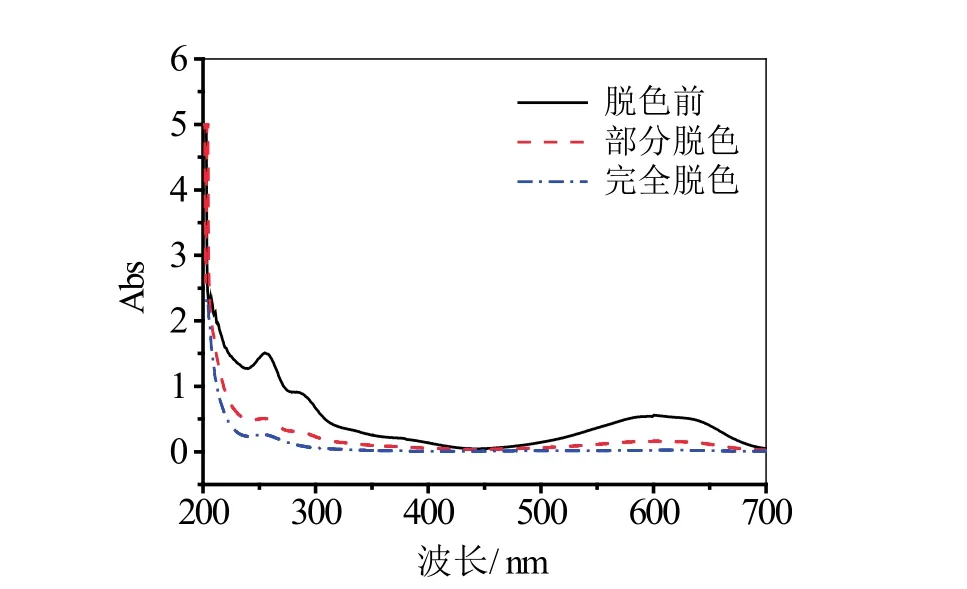
图1 活性艳蓝KN-R脱色前后的紫外可见吸收光谱图
为了更好地了解固定化漆酶对活性艳蓝 KN-R的降解过程,对降解过程分别进行一级和二级动力学表征,两种动力学方程如下式(1)和式(2)[19]:
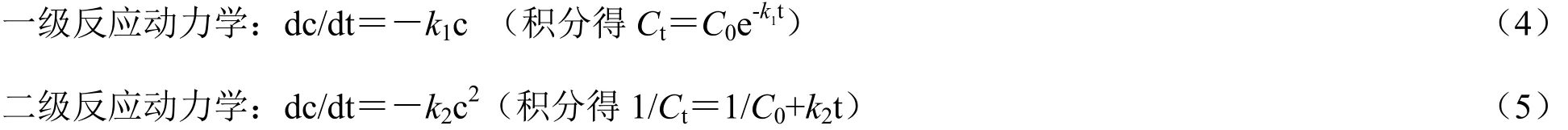
由图2可以看出,二级动力学的线性更好,固定化酶对活性艳蓝KN-R的降解更符合二级动力学模拟。
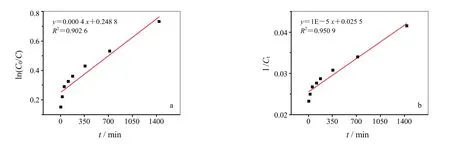
图2 动力学模拟(a)一级动力学模拟、(b)二级动力学模拟
2.3 BC 膜对活性艳蓝KN-R的吸附等温线
细菌纤维素膜载体对染料有一定的吸附,对吸附过程分别进行Langmuir和Freundlich吸附等温线模拟,两种吸附等温线方程如下式(3)和式(4)[20]:

式中:Ce为吸附平衡浓度(mg/L),qe为细菌纤维素膜对活性艳蓝 KN-R的吸附量(mg/g),qm为最大吸附量(mg/g),KL、KF、n为吸附速率常数。从图 3可以看出,载体细菌纤维素膜对活性艳蓝 KN-R的吸附更符合Freundlich吸附等温线,说明细菌纤维素膜对活性艳蓝KN-R的吸附不属于单分子层吸附。
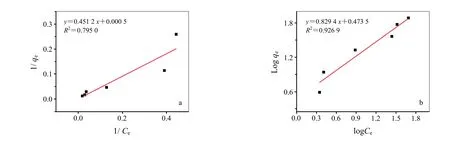
图3 吸附等温线模拟(a)Langmuir 吸附、(b)Freundlich吸附
2.4 不同因素对活性艳蓝KN-R溶液脱色率的影响
2.4.1 酶活对活性艳蓝KN-R染料脱色率的影响
从图 4可以看出,当未加酶时,溶液的脱色率为23.4%,即没有固定化酶时细菌纤维素膜对活性艳蓝KN-R的吸附量,表明细菌纤维素膜本身对活性艳蓝KN-R染料有一定的吸附率。一定范围内随着同样质量BC载体上漆酶量的增加,固定化酶活增大,艳蓝脱色率增加,随着游离酶的酶活增加,艳蓝脱色率同样增加。当加入的同样质量BC固定化酶的活力为84.9 U时,此时反应体系酶活为3.4 U/mL,脱色率最大为73.5%,而同等酶活的游离酶脱色率为20.5%,计算得出,固定化酶比游离酶的降解率提高了2倍,反应速率提高了3倍,染料可能会破坏酶分子,BC膜载体为漆酶提供了相对稳定的环境,因此固定化酶的效率比游离酶高。继续增加固定化酶酶活,脱色率会有所下降,这可能是由于当单位质量的BC膜上增加酶量时,漆酶对活性艳蓝KN-R的降解效率会增加,但是过量的酶占据了BC膜上的吸附位点,减小了BC膜对染料分子的吸附,最终导致脱色率有所下降。
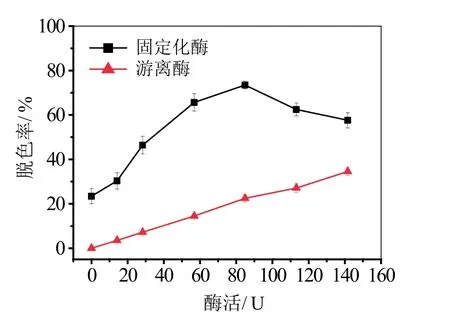
图4 酶活对脱色率的影响
2.4.2 层析柱填充的固定化酶量对脱色率的影响
图5a中是总的脱色率和BC膜对艳蓝的吸附,图5b中脱色率为扣除BC膜吸附后的值。加入的固定化酶填充量在0.5~10 g范围内,随着层析柱中填充的固定化酶增多,脱色率增大。在加入湿重为0.5 g的固定化酶时,活性艳蓝KN-R总的脱色率为39.9%,此时BC膜对染料的吸附量较少为5.5%,增加层析柱中固定化酶的填充量,脱色率迅速增加,当固定化酶的量增加到5.0 g时,BC膜对染料的吸附量为23.9%,总的脱色率可以达到 87.5%。继续增加固定化酶的填充量,BC膜的吸附增加很多,一定时间内酶的降解率增加缓慢,因此扣除BC膜的吸附后,图5b中显示固定化酶的降解率下降,但是被BC膜吸附的染料最终也会被膜上的酶降解。综合考虑BC膜的吸附和酶的降解,比较理想的固定化酶填充量为5.0 g。
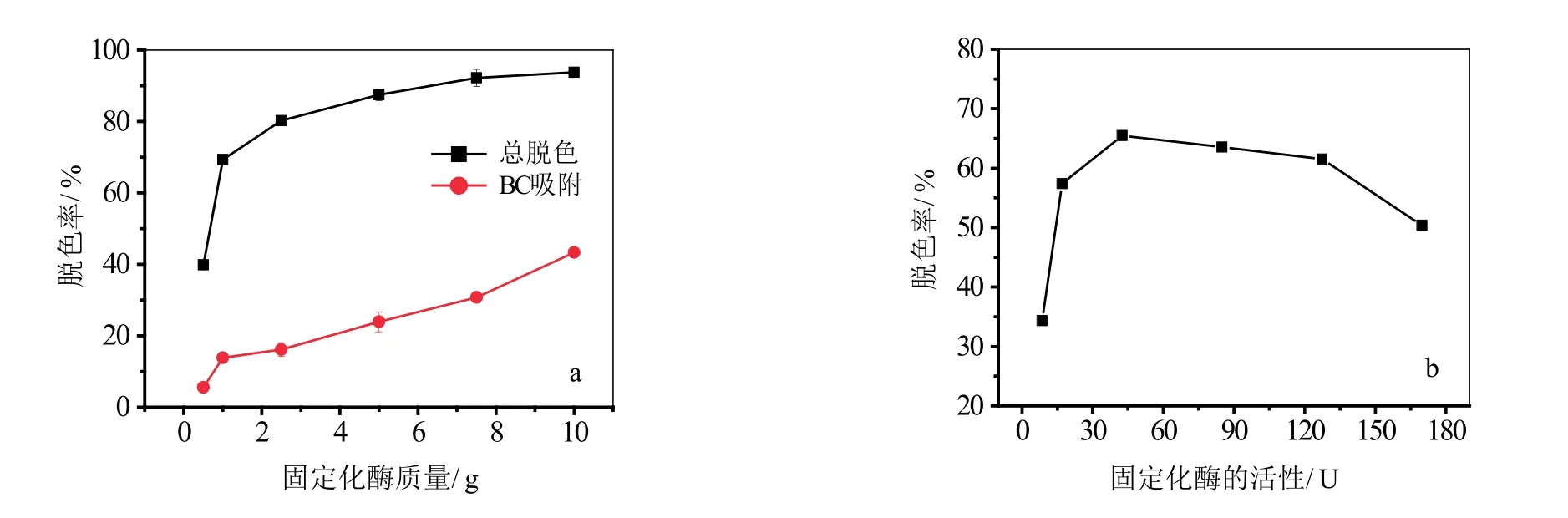
图5 固定化酶量对脱色率的影响(a)固定化酶质量、(b)固定化酶酶活
2.4.3 染料浓度对活性艳蓝KN-R染料脱色的影响
从图6可以看出,当活性艳蓝KN-R染料的浓度小于50 mg/L时,增加染料的浓度,催化反应速度增大,脱色率上升,当染料浓度达到50 mg/L时脱色率最大,为81.1%,当浓度超过50 mg/L时,脱色率有所降低。适当增加染料浓度,脱色率会升高,说明酶未被染料分子所饱和,但染料浓度达到50 mg/L时,一定时间内酶的活性中心完全被底物占据,此时继续增加染料浓度也不会增加酶与染料的中间产物,而BC膜对染料的吸附率也是有限的,所以当底物浓度太大时脱色率会降低。
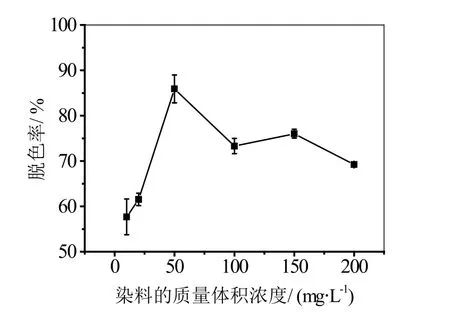
图6 染料浓度对脱色率的影响
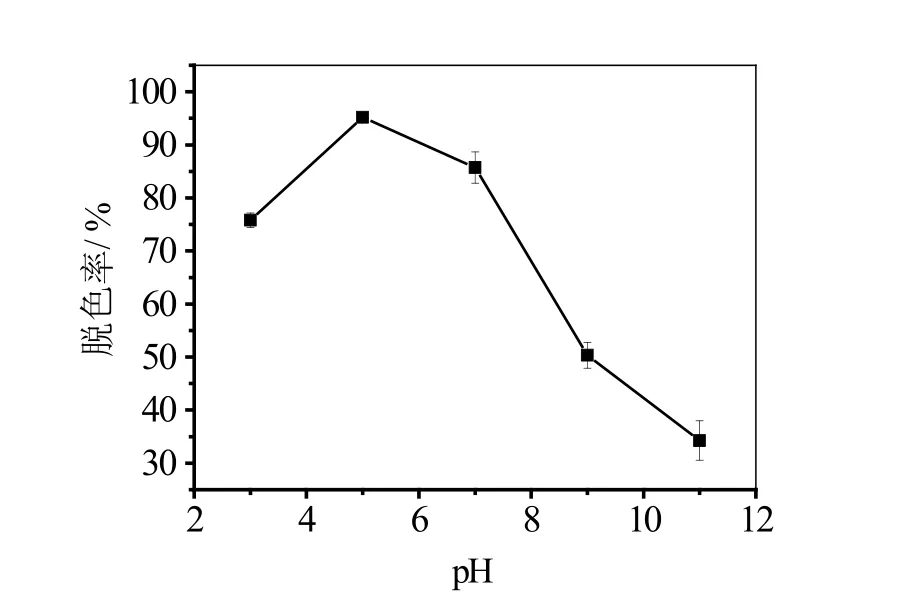
图7 pH对脱色率的影响
2.4.4 pH 对活性艳蓝染料KN-R染料脱色的影响
从图7可以看出,当pH为3~5时,随着pH的增加,脱色率增大,pH为5时活性艳蓝KN-R的脱色率最高为95.2%,pH值大于7后,脱色率快速下降,当pH增大到11时,脱色率仅为34.3%,说明偏酸性条件适合漆酶对活性艳蓝 KN-R染料的脱色,而碱性条件下的脱色效果非常差,这与之前的报道基本一致[21],但是有报道说漆酶对不同的染料脱色的最佳pH是不同的[22]。
2.4.5 固定化酶对活性艳蓝KN-R脱色的重复使用次数
从图8可以看出,随着重复脱色的次数增多,脱色率下降,在重复脱色3次后,脱色率降为原来的一半左右,在重复脱色5次以后,活性艳蓝KN-R的脱色率仅为12.2%。随着重复脱色的次数增加,载体膜上越来越多的染料以及染料分解后的产物,阻碍了固定化膜对活性艳蓝KN-R的吸附,膜上固定化酶的酶活也逐渐失活减小,脱色变得越来越困难,脱色率降低。
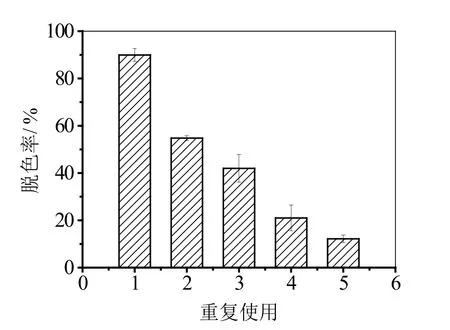
图8 固定化酶的重复使用次数
3 结论
本实验主要研究了细菌纤维素膜固定化漆酶对活性艳蓝KN-R的脱色过程,主要结论如下:
1)BC膜为载体固定化漆酶对活性艳蓝KN-R有良好的脱色效果,与游离酶相比降解率提高了2倍,反应速率提高了3倍;固定化酶对活性艳蓝KN-R的降解符合二级动力学方程;BC膜对活性艳蓝KN-R的吸附符合Freundlich吸附等温线;脱色后的活性艳蓝KN-R溶液的紫外可见吸收光谱的吸收峰几乎完全消失,说明染料发生降解而脱色。
2)固定化酶对活性艳蓝KN-R的脱色在偏酸性条件下较好,pH为5时,脱色率为95.2%;染料浓度为50 mg/L时脱色效果较好;反应体系中加入84.9 U的固定化酶时,此时反应体系酶活为3.4 U/mL,脱色率最高为73.5%;随着固定化酶重复脱色次数的增加,脱色率会逐渐降低。
参考文献:
[1]张斌, 刘金海, 冯晓辉. 印染废水污染现状及其处理技术的发展[J]. 科技信息, 2011, 1(5): 376-377.
[2] Wesenberg D, Kyriakides I, Agathos S N. White-rot fungi and their enzymes for the treatment of industrial dye effluents.[J].Biotechnology Advances, 2003, 22(1): 161-187.
[3]施跃锦, 马楠. 蒽醌类染料废水处理的研究进展[J]. 化工时刊, 2009, 23(6): 49-53.
[4] Georgiou D, Melidis P, Aivasidis A, et al. Degradation of azo-reactive dyes by ultraviolet radiation in the presence of hydrogen peroxide[J]. Dyes & Pigments, 2002, 52(2): 69-78.
[5] Michniewicz A, Ledakowicz S, Ullrich R, et al. Kinetics of the enzymatic decolorization of textile dyes by laccase from Cerrena unicolor[J]. Dyes & Pigments, 2008, 77(2): 295-302.
[6] Riva S. Laccases: Blue enzymes for green chemistry[J]. Trends in Biotechnology, 2006, 24 (5): 219-26.
[7]张玉, 洪枫. 优化彩绒革盖菌产漆酶条件及染料脱色研究[J]. 林产化学与工业, 2006, 26(3): 41-46
[8]邓云霞, 洪枫, 张玉. 染料的香菇漆酶脱色研究[J]. 印染, 2006, 32(12): 8-11
[9]胡平平, 付时雨. 漆酶催化活性中心结构及其特性研究进展[J]. 林产化学与工业, 2001, 21(3): 69-75.
[10] Wang P, Fan X, Cui L, et al. Decolorization of reactive dyes by laccase immobilized in alginate/gelatin blent with PEG[J].环境科学学报(英文版), 2008, 20(12): 1519-1522.
[11]刘友勋, 颜克亮, 熊征, 等. 漆酶介体系统对孔雀绿的脱色研究[J]. 环境科学与技术, 2008, 31(7): 37-39.
[12]袁海彬, 洪枫. 不同菌株来源细菌纳米纤维素膜固定化漆酶的研究[C]. 第六届全国生物复合材料学术研讨会, 江西省九江市, 2016 年10 月20 -22日.
[13] Zou, M Hong F. Preparation of bacterial cellulose pellets as carriers for laccase immobilization[C]. Proceedings of 2009 International Conference on Advanced Fibers and Polymer Materials (ICAFPM 2009), pp1162-1164, Shanghai, China, Oct.21-24.
[14]Chen L, Zou M, Hong F. Evaluation of fungal laccase immobilized on natural nanostructured bacterial cellulose[J]. Frontiers in Microbiology, 2015, 6 (25): 1245.
[15]赵林果, 季永新, 李强, 等. 固定化漆酶对染料酸性紫43的脱色和降解[J]. 工业微生物, 2007, 37(6): 35-40.
[16]历娜, 栗君, 卢磊, 等. 固定化漆酶在染料脱色中的应用[J]. 南京林业大学学报(自然科学版), 2014 38(5):129-133.
[17]孙东平. 细菌纤维素功能材料及其工业应用[M]. 科学出版社, 2010.
[18]林俊芳, 刘志明, 陈晓阳, 等. 真菌漆酶的酶活测定方法评价[J]. 生物加工过程, 2009, 7(4): 1-8.
[19]张德敏, 高洁, 孙进, 等. 铜离子和孔雀绿在磷酸酯化改性豆壳上的吸附行为[J]. 环境科学学报, 2008, 28(4):720-725.
[20]刘澜. 改性稻秆吸附剂表征及处理亚甲基蓝溶液的吸附性能研究[D]. 重庆大学, 2011.
[21]杨波, 冯利东, 张丽媛. 漆酶对活性艳蓝染料废水脱色[J]. 环境工程学报, 2012, 6(10): 3514-3518.
[22]司静, 李伟, 崔宝凯, 等. 真菌漆酶性质、分子生物学及其应用研究进展[J]. 生物技术通报, 2011 18(2): 48-55.
