伴生介质漆酶的生产优化及其酶学特性研究
2018-05-03冯年捷王传槐
冯年捷*, 傅 瑜, 王传槐
(1. 湖北工业大学 绿色轻工材料湖北省重点实验室,湖北 武汉 430068;2. 南京林业大学 江苏省制浆造纸科学与技术重点实验室,江苏 南京 210037;3. 江苏理工学院 化学与环境工程学院,江苏 常州 213001)
漆酶是一种含铜的多酚氧化酶,以氧分子作为电子受体,通过电子传递,参与底物的降解和聚合。漆酶催化底物广泛且绿色清洁,在制浆造纸、有机合成、食品医药和环境修复等领域均起着重要作用[1-3]。由于漆酶氧化还原电势较低,只能氧化酚型木质素结构单元,而无法直接氧化木质素结构中占主要的非酚型单元[4]。Bourbonnais等发现一种染料化合物2,2ʼ-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)(ABTS)可作为漆酶的介质,在氧化还原过程中起到电子传递的作用,参与非酚型木质素单元的氧化[5],使利用漆酶实现木质纤维生物质的高效转化成为了可能。然而,人工合成介质存在着价格昂贵和环境污染等问题,使得漆酶介质体系的产业化应用受到了限制[6]。Li发现血红密孔菌在分泌漆酶的同时伴生 3-羟基邻氨苯甲酸(3-HAA)[7]。Eggert研究表明,在无外加介质的情况下3-HAA可参与漆酶氧化木质素β-O-4结构[8-9],从而有望解决漆酶氧化木质素中介质的问题。非伴生介质漆酶活力可达136 U/g[10]或80 U/mL[11],而伴生介质漆酶的生产鲜有人研究,漆酶活力较低(<10 U/mL)[7]。
笔者已筛选出了血红密孔菌NFZH-1,漆酶活力为13.7 U/mL,并鉴定了其伴生介质3-HAA的存在[12]。因此,迫切需要利用血红密孔菌NFZH-1来提高伴生介质漆酶产量。本研究通过优化血红密孔菌NFZH-1液态培养基和发酵条件,提高了伴生介质漆酶的产量;并通过测定酶学特性,确定了该漆酶的最适反应条件和稳定性,以期为伴生介质漆酶的工业化生产和应用提供理论基础和技术支持。
1 实验
1.1 主要试剂
ABTS、愈创木酚、阿魏酸和 2,5-二甲基苯胺均为优级纯,购于美国Sigma公司。葡萄糖、麦芽糖、蔗糖、淀粉、酒石酸铵、尿素、琼脂、酵母浸膏、维生素B1、Tween-80和无机盐((NH4)2SO4、NH4NO3、MgSO4·7H2O、KH2PO4、CuSO4·5H2O、CaCl2、FeSO4·7H2O、ZnSO4·7H2O、MnSO4·H2O 和 CoCl2·6H2O)均为分析纯,从国药集团化学试剂有限公司购得。土豆从农贸市场购买。
1.2 菌种及漆酶生产
血红密孔菌NFZH-1(Pycnoporus sanguineus),于4℃保存在土豆-葡萄糖-琼脂(PDA)斜面培养基上,储藏于南京林业大学木材腐朽菌菌种库。
PDA培养基含20%土豆浸出液,2.0%葡萄糖和2.0%琼脂,pH自然。
种子培养液由200 g/L土豆浸出液,20 g/L葡萄糖,2 g/L MgSO4·7H2O,5 g/L (NH4)2SO4和5 g/L KH2PO4组成,pH自然。
液态发酵培养基由200 g/L土豆浸出液,10.8 g/L葡萄糖,0.1 g/L (NH4)2SO4,0.125 g /L酒石酸铵,0.1 g/L 酵母浸膏,2.0 g/L KH2PO4,0.5 g/L MgSO4·7H2O,0.1 g/L CuSO4·5H2O,75 mg/L CaCl2,5.0 mg/L FeSO4·7H2O,6.0 mg/L ZnSO4·7H2O,5.0 mg/L MnSO4·H2O,1.0 mg/L CoCl2·6H2O,1 mg/L 维生素 B1和 1 g/L Tween-80组成,pH5.5。
将50 mL种子培养液置于250 mL三角瓶中,121℃灭菌30 min,灭菌的三角瓶接入平板菌落,置于28℃、170 r/min(Φ 18 mm)摇床上培养3天,获得均一孢子悬浮液,无菌过滤悬浮液,调节孢子浓度为1.0×107个/mL,4℃暗处保存。
将50 mL液态发酵培养基置于250 mL三角瓶中,121℃灭菌30 min,灭菌的三角瓶接入5.0 mL上述孢子悬浮液,置于28℃、170 r/min(Φ 18 mm)摇床上培养7天,获得发酵液。7 000 r/min离心发酵液,取上层清液,4℃密封保藏,待漆酶活力分析。
1.3 漆酶生产条件优化
1.3.1 培养基
对培养基的组成进行逐一替换或添加,单因素优化产漆酶培养基。
碳源:分别以相同浓度的不同碳源(麦芽糖、蔗糖、淀粉)替代原培养基中的葡萄糖。
碳源浓度:选取优化的碳源,使其浓度分别为4.5、9.0、13.5、18.0 g/L。
氮源:分别以相同浓度的尿素替代原培养基中的酒石酸铵和相同浓度的硝酸铵替代原培养基中的硫酸铵,即组成氮源组合为酒石酸铵+硝酸铵、尿素+硫酸铵和尿素+硝酸铵。
诱导剂:分别以愈创木酚、阿魏酸和2,5-二甲基苯胺为诱导剂,于发酵第3天添加,并使培养基中诱导剂浓度为0.5 mmol/L,与未添加诱导剂试样进行对照。
诱导剂浓度:选取较优的诱导剂,使其浓度分别为0.2、0.4、0.6、0.8 mmol/L。
1.3.2 发酵条件
对发酵条件进行逐一改变,单因素优化产漆酶发酵条件。
温度:控制发酵温度分别为20、24、28、32和36℃。
pH:调节培养基pH分别为4.5、5.5、6.5、7.5和8.5。
装液量:采用250 mL三角瓶,分别装入40、60、80和100 mL培养基。
接种量:分别接入0.5、1.5、2.5、3.5和5.0 mL孢子悬浮液。
培养时间:分别培养6、7、8和9天,定时取样,测定漆酶活力。
1.4 漆酶活力测定
漆酶活力测定及相对活力计算参照文献[13]。采用紫外-可见分光光度计(UV757CRT/PC,上海),在35℃、pH4.8条件下,以每分钟使1 mmol的ABTS氧化所需的酶量为一个活力单位,已知420 nm处ABTS摩尔消光系数ε=3.6×10-4[(mol/L)-1cm-1]。
1.5 漆酶酶学特性分析
1.5.1 最适反应条件
最适温度:测定在30~90℃范围内,pH4.8条件下的漆酶活力。以最高漆酶活力为对照(100%),以相对酶活力对温度作图,得漆酶氧化ABTS的最适温度。
最适pH:测定在 pH1.0~5.5范围内,35℃条件下的漆酶活力。以最高漆酶活力为对照(100%),以相对酶活力对pH作图,得漆酶氧化ABTS的最适pH。
1.5.2 稳定性
热稳定性:将等浓度的漆酶,在pH4.8条件下,30~70℃范围内不同温度下保温3 h。定时取样,测定35℃、pH4.8条件下的残余漆酶活力,以原酶液的漆酶活力为对照(100%),以相对酶活力对温度作图,得漆酶氧化ABTS的热稳定性。
酸稳定性:将等浓度的漆酶,在30℃条件下,pH3.0~7.0范围内不同pH下保温24 h。测定35℃、pH4.8条件下的残余漆酶活力,以原酶液的漆酶活力为对照(100%),以相对酶活力对pH作图,得漆酶氧化ABTS的酸稳定性。
1.6 统计分析
2 结果与讨论
2.1 伴生介质漆酶生产优化
取两组平行实验均值,利用软件Origin 8.0拟合曲线,误差棒表示。
2.1.1 培养基对发酵漆酶产量的影响
图1a是不同碳源对血红密孔菌NFZH-1发酵漆酶产量的影响。以麦芽糖作碳源时,菌株NFZH-1漆酶产量最高,达18.9 U/mL。这与麦芽糖酶分泌过程中诱导了漆酶的产生有关。以淀粉作碳源时,菌株NFZH-1漆酶产量次之。较麦芽糖代谢,血红密孔菌NFZH-1缺少了淀粉酶,使淀粉无法高效地转化为葡萄糖,导致漆酶产量相对较低。以蔗糖作碳源时,漆酶产量最低。蔗糖由α-葡萄糖和果糖脱水缩合而成,相对于葡萄糖而言,果糖不易被菌株NFZH-1吸收利用,因而漆酶产量较低。总之,以两分子葡萄糖通过α-1,4-糖苷键连接构成的麦芽糖最适合菌株NFZH-1的漆酶生产。
图1b是麦芽糖浓度对血红密孔菌NFZH-1发酵漆酶产量的影响。麦芽糖浓度低时,菌株生长受到抑制,漆酶活力较低。但随着麦芽糖浓度增加,菌株生长得到了促进,漆酶产量逐渐增高。当麦芽糖浓度为13.5 g/L时,菌株NFZH-1发酵漆酶活力最高,达21.2 U/mL。继续增加麦芽糖浓度,菌株生长过于茂盛,摇瓶中营养物质过多用于自身繁殖,而忽略了菌株次级代谢。同时生长繁茂的菌株使摇瓶中液体粘度增大,降低了其传质效率[14],使漆酶活力降低。
图1c是不同氮源对血红密孔菌NFZH-1发酵漆酶产量的影响。有机氮源和无机氮源孰优孰劣一直存在着争议[15]。将有机氮源和无机氮源组合施用效果较佳,近年来已被业内逐渐认可[16]。在有机氮源比较中,酒石酸铵较尿素促进了菌株NFZH-1漆酶的生产;在无机氮源比较中,硫酸铵较硝酸铵有利于菌株NFZH-1漆酶的分泌。因此,选择酒石酸铵与硫酸铵的组合作为血红密孔菌NFZH-1液态发酵的氮源。
图1d是三种诱导剂对血红密孔菌NFZH-1发酵漆酶产量的影响。愈创木酚和2,5-二甲基苯胺作诱导剂时,菌株NFZH-1发酵漆酶产量均有所提高。与刘志钰研究一致,愈创木酚是较优的诱导剂[17],较无诱导剂,漆酶活力提高了12.3%,达23.7 U/mL。小分子芳香族诱导剂通常在苯环上存在羟基、氨基或羧基等,在发酵过程中易与漆酶酶蛋白结合,刺激微生物RNA转录,促进酶蛋白的合成和分泌,提高漆酶产量[18]。然而,小分子芳香族化合物同时作为底物参与漆酶的催化氧化,生成的副产物抑制了微生物的生长[19],如血红密孔菌利用阿魏酸代谢产香草醛,而产生的香草醛抑制了漆酶的生产[20]。
图1e是愈创木酚浓度对血红密孔菌NFZH-1发酵漆酶产量的影响。随着愈创木酚浓度增加,漆酶产量逐渐提高。当愈创木酚浓度为0.4 mmol/L时,漆酶活力达到最大值,为23.9 U/mL。随着诱导剂浓度继续升高,漆酶活力逐渐下降。过高的诱导剂浓度影响了微生物细胞膜结构,改变了细胞膜通透性,抑制了微生物生长[21]。

图1 液态培养基对伴生介质漆酶生产的影响a. 碳源;b. 麦芽糖浓度;c. 氮源;d. 诱导剂;e. 愈创木酚浓度对照培养基:200 g/L土豆浸出液,10.8 g/L葡萄糖,0.1 g/L (NH4)2SO4,0.125 g /L酒石酸铵,0.1 g/L酵母浸膏,2.7 g/L无机盐,1 m g/L维生素B1和1 g/L Tween-80,无诱导剂
2.1.2 发酵条件对发酵漆酶产量的影响
图2a是温度对血红密孔菌NFZH-1发酵漆酶产量的影响。20℃时,发酵液中未发现漆酶,低温抑制了菌株生长。随着温度的上升,微生物细胞内化学和酶促反应都以较快的速度进行,菌株生长加快,酶蛋白分泌增多,28℃时漆酶产量达到了最高值。菌株个体存在其自身的耐受温度,当超过这一温度,蛋白质、核酸和细胞等会受到不可逆的损害,细胞机能急剧下降[22]。继续升高温度,漆酶产量逐渐降低。由此可知,菌株NFZH-1的最适产漆酶温度为28℃。
图2b是pH对血红密孔菌NFZH-1发酵漆酶产量的影响。血红密孔菌NFZH-1产漆酶最适初始pH为6.5,此时漆酶活力可达24.7 U/mL。当培养基初始pH在5.5~7.5时,菌株NFZH-1漆酶产量均较为理想,可保持在22.2 U/mL以上。漆酶是一种糖蛋白,pH会影响酶构象的稳定性;也会影响菌株的生长,从而影响漆酶的合成[23]。当pH<5.5或>7.5时,菌株生长受到抑制,漆酶活力明显降低。菌株NFZH-1在中性和弱酸性条件下生长较好,具有较高的漆酶生产能力。反之,若pH过低,酸性环境会抑制菌株的生长;若pH过高,由于漆酶的合成需要H+的参与,碱性环境会抑制漆酶的代谢。
图 2c是装液量对血红密孔菌 NFZH-1发酵漆酶产量的影响。菌株 NFZH-1产漆酶最适装液量为60 mL/250 mL,此时漆酶活力最高。增加装液量,菌株NFZH-1分泌漆酶能力逐渐下降,这与摇瓶中溶解氧减少有关。菌株NFZH-1为好氧菌,菌株的生长及相关酶的分泌都需要氧的参与。40 mL/250 mL装液量时,漆酶活力反而下降。装液量较少,次级代谢产物不断积累,使发酵后期培养液中毒性物质浓度过高,抑制了菌株生长和漆酶分泌[24]。
图2d是接种量对血红密孔菌NFZH-1发酵漆酶产量的影响。接种量0.5 mL时,漆酶产量较低,随着接种量增加,漆酶产量快速增加。接种量的增加,促进了菌株的生长繁殖,提高了漆酶产量。接种量2.5 mL时,漆酶产量达最高,为26.7 U/mL。继续增加接种量,漆酶产量呈缓慢下降趋势。接种量过大,菌株生长过快,摇瓶中溶解氧不断减少。同时,对于一定的培养基组成和含量,随着接种量的不断增大,营养成分已不能满足菌株的生长需求,从而抑制了微生物的代谢,减少了漆酶的产量。
图2e是培养时间对血红密孔菌NFZH-1发酵漆酶产量的影响。漆酶生产优化前,漆酶活力随培养时间延长逐渐增大,最高漆酶活力出现在发酵第八天,为13.7 U/mL,继续延长发酵时间,漆酶活力略有降低。漆酶的产生与菌体的生长相关联。菌体进入对数期,漆酶开始大量分泌;菌体进入稳定期,漆酶活力达到最高;菌体进入衰亡期,漆酶产量逐渐降低。漆酶生产优化后,漆酶活力随发酵时间延长逐渐增大,最高漆酶活力出现在发酵第七天,为26.1 U/mL,继续延长发酵时间,漆酶活力略有降低。经培养基和发酵条件优化,血红密孔菌NFZH-1发酵周期缩短一天,最高漆酶活力提高91%。血红密孔菌NFZH-1经发酵优化,漆酶活力为26.1 U/mL,较非伴生介质漆酶活力仍有较大差距[25]。这可能是由于伴生介质3-HAA作为底物参与漆酶催化氧化,抑制了菌株NFZH-1的漆酶生产。为研究伴生介质3-HAA对漆酶生产的抑制作用,将结合伴生介质 3-HAA的代谢,进一步综合系统地完善伴生介质漆酶的生产,以实现伴生介质漆酶体系在木质纤维生物转化上的经济可行性。
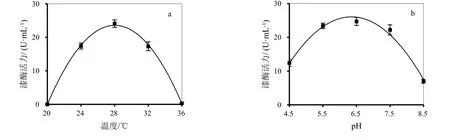

图2 发酵条件对伴生介质漆酶生产的影响a, 温度;b,pH;c,装液量;d,接种量;e,培养时间对照发酵条件:28 ℃,170 r/min (Φ 18 mm),pH5.5,装液量50 mL,接种量5.0 mL,培养时间7天
2.2 伴生介质漆酶酶学特性
2.2.1 最适反应条件
图3a是反应温度对漆酶活力的影响。伴生介质漆酶最适反应温度为70℃,并在50~85℃范围内均具有较高的漆酶活力(相对酶活力80%以上)。真菌漆酶最适反应温度一般在40~70℃范围内[26-28],血红密孔菌NFZH-1所产漆酶最适反应温度为70℃。该漆酶在较高温度仍具有较高的漆酶活力,与灰树花漆酶相似,属耐热漆酶,可满足工业高温环境的需求[29]。
图3b是反应pH对漆酶活力的影响。pH2.5~4.5时,伴生介质漆酶相对活力保持在80%以上,并在pH3.5时呈现最大值,与漆酶等电点一般出现在3.5是一致的[3,30]。当pH小于1.5和大于4.5时,漆酶活力快速下降,真菌漆酶在强酸和碱等极端环境中易失活[31]。

图3 伴生介质漆酶最适反应条件(a. 反应温度;b. 反应pH)
2.2.2 稳定性
图 4a是温度对漆酶稳定性的影响。随时间延长,漆酶活力均逐渐降低,但不同温度,漆酶活力下降速率不同。温度不高于50℃时,保温3 h,残余漆酶相对活力保持在70 %以上。温度升高,酶蛋白变性失活,漆酶热稳定性逐渐降低。在60℃和70℃条件下保温1 h,残余漆酶相对活力分别仅为54%和27%,继续延长保温时间,漆酶活力趋于稳定,并保持在较低水平。伴生介质漆酶在60℃以下具有较好的热稳定性。
图4b是pH对漆酶稳定性的影响。pH5.0~7.0时,残余漆酶相对活力仍保持在70 %以上,其中pH6.0时,残余漆酶相对活力最大。pH小于5.0时,随着pH降低,残余漆酶活力迅速下降,pH4.0时残余漆酶相对活力仅为22 %,继续降低pH,漆酶活力趋于稳定,并保持在较低水平。真菌漆酶一般在酸性环境中具有良好的稳定性[32-33],而伴生介质漆酶仅在pH5.0~7.0条件下具有较好的稳定性,这与低pH条件下,漆酶与伴生介质的相互作用有关。

图4 伴生介质漆酶稳定性(a. 温度;b. pH)
3 结论
1)血红密孔菌NFZH-1为伴生介质漆酶高产菌株,经培养基和发酵条件优化,漆酶活力提高91%,达26.1 U/mL。
2)伴生介质漆酶具有耐热性,在50~85℃范围内具有较高的漆酶活力,且在60℃以下具有较好的热稳定性。
3)伴生介质漆酶缺乏耐酸性,虽然在pH2.5~4.5范围内具有较高的漆酶活力,但在pH<5.0时缺乏较好的酸稳定性。
参考文献:
[1] Rodriguez C S, Toca Herrera J L. Industrial and biotechnological applications of laccases: A review[J]. Biotechnology Advances, 2006, 24(5): 500-513.
[2]慎镛健, 张蓓蓓, 徐昌, 等. 漆酶的研究及进展[J]. 黑龙江环境通报, 2015, 39(2): 59-62.
[3]刘晓庆. 重组布氏乳杆菌漆酶表达的研究[D]. 呼和浩特: 内蒙古大学, 2016.
[4]Munk L, Sitarz A K, Kalyani D C, et al. Can laccases catalyze bond cleavage in lignin? [J]. Biotechnology Advances, 2015,33(1): 13-24.
[5] Bourbonnais R, Paice M G. Demethylation and delignification of kraft pulp by Trametes versicolor, laccase in the presence of 2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate)[J]. Applied Microbiology and Biotechnology, 1992, 36(6): 823-827.
[6] Canas A I, Camarero S. Laccases and their natural mediators: Biotechnological tools for sustainable eco-friendly processes[J].Biotechnology Advances, 2010, 28(6): 694-705.
[7] LI Kai-chang, Horanyi P S, Collins R, et al. Investigation of the role of 3-hydroxyanthranilic acid in the degradation of lignin by white-rot fungus Pycnoporus cinnabarinus[J]. Enzyme and Microbial Technology, 2001, 28(4-5): 301-307.
[8] Eggert C, Temp U, Dean J F D, et al. Laccase-mediated formation of the phenoxazinone derivative, cinnabarinic acid[J]. FEBS Letters, 1995, 376(3): 202-206.
[9] Eggert C, Temp U, Dean J F D, et al. A fungal metabolite mediates degradation of non-phenolic lignin structures and synthetic lignin by laccase[J]. FEBS Letters, 1996, 391(1-2): 144-148.
[10] LIU Jia-yang, YU Zhong-hua, LIAO Xiang-ru, et al. Scalable production, fast purification, and spray drying of native Pycnoporus laccase and circular dichroism characterization[J]. Journal of Cleaner Production, 2016, 127: 600-609.
[11] Zimbardi A L R L, Camargo P F, Carli S, et al. A high redox potential laccase from Pycnoporus sanguineus RP15: Potential application for dye decolorization[J]. International Journal of Molecular Sciences, 2016, 17(5): 672-695.
[12]冯年捷, 翟华敏, 王传槐. 自带介质血红密孔菌 NFZH-1的鉴定及其木质素降解特性[J]. 林产化学与工业, 2014, 34(5):1-7.
[13] FENG Nian-jie, MA Qin-zhi, YUAN Mei-ting, et al. Improving degradation ability toward wheat straw chemical composition by Co-cultivation of Pycnoporus sanguineus with Candida tropicalis[J]. Journal of Biobased Materials and Bioenergy, 2015,9(6): 568-571.
[14]Chavarria-Hernandez N, Oryega-Morales E, Vargas-Torres A, et al. Submerged monoxenic culture of the entomopathogenic nematode, Steinernema carpocapsae, CABA01, in a mechanically agitated bioreactor: Evolution of the hydrodynamic and mass transfer conditions[J]. Biotechnology and Bioprocess Engineering, 2010, 15(4): 580-589.
[15] Rodriguez-Gomez D, Hobley T J. Is an organic nitrogen source needed for cellulase production by Trichoderma reesei,Rut-C30? [J]. World Journal of Microbiology and Biotechnology, 2013, 29(11): 2157-2165.
[16] Ghosh S, Leff L G. Impacts of labile organic carbon concentration on organic and inorganic nitrogen utilization by a stream biofilm bacterial community[J]. Applied and Environmental Microbiology, 2013, 79(23): 7130-41.
[17]刘志钰. 拟青霉漆酶发酵调控、分离纯化及性质的研究[D]. 无锡: 江南大学, 2010.
[18]Quaratino D, Ciaffi M, Federici E, et al. Response surface methodology study of laccase production in Panus tigrinus, liquid cultures[J]. Biochemical Engineering Journal, 2008, 39(2): 236-245.
[19] Revankar M S, Lele S S. Enhanced production of laccase using a new isolate of white rot fungus WR-1[J]. Process Biochemistry, 2006, 41(3): 581-588.
[20]Oddou J, Stentelaire C, Lesage-Meessen L, et al. Improvement of ferulic acid bioconversion into vanillin by use of high-density cultures of Pycnoporus cinnabarinus[J]. Applied Microbiology and Biotechnology, 1999, 53(1): 1-6.
[21]Tavares A, Coelho M, Coutinho J, et al. Laccase improvement in submerged cultivation: induced production and kinetic modeling [J]. Journal of Chemical Technology and Biotechnology, 2005, 80(6): 669-676.
[22] Mansour A A, Arnaud T, LU-Chau T A, et al. Review of solid state fermentation for lignocellulolytic enzyme production: Challenges for environmental applications[J]. Reviews in Environmental Science and Bio/Technology, 2016, 15(1):31-46.
[23] Kamath P, Subrahmanyam V M, Rao J V, et al. Optimization of cultural conditions for protease production by a fungal species[J]. Indian Journal of Pharmaceutical Sciences, 2010, 72(2): 161-166.
[24] Zhang Lei, Wu Ming-de, Li Guo-qing, et al. Effect of Mitovirus infection on formation of infection cushions and virulence of Botrytis cinerea[J]. Physiological and Molecular Plant Pathology, 2010, 75(1): 71-80.
[25]吴坤. 杂色云芝(Coriolus Versicolor)和杂色云芝漆酶及其对环境污染物降解的研究[D]. 杭州: 浙江大学, 2002.
[26] Aslam M S, Aishy A, Samra Z Q, et al. Identification, purification and characterization of a novel extracellular laccase from Cladosporium cladosporioides[J]. Biotechnology and Biotechnological Equipment, 2014, 26(6): 3345-3350.
[27]孙静. 毕赤酵母异源表达灵芝漆酶及酶学特性与功能的研究[D]. 扬州: 扬州大学, 2011.
[28]包文华. 毕赤酵母异源表达仁果褐腐病菌漆酶及酶学特性与功能的研究[D]. 南京: 南京农业大学, 2012.
[29]赵晓燕, 邢增涛, 邵毅, 等. 灰树花漆酶酶学性质的初步研究[J]. 天然产物研究与开发, 2012, 24(6): 824-827.
[30] Chakroun H. Purification and characterization of a novel laccase from the ascomycete Trcihoderma atrovinde: Application on bioremediation of phenolic compounds[J]. Process Biochemistry, 2010, 45(4): 507-513.
[31]欧阳凤菊. 芽孢杆菌漆酶基因的克隆表达与分子定向进化[D]. 哈尔滨: 东北林业大学, 2014.
[32]方金涛. 灵芝漆酶的功能表达及其在工业废水脱色处理中的应用[D]. 南阳: 南阳师范学院, 2015.
[33]胡莹玥. 球形芽孢杆菌C3-41菌株芽孢漆酶的提取、纯化及性质研究[D]. 武汉: 武汉纺织大学, 2017.
