超声血流向量成像技术评价维持性血液透析患者左心室舒张期血流能量损耗*
2018-05-03周婕尹立雪蔡璐徐芸谢苓
周婕 尹立雪 蔡璐 徐芸 谢苓
(1.遵义医学院,贵州 遵义 563000;2.四川省医学科学院·四川省人民医院超声医学研究所·超声心脏电生理学与生物力学四川省重点实验室,四川 成都 610072)
心肌损害是终末期肾脏病患者常见的并发症,而血液透析是慢性肾功能不全(chronic renal failure,CRF)患者主要肾脏替代治疗方式[1]。有研究表明,心血管疾病是维持性血液透析(maintenance hemodialysis,MHD)患者死亡的主要原因,且发生严重影响预后[2]。MHD患者在疾病早期即可有LV舒张功能改变。常规超声心动图可评价其舒张功能,但不能可视化评价心腔内血流动力学改变。速度向量成像(vector flow mapping,VFM)技术是可用于可视化观察与量化分析心室腔内流体运动的超声新技术[3]。本研究拟采用VFM评价MHD患者舒张期LV血流动力学状态,并分析能量损耗与E/e的相关性,以期为临床提供一种能精确量化评价MHD患者左心室舒张功能受损的新方法。
1 资料与方法
1.1 研究对象 选择在四川省人民医院血液透析中心进行维持性血液透析的终末期肾脏病患者32例为血透组,其中男性17例,女性15例,年龄25~60岁,平均(45.7±9.5)岁。纳入标准:依据2009年《改善全球肾脏病预后组织(KDIGO)临床实践指南》达到慢性肾功能不全标准,且已行维持性血液透析时间超过1年,每周规律透析三次,每次透析3~4小时,并坚持药物治疗,无心功能不全的临床表现。排除标准:先心病、冠心病、心脏瓣膜疾病、甲亢、心律失常及超声提示左心室射血分数<50%、心包积液者。选取经心电图、超声心动图及生化指标检查均正常的健康志愿者31例为对照组,其中男性16例,女性15例,年龄25~55岁,平均(44.3±8.7)岁。
1.2 仪器与方法 应用阿洛卡公司新标Prosound F70超声诊断仪,相控阵探头,频率1.5~5MHz。图像采集:在静息状态下,受检者左侧卧位,同步记录心电图。①行常规超声心动图检查;②在心尖四腔心切面启动PW/TDI模式,取样容积分别置于二尖瓣口与左心室瓣环侧壁处,同步获取运动速度曲线;③启动VFM模式,取心尖四腔心、三腔心、二腔心观,调节彩色取样框的大小及彩色增益,要求帧频在17Hz以上,且血流取样框必须包绕整个左心室,记录并储存连续3个心动周期的动态图像。在机测量LAD、LVPWd、LVDd、IVSd、E、e,并计算E/e比值,以二维Simpson法测量计算左心室射血分数LVEF。
1.3 图像分析 将AP4C、AP3C、AP2C动态血流图导入DAS-RS1图像后处理工作站,选定一个完整的心动周期,逐帧勾画心内膜边界,系统将自动对左心室内膜进行追踪,根据时间流量曲线(time-flow curve,T-F curve)以及瓣膜开闭情况将一个完整的舒张期分为4个时相:等容舒张期(P1)、快速充盈期(P2)、减慢充盈期(P3)、心房收缩期(P4)。手动确定好时相后勾画、获取并记录各时相LV平均整体能量损耗(aEL-T)及基底段能量损耗(aEL-B)、中间段能量损耗(aEL-M)、心尖段能量损耗(aEL-A)及LV涡旋面积、循环强度,见图1~3。

图1能量损耗图
Figure1Theimageoftheaverageenergyloss
注:A-D分别是对照组的能量损耗图;E-H分别是血透组P1、P2、P3、P4的能量损耗图;颜色越亮代表能量损耗值越大;图示两组平均能量损耗均从基底段到心尖段依次减小;血透组平均能量损耗较对照组更大,以P4明显

图2 涡旋图Figure 2 The image of vortex
注:A-D分别是对照组P1、P2、P3、P4的涡旋图,E-H分别是血透组P1、P2、P3、P4的涡旋图;它可显示涡旋的位置、面积与循环强度。图示血透组P2、P4的涡旋circulation较对照组增加

图3 血流向量图Figure 3 The image of blood flow vector
注:A-D分别是对照组P1、P2、P3、P4的血流向量图;E-H分别是血透组P1、P2、P3、P4血流向量图,它以黄色线条显示左心室腔流场的运动,箭头指示方向,线条长短表示向量的大小;图示血透组的血流向量较对照组相对不规则,以P2、P4明显

2 结果
2.1 两组受检者一般资料比较 血透组患者年龄、收缩压及舒张压、心率较对照组增高,其中两组年龄、心率比较差异无统计学意义(P>0.05),收缩压、舒张压比较差异有统计学意义(P<0.01),见表1。
2.2 两组常规超声测值比较 血透组左心房内径(LAD)、左心室舒张末期内径(LVDd)、室间隔厚度(IVSd)、左心室后壁厚度(LVPWd)、E/e均较对照组增高,左心室射血分数(LVEF)较对照组降低,两组LVPWd、LVEF比较差异无统计学意义(P>0.05),LAD、LVDd、IVSd、E/e差异有统计学意义(P<0.01),见表2。

表1 两照组一般临床资料比较Table 1 The basic clinical data
注:与对照组比较,①P<0.01

表2 两组常规超声测值比较Table 2 Conventional ultrasonic measurement
注: 与对照组比较,①P<0.01
2.3 两组平均能量损耗比较 血透组aEL在舒张期多个时相LV整体及心室不同水平较对照组增高,其中P1的aEL-T、P2的aEL-T、aEL-B、aEL-M、aEL-A及P3的aEL-A、P4的aEL-T、aEL-M、aEL-A差异具有统计学意义(P<0.01或P<0.05),见表3。 两组间比较,血透组涡旋面积在P1,循环强度在P2、P4较对照组增高,差异具有统计学意义(P<0.01或P<0.05),见表4。
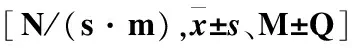
表3 两组平均能量损耗(aEL)比较Table 3 The average energy loss

组别P3P4aEL⁃TaEL⁃BaEL⁃MaEL⁃AaEL⁃TaEL⁃BaEL⁃MaEL⁃A血透组8.31±5.999.31±9.199.37±5.926.92±5.78①17.44±7.35②20.97±11.7315.03±7.69②14.09±7.68②对照组7.72±5.548.81±7.768.12±5.145.20±7.0812.64±8.7518.91±12.655.80±4.155.24±3.44
注:①P<0.05,与对照组比较;②P<0.01,与对照组比较

表4 两组涡旋参数比较Table 4 The vortex parameter
注:与对照组比较,①P<0.05;与对照组比较,②P<0.01
2.4 相关性分析 在P2,血透组aEL-T与E/e正相关(r=0.402,P<0.05);aEL-T与循环强度正相关(r=0.746,P<0.01)。在P4,血透组aEL-T与E/e正相关(r=0.732,P<0.01);aEL-T与循环强度正相关(r=0.642,P<0.01)。
3 讨论
心血管疾病是MHD患者死亡的主要原因[1-2]。超声心动图因其简便、实时、无损伤等特点,已成为临床诊断MHD患者心脏病变的首选医学影像学方法。常规超声心动图对心功能的评价多基于心室壁运动,无法显示心腔内的血流动力学改变情况。VFM技术是一种基于彩色多普勒成像,叠加斑点追踪,以速度向量反映血流速度的大小和方向的能够可视化呈现心腔内血流状态的超声新技术。它通过其内置的方程式,可以观察到心腔内的流场状态,可对层流和涡流进行区分并得到心腔内的能量损耗值[3-5]。正常的涡流对维持心腔内正常较小的EL具有重要作用,而异常涡流的形成则会增加能量损耗,从而反映心脏功能改变[6]。本研究应用VFM技术中平均能量损耗和涡旋两个指标,对MHD患者舒张期LV腔内流场状态做出定量评价,并探求aEL与E/e的相关性,以望为早期心功能评价提供依据。
血液透析时MHD患者血液经血管通路进入体外循环,与透析液发生溶质交换后再经血管通路回到体内,从而引起静脉回流增加。过多回流会加重心脏负担,再加之CRF本身引起水、钠潴留、贫血、肾素-血管紧张素增加及某些舒血管因子产生不足等因素的综合作用,都会引起MHD患者血容量增高,心输出量增加,最终导致血压升高,引起心肌重构,导致左心室肥厚[1,7-8]。本研究中MHD患者心脏结构的变化规律与已有的研究一致[9]。
有研究发现,心腔内涡流的形成与心脏的解剖结构、心肌运动及心功能等因素有关[10-11]。而本研究中,MHD患者舒张期部分时相的LV整体与心室不同水平aEL较正常组增高,分析其可能原因为MHD患者长期继发性高血压致左心室顺应性变化影响心腔内正常涡旋形成,同时心室肌舒张和形态学变化,室壁僵硬度增加[12],以及血流的高动力学状态,使心腔内涡旋增多,导致心室腔内EL的增加。另外,MHD患者透析膜的生物相容性可造成脂蛋白酶抑制物产生增多引起脂代谢紊乱,MHD患者所处的高脂状态,血液粘稠度的增高[13],亦会导致MHD患者EL的增高。另有研究发现,心肌纤维化及心肌纤维排列的紊乱可引起左心室收缩与舒张不同步,这会使得同一时相的不同节段间出现压差,有易于心腔内形成异常涡旋,造成不稳定的血流动力学改变,从而增加心室腔内EL[14]。这可能是本研究中P2的LV整体及不同节段aEL较对照组增高的原因,MHD患者高血流动力致心肌纤维化及CRF本身对心肌的损害,必然会引起舒张早期左心室心肌运动失同步,甚至导致左心室功能的改变[15]。郭子鸿等[16]的研究显示,CRF患者减慢充盈期及心房收缩期的能量损耗较正常人增多,考虑可能与左心室功能减退的代偿机制有关。本研究中MHD患者P3的aEL-A及P4的aEL-T、aEL-M及aEL-A高于对照组,其原因可能与CRF患者该期能量损耗增加机理一致,为左心室心肌主动松弛与自身抽吸能力的降低,引起心房收缩代偿性增加,从而引起左心房压力增高,左心室被动充盈增加,左心室压力改变明显,心腔内血流不稳定,呈涡旋样改变,进而引起EL发生变化。两组间各节段aEL由基底段至心尖段依次递减,考虑为舒张期血流由心房顺房室压力梯度进入心室,血液间粘滞力及涡旋间、涡旋与室壁间的撞击致左心室动能消耗进而速度分量依次减低,这与Honda等[17]的研究结果一致。
循环强度又被称为速度环量,当流速增大时,循环值变大[14]。正常的涡旋可以储备能量,舒张期蓄积动能,有助于推进血流运动,而心室腔内血流动力学发生改变时,常表现为涡旋面积的改变和循环强度的增加。马荣川等[18]研究表明,涡旋循环强度的异常有可能增加涡旋间、涡旋与室壁间粘滞摩擦或剪切摩擦所产生的热能消耗,从而导致该期的能量损耗增大,影响左心室功能。MHD患者由于水、钠潴留、贫血、高血压以及血液透析内瘘的使用等因素,会引起心高搏出量状态[1],致心腔室内血流动力学发生改变,进而引起涡旋面积及循环强度的变化[15]。本研究中,舒张期LV内血透组的涡旋面积除在P1外的其他时相较对照组均无明显差异,而P2及P4时相涡旋循环强度增加,同时左心室腔内aEL-T与涡旋循环强度呈正相关,进一步证实循环强度对能量损耗以及心功能的影响。
2009年美国和欧洲超声心动图学会联合指南推荐E/e作为评价左心室舒张功能异常的指标[19]。本研究中,P2、P4的aEL-T与E/e都有良好的相关性,表明MHD患者舒张期左心室内血流流场与左心室舒张功能改变有关。因此,aEL有可能成为临床量化评估MHD患者舒张功能受损程度的指标。
本研究的局限性:①病例数较少,未对不同透析时间MHD患者进行分组;②VFM技术只能评价其二维平面的流场改变,而左心腔是一个三维的空间结构,虽然本研究采用三个腔室的平均值,但对于左心腔整体的流场改变不能完全精准的评估。
4 结论
MHD患者存在左心室舒张期流体力学异常状态;VFM技术可直观显示其左心室舒张期流场的变化特征,并在一定程度上反映其左心室舒张功能改变,有望为临床提供一种能精确评价MHD患者心脏血流动力学损害的新方法。
【参考文献】
[1]葛均波,徐永健.内科学[M].人民卫生出版社.2013,8版:524-536.
[2]Yuan J, Zou XR, Han SP,etal. Prevalence and risk factors for cardiovascular disease among chronic kidney disease patients: results from the Chinese cohort study of chronic kidney disease (C-STRIDE):[J]. Bmc Nephrology, 2017, 18(1):23.
[3]Itatani K. When the blood flow becomes bright[J]. European Heart Journal, 2014, 35(12):747.
[4]Hong GR, Kim M, Pedrizzetti G,etal. Current Clinical Application of Intracardiac Flow Analysis Using Echocardiography[J]. J Cardiovasc Ultrasound, 2013, 21(4):155-162.
[5]Garcia D, Del Alamo JC, Tanne D,etal. Two-dimensional intraventricular flow mapping by digital processing conventional color-Doppler echocardiography images.[J]. IEEE Transactions on Medical Imaging, 2010, 29(10):1701.
[6]Akiyama K, Maeda S, Matsuyama T,etal. Vector flow mapping analysis of left ventricular energetic performance in healthy adult volunteers:[J]. Bmc Cardiovascular Disorders, 2017, 17(1):21.
[7]崔晓勇. 不同血管通路选择对维持性血液透析患者心功能的影响及预后影响因素研究[J]. 临床医药文献电子杂志, 2017, 4(13):2443-2444.
[8]王栗莉. 维持性血液透析患者心血管疾病危险因素及死亡分析[D]. 大连医科大学, 2016.
[9]张笑茹, 杨爱华. 维持性血液透析患者左心室结构和功能的单中心横断面研究[J]. 中外医学研究, 2014(12):27-29.
[10] F ll D, Taeger S, Bode C,etal. Age, gender, blood pressure, and ventricular geometry influence normal 3D blood flow characteristics in the left heart[J]. European Heart Journal Cardiovascular Imaging, 2013, 14(4):366.
[11] 朱美华. 血流向量成像技术在评价扩张型心肌病心脏整体功能及陈旧性心肌梗死心脏局部功能中的应用[D]. 华中科技大学, 2012.
[12] Balc MM, Balc KG, K rkpantur A,etal. Prevalence of severe carotid artery stenosis and its association with echocardiographic parameters in maintenance hemodialysis patients.[J]. Turk Kardiyol Dern Ars, 2014, 42(4):368-376.
[13] 张欢, 吴灏, 丁家荣,等. 维持性血液透析患者微炎症状态对血清骨钙素水平及脂代谢紊乱的影响[J]. 中国中西医结合肾病杂志, 2016, 17(8):720-722.
[14] 杨艳, 薛丹, 杨一林,等. 血流向量成像技术评价肥厚型心肌病患者左心室功能的初步研究[J]. 临床超声医学杂志, 2017, 19(2):85-90.
[15] 申凯凯, 王珍珍, 邓颖,等. 血流向量成像技术评价尿毒症患者左心室舒张功能的研究[J]. 中华超声影像学杂志, 2015, 24(11):942-947.
[16] 郭子鸿, 杜国庆, 李紫瑶,等. 血流向量成像技术对CRF患者左心室舒张功能的量化研究[J]. 中国超声医学杂志, 2016, 32(4):323-326.
[17] Honda T, Itatani K, Miyaji K,etal. Assessment of the vortex flow in the post-stenotic dilatation above the pulmonary valve stenosis in an infant using echocardiography vector flow mapping.[J]. European Heart Journal, 2014, 35(5):306.
[18] 马荣川, 尹立雪, 汪智慧,等. 超声血流向量成像评价2型糖尿病患者等容收缩期左心室流场状态[J]. 四川医学, 2016(1):11-15.
[19] Nagueh SF, Appleton CP, Gillebert TC,etal. Recommendations for the evaluation of left ventricular diastolic function by echocardiography[J]. European Journal of Echocardiography the Journal of the Working Group on Echocardiography of the European Society of Cardiology, 2009, 10(2):165-193.
