放射治疗食管癌术后纵隔淋巴转移的疗效分析*
2018-05-03宋嫒姝李光明吴敬波别俊张欣平杨健筌
宋嫒姝 李光明, 吴敬波 别俊 张欣平 杨健筌
(1.西南医科大学附属医院肿瘤科,四川 泸州,646000;2.南充市中心医院肿瘤防治中心,四川 南充,637000)
食管癌是发生在食管上皮组织的恶性肿瘤,占全身恶性肿瘤的2%;我国是食管癌高发国家之一,食管癌手术治疗的5年生存率为20%~30%,局部复发或远处转移是治疗失败的原因之一。淋巴结转移是食管癌最常见的转移途径,特别是颈部及纵隔淋巴结转移[1]。本研究通过对2010 年1月~2014年12月收治的食管癌术后发生纵隔淋巴结转移并进行放疗的47例患者的临床资料进行回顾性分析,以观察食管癌术后纵隔淋巴结转移的放疗效果。
1 资料与方法
1.1 一般资料 收集南充市中心医院2010~2014年食管癌术后纵隔淋巴结转移行放射治疗的47例病例。其中,男性37例,女性10例,年龄38~80岁,中位年龄在60.4岁。病变位于胸上段5例(10.6%),胸中段40例(85.1%),胸下段2例(4.3%)。食管病变长度<5cm 20例(42.6%),≥5cm 27例(57.4%)。放疗剂量<60Gy 19例(40.4%),≥60Gy28例(59.6%)。单纯放疗31例,同步或序贯放化疗16例。Ⅱ期29例,Ⅲ期18例,调强放疗18例,三维适形放疗29例。术后病理诊断47例均为鳞癌。
1.2 放射治疗方法 针对纵隔转移淋巴结放疗,其中调强放疗18例,三维适形放疗29例。采用三维适形放射治疗或调强放射治疗。患者取仰卧位,双手抱头经热塑模固定后,予螺旋 CT 扫描,层厚 2.5 mm。影像传输至计划系统后进行靶区勾画及计划制定。靶区确定:肿瘤区 (GTV) 为 CT所显示的纵隔淋巴结;临床靶区 (CTV) 为 GTV 再外放 5~8 mm;计划靶区 (PTV) 为 CTV再外放 5 mm。不予淋巴引流区预防照射。单次剂量为 2 Gy,总剂量60~70 Gy,每周 5 次。正常组织的剂量限制:双肺 V20 ≤ 25%,脊髓最大剂量≤45 Gy,心包 V30 ≤ 46%,术后胸胃≤40%~50%。
1.3 化学治疗 31例未行化疗,其余病例均行化疗,都是以TP为主的联合化疗方案。化疗方案:紫杉醇210mg d1、奈达铂50mg d2-3;中位化疗周期为2周期。
1.4 随访 所有存活病例均随访到2016年12月,中位随访时间19月(3~50月),失访1例,随访率为97.8%。
1.5 近期疗效 放疗结束后1月行CT检查,对肿大的淋巴结缩小情况进行近期疗效评估。分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD);总有效率为CR+PR,并持续缓解4周以上。
1.6 统计学分析 应用SPSS17.0统计软件分析资料,生存率、局控率用Kaplan-Meier法计算,组间的生存率和局控率差异采用Log-rank时序检验,多因素分析用COX回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效 CR 4例(8.5%),PR 29 例(61.7%)、SD 9例(19.1%)、 PD 5例(10.6%)。47例患者放疗后总有效率为CR+PR 70.2%。
2.2 总体生存率 47例患者放疗结束后中位生存时间为19月,1、2、3 年生存率分别为58.1%、36%、19.4%,见图1。
2.3 急性放射性损伤 主要是急性放射性食管炎和放射性肺炎。1-2级放射性食管炎26例(55.3%),1-2级放射性肺炎3例(7.1%),无3级及3级以上放射性食管炎和放射性肺炎。

图1生存函数曲线图
Figure1Survivalfunctiongraph
2.4 单因素分析结果 单因素分析显示食管癌术后Ⅱ期出现纵隔淋巴结转移放疗后1、2、3年与Ⅲ期患者放疗后1、2、3年生存率三者之间比较差异有统计学意义(P=0.021);食管癌胸部上段、中段及下段术后出现纵隔淋巴结转移放疗后1、2、3年生存率三者之间比较差异有统计学意义(P=0.031);食管癌术后出现纵隔淋巴结转移放疗剂量小于60Gy的患者放疗后1、2、3年生存率与放疗剂量大于等于60Gy的患者放疗后1、2、3年生存率分别为57.1%、35.4%、19.6%;三者之间差异有统计学意义(P=0.006)。患者性别、病变长度、放疗方式及是否化疗对预后无显著影响,见表2。
2.5 多因素分析结果 COX回归多因素分析表明,患者术后分期及放疗剂量为预后独立影响因素(P<0.05),见表3。
2.6 死亡原因 截止随访日期,47例患者死亡43人,其中局部复发17例,远处转移18例,不详8例,失访1例。
3 讨论
食管癌是我国最常见的恶性肿瘤之一,食管鳞癌是其主要的病理类型,占95%以上,且绝大多数发生于胸段食管。食管癌首选手术治疗,但5 年生存率只有20%~30%[2]。研究发现[3], 即使手术病理证实无淋巴结转移的食管癌患者 ,实际上仍有约 17 %的患者存在亚临床淋巴结转移;食管癌术后淋巴结转移是导致食管癌患者预后较差的重要因素之一,患者长期生存率明显降低。该类转移发生率较高,有报道称其发生率可高达44.9%[4]。食管癌术后淋巴结转移常好发于锁骨上区及上纵隔, 占 85.2%[5],而纵隔淋巴结转移食管癌术后最常见的转移部位[6-7]。相加庆等[8]报道显示, 胸段食管癌发生颈部淋巴结转移约为31%, 纵隔淋巴结转移约为34%, 腹腔淋巴结转移者约为 26%;纵隔转移灶压迫气管、神经、食管,甚至侵犯椎体,产生声音嘶哑或呼吸困难症状,影响患者生存时间及生存质量,需要优先考虑局部治疗缓解症状[9]。而食管癌术后发生纵隔淋巴结转移再行手术治疗很困难[10-11],单纯化疗有效率低,化疗副反应较大,放疗为其主要的治疗手段,给予适当的放射治疗,可以延长患者的生存时间[12]。近年来有文献报道,术后放疗可以改善预后,提高患者生存率[13]。随着放疗技术的发展,三维适形或调强放疗因其具有明显的剂量学优势,已成为现代放疗技术的主要方法[14]。
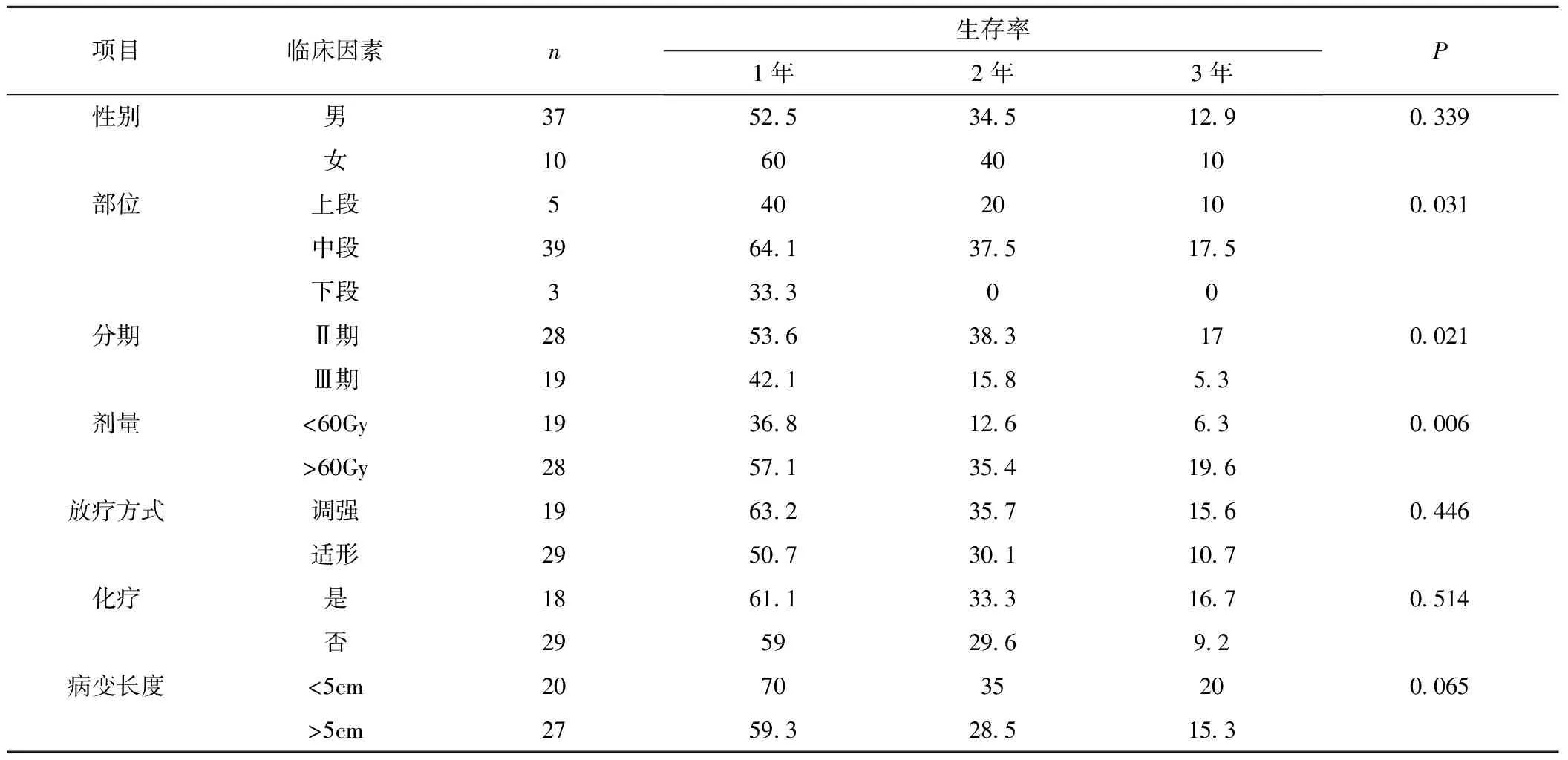
表2 临床因素关系单因素分析Table 2 Univariate analysis of prognostic factors

表3 纵隔淋巴结转移与临床因素关系多因素COX回归分析结果Table 3 Multiple cox regression analysis of prognostic factors of mediastinal LNM
有许多临床研究表明,瘤体对放疗后的生存率和缓解率均有明显影响,瘤体越大,肿瘤中心血供越差,越容易出现肿瘤中心坏死,使得肿瘤内产生大量乏氧细胞,瘤体中的缺氧细胞的放疗敏感性低[15-16]。因此,提高放疗疗效需要提高放疗剂量和改善瘤体中缺氧细胞的状态,而在放疗中使用化疗可提高对肿瘤的杀灭作用,同时化疗能够改善瘤体中乏氧细胞的状态。有研究表明食管癌术后辅助紫杉醇为基础的化疗可提高淋巴结阳性的食管癌的生存率[17]。本研究中术后纵隔淋巴结转移放疗联合化疗较单纯放疗生存率有所提高,但差异无统计学意义,可能与本研究病例数量较少有关。因此,不能说明联合放化疗不是影响食管癌术后纵隔淋巴结转移放疗的预后因素。
周绍兵等[18]报道食管癌术后纵隔淋巴结转移单纯三维适形放疗的1、2、3年生存率分别为73.3%、23.3%、6.7%;苏景伟等[19]报道显示食管癌术后纵隔淋巴结转移患者放疗后总有效率为78.6%, 1,2,3 年生存率分别为 47. 1%,20. 5% 和 13.2%;Nemoto等[20]报道33例食管癌术后纵隔和(或)锁骨上淋巴结转移者单纯放疗后1、2、3年生存率分别为33%、15%和12%。本研究总有效率为70.2%,1、2、3年生存率分别为58.1%、36%、19.4%,与上述报道结果较一致,与国外报道的较高,可能是与本研究中食管癌术后临床分期较早的及放疗剂量大于60Gy的病例数相对较多有关。
本研究中单因素分析显示术后Ⅱ期、术前肿瘤位于胸中上段或术后纵隔淋巴结转移放疗剂量大于60Gy者,放疗后生存率高于术后Ⅲ期、术前肿瘤位于胸下段或术后纵隔淋巴结转移放疗剂量小于60Gy者;Cox多因素分析显示术后纵隔淋巴结转移放疗剂量及术后分期为独立预后因素。为了进一步提高疗效,我们对于食管癌术后Ⅲ期者应常规行术后预防性放疗,能降低局部复发率,从而使部分患者获益。
4 结论
食管癌术后临床分期较早发生纵隔淋巴结转移的行放射治疗预后较好,同时放疗剂量大于60Gy的预后较好,但影响放疗疗效还有很多因素。调强放疗较三维适形放疗生存率有所提高,但差异无统计学意义,可能与本研究病例数较少有关。
【参考文献】
[1]Jemal A ,BrayF,Center MM,etal.Global cancer statistic[J].CA Cancer J Clin,2011,61(2):69-90.
[2]章文成,肖泽芬. 食管癌根治术后预防性放疗应用的相关性研究(二)-食管癌术后失败模式和术后放疗[J].中华放射肿瘤学杂志,2011,20(2): 148-152.
[3]李成林, 王雅棣, 韩春, 等.胸段食管癌术后下颈部淋巴结转移规律及放疗靶区探讨[J] .中华放射肿瘤学杂志,2012 , 21(2):126.
[4]陈建华,桑玫,陈宇航 . 等 . 食管癌术后复发转移的类型及预后分析 [J]. 中华肿瘤杂志,1998,20(4):293-295
[5]章文成, 王奇峰, 肖泽芬, 等.Ⅱ和Ⅲ期胸段食管癌术后预防性三维放疗疗效分析[J] .中华放射肿瘤学杂志,2012 , 21(2):136
[6]Chen G,Wang Z,Liu XY,etal.Recurrence patterns of esophageal cancer after lvor-Lewis esophageal-a report of 196 cases [J].Ai Zheng,2006,25(1):96-99.
[7]Lu JC,Kong C,Tao H.Radiotherapy with or without concurrent chemotherapy for lymph node recurrence after radical surgery of thoracic esophageal squamous cell carcinoma [J].Int J Radiat Oncol Biol Phys, 2010,78(3):710-714.
[8]相加庆, 张亚伟, 嵇庆海, 等.胸段食管癌 100 例淋巴结转移的规律性[J] .中国癌症杂志, 2001 , 11(5):423.
[9]毕良文.三维适形放疗联合化疗治疗食管癌上纵隔淋巴结转移的疗效分析.中华肿瘤放射杂志,2009,16(20):1597-1602.
[10] 濮娟, 王成师, 厉天林.胸段食管癌首程治疗后出现锁骨上淋巴结转移 78 例临床分析[J] .实用临床医药杂志,2010 , 14(11):93.
[11] 任伟,孔炜伟,闫婧,等. 食管鳞癌上纵隔1与2区淋巴结转移适形调强放疗回顾性分析[J].中华肿瘤防治杂志,2013,20(23):1834-1837.
[12] Zhu ZJ,Hu Y,Zhao YF,etal. Early recurrence and death after esophagectomy in patients with esophageal squamous cell carcinoma[J].Ann horac Surg,2011,91(5):1502-1508.
[13] 吴丹, 徐松涛.淋巴结转移范围与食管癌术后预后分析[J] .中国现代医生, 2011,49(9):41
[14] 于舒飞,章文成,王奇峰,等. 淋巴结阳性食管癌术后预防性 IMRT 同期化疗的临床 I 期研究[J].中华放射肿瘤学杂志,2016,25(1): 26-31.
[15] Walsh JC,Lebedev A,Aten E,etal. The clinical importance of
assessing tumor hypoxia: relationship of tumor hypoxia to prognosis and therapeutic opportunities[J].Antioxid Redox Signal,2014,21(10): 1516-1554.
[16] Weng Q,Zhang J,Cao J,etal. Q39,a quinoxaline 1,4-Di-Noxide derivative,inhibits hypoxia-inducible factor-1α expression and the Akt /mTOR/4E-BP1 signaling pathway in human hepatoma cells[J].Invest New Drugs,2011,29(6):1177-1187.
[17] Lyu X,Huang J,Mao Y,etal. Adjiuvant chemotherapy after esophagectomy: is there a role in the treatment of the lymph node positive thoracic esophageal squamous cell carciooma[J].J Surg Oncol,2014,110(7): 864-868.
[18] 周绍兵, 丁文秀,郭信伟,等.食管癌术后纵隔淋巴结转移中部分群体同步放化疗的疗效观察[J].临床肿瘤学杂志,2016, 21(11):1001-1004.
[19] 苏景伟,祝淑钗,王玉祥,等.145例胸段食管癌术后纵隔淋巴结转移放射治疗的疗效评价[J].中国肿瘤临床,2009,36 ( 11) :609-612.
[20] Nemoto K ,Ariga H,Kakuto Y,etal.Radiation therapy for loco-regionally recurrent esophageal cancer after surgery[J].Radiother Oncol,2001,61(2):165-168.
