YAP及P-YAP在RAW264.7细胞脓毒症模型中的表达*
2018-05-03左文王海清钟武胡迎春陈睦虎
左文 王海清 钟武 胡迎春 陈睦虎
(西南医科大学附属医院急诊科,四川 泸州 646000)
脓毒症是机体对感染的过度免疫反应,大量的炎症介质释放到外周血引起全身炎症反应(systemic inflammatory response syndrome,SIRS)[1]。其发生率占住院患者的1%~2%,如果伴感染性休克和多器官功能障碍,其死亡率高达30%~60%[2]。脓毒症的发生机制尚不明确,若能找到调控脓毒症的关键信号通路及其关键基因,或许能为临床治疗脓毒症提供新靶点。目前关于hippo信号通路在脓毒症中的作用机制的报道较少。Yes相关蛋白(YAP)是hippo信号通路中重要的核心转录因子,参与细胞的增殖、分化及组织的稳定[3]。本实验拟通过检测YAP和P-YAP在细胞脓毒症模型中的表达情况,以探讨YAP和P-YAP与脓毒症发生的相关性。
1 材料与方法
1.1 试剂及仪器 高糖DMEM培养基(Hyclone),胎牛血清FBS(PAN),LPS(Sigma),YAP、P-YAP及IONS(abcom)一抗,β-actin一抗(碧云天),山羊抗兔IgG二抗(博奥森),绿色荧光山羊抗兔IgG(Protientech),DAPI(索莱宝),蛋白酶抑制剂和磷酸酶抑制剂(Roche),蛋白裂解液(碧云天)。低温离心机(Thermo),生物安全柜(Telstar),荧光显微镜(olympus),共聚焦显微镜(feica),细胞培养箱(Thermo)。
1.2 细胞株 小鼠巨噬细胞RAW264.7,购自中国科学院上海细胞库。
1.3 细胞培养及模型的建立 RAW264.7细胞用含10%FBS DMEM培养基在5%CO2,37℃条件下培养[4]。取对数期RAW264.7细胞,用100ng/ml的LPS刺激4小时,构建脓毒症模型[5]。取对数期raw264.7细胞在6孔板中培养,每孔接种5.0×106个/ml,分为正常组和实验组,实验组接种24小时后(即对数期)用100ng/ml的LPS刺激4小时建立脓毒症模型,对照组加入相同体积的完全培养基。
1.4 免疫荧光对YAP及P-YAP进行定位 取对数期的RAW264.7细胞在12孔板中爬片,每孔接种2.0×106个/ml,培养24小时后用LPS(100ng/ml)刺激RAW264.7细胞,培养4小时,PBS洗涤3次,每次3分钟,4%多聚甲醛固定15分钟,再用PBS洗涤3次,每次3分钟,0.5%Triton-10打孔20分钟,PBS洗涤3次,每次3分钟,10%山羊血清封闭30分钟,一抗过夜。第二天37℃复温45分钟,吸进一抗后,PBS洗涤3次,每次3分钟,37℃孵育二抗1小时,PBS洗涤3次,每次3分钟,DAPI复染核5分钟,PBS洗涤3次,每次5分钟,加入适量的抗荧光淬灭剂。然后在荧光显微镜或共聚焦显微镜下观察。
1.5 Weston blot检测YAP及P-YAP的表达情况 用含有1%磷酸酶抑制剂和1%蛋白酶抑制剂的细胞裂解液提取蛋白,BCA检测蛋白浓度,用10%的分离胶电泳,先用60V电压电泳30分钟,再用120V电压电泳60分钟,然后转移到PVDF膜,用0.02A恒流转60分钟。用5%脱脂牛奶封闭1小时,PBST洗涤5分钟,YAP(1:4000),P-YAP(1:2000)一抗在4℃过夜。第二天,PBST洗涤3次,每次10分钟,孵二抗(1:4000)一小时, PBST洗涤3次,每次10分钟。用VisionCapt曝光。用Quantity One进行灰度值检测。
1.6 统计学分析 运用SPSS16.0对YAP及P-YAP表达情况进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 RAW264.7细胞鉴定及细胞脓毒症模型的建立 INOS为M1型巨噬细胞特异性分子[6],用100ng/ml LSP刺激RAW264.7细胞4h,用免疫荧光检测模型的建立,100%细胞均有INOS表达,见图1。说明RAW264.7浓毒血症模型建立成功。

图1 LPS(100ng/ml)刺激RAW264.7细胞后检测INOSFigure 1 LPS stimulated RAW 264.7 cells,INOS were used to evaluate the model of sepsis
2.2 免疫荧光对RAW264.7细胞浓度血症模型中YAP及P-YAP进行表达定位 在RAW264.7细胞脓毒症模型中,P-YAP表达于胞质中,在实验组中荧光亮度减弱,见图2。YAP蛋白表达于胞核中,在实验组中荧光强度增强,见图3。
2.3 用Weston blot检测正常组及模型组YAP蛋白及P-YAP蛋白的情况 实验组YAP蛋白表达明显高于正常组(P<0.5),见图4;实验组P-YAP蛋白表达明显低于正常组(P<0.5),见图5。
3 讨论
脓毒症是严重的全身炎症反应,严重威胁患者生命[7]。内毒素是革兰阴性杆菌的重要成分,是导致脓毒症的主要原因[8]。当脓毒症发生时,血液中微生物的引起了一种先天性免疫反应,其特征是单核细胞的刺激和促炎细胞因子的释放以及各种免疫途径的激活。目前,Toll样受体(LPS-TLR4-MD-2)在最初的免疫激活中发挥关键作用,作为天然免疫系统的传感器通过高度保守的成分,参与各种微生物的识别[9]。 但是,阻断TLR4通路并不能完全抑制炎症介质的释放[10],推测有其他通路参与其中。
巨噬细胞在脓毒症的发生中有着重要的作用。巨噬细胞可以分化成M1、M2型巨噬细胞。M1型巨噬细胞产生TNF-α,IL-1和一氧化氮合酶,促进细菌的去除和损坏的细胞,已被证明具有抗肿瘤性质,而M2巨噬细胞产生精氨酸酶,促进组织修复和肿瘤增殖[11-12]。在脓毒症时,巨噬细胞可分化为M1型[13],大量释放炎症介质进入外周血,引发广泛炎症,引起多器官功能障碍(MODS)的发生,引起严重感染和感染性休克[14]。故本实验通过LPS刺激RAW264.7细胞构建细胞脓毒症模型。

图2 P-YAP表达于细胞质Figure 2 In the sepsis model of RAW264.7 cells, the YAP protein was expressed in the nucleus
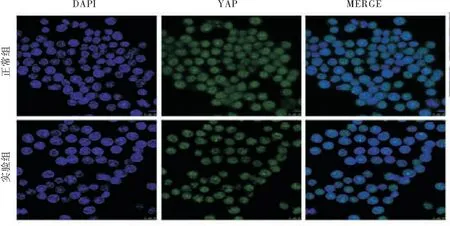
图3 YAP表达于细胞核Figure 3 In the sepsis model of RAW264.7 cells,,the P-YAP was expressed in the cytoplasm
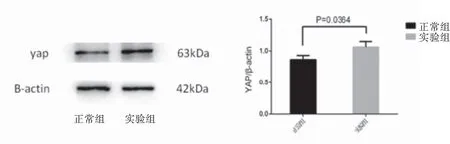
图4 YAP在脓毒血症模型中高表达Figure 4 In the model of sepsis, the expression of YAP protein was significantly higher than that in the normal group

图5 P-YAP在脓毒血症模型中表达减少Figure 5 The expression of P-YAP protein in the sepsis model was lower than that in the normal group
Hippo信号通路下游的效应分子YAP/TAZ复合物在器官的大小的调节,组织的稳态,肿瘤的发生中有着重要的影响,YAP/TAZ复合物的活性主要同过磷酸化来实现。去磷酸化的YAP/TAZ在细胞核中与TEAD结合,引发下游基因的表达[15]。YAP在心肌的增殖过程中有重要作用,缺乏YAP的小鼠在围产期就发生死亡[16]。研究发现在结肠癌细胞中β-catenin能调节YAP的表达在炎症性肠病和结肠癌中[17],通过YAP和NOTCH通路,肠上皮gp130激活能增强肠黏膜抵抗性[18]。肿瘤的发生与炎症反应有着密切的关系,肿瘤组织中癌细胞的浸润,炎症因子的释放[19],而YAP在肿瘤的发生中有重要影响。研究发现YAP与CD8+T细胞表达Blimp-1有关[20]。猜想YAP参与脓毒症的发生;下一步深入研究YAP对脓毒症时炎症因子表达的情况,探讨与其他通路的关系。
4 结论
本研究通过构建细胞脓毒症模型检测YAP的表达情况,发现YAP高表达于M1型巨噬细胞,而P-YAP低表达。因此推测去磷酸化的YAP参与脓毒症的发生,可作为新的治疗靶标。
【参考文献】
[1]Shukla P, Rao GM, Pandey G,etal. Therapeutic interventions in sepsis: current and anticipated pharmacological agents[J]. Br J Pharmacol, 2014, 171(22): 5011-5031.
[2]Galley HF. Oxidative stress and mitochondrial dysfunction in sepsis[J]. Br J Anaesth, 2011, 107(1): 57-64.
[3]Hansen CG, Moroishi T, Guan KL. YAP and TAZ: a nexus for Hippo signaling and beyond[J]. Trends Cell Biol, 2015, 25(9): 499-513.
[4]Yu W, Zhang X, Wu H,etal. HO-1 Is Essential for Tetrahydroxystilbene Glucoside Mediated Mitochondrial Biogenesis and Anti-Inflammation Process in LPS-Treated RAW264.7 Macrophages[J]. Oxid Med Cell Longev, 2017, 2017: 1818575.
[5]Lv Y, Hu S, Lu J,etal. Upregulating nonneuronal cholinergic activity decreases TNF release from lipopolysaccharide-stimulated RAW264.7 cells[J]. Mediators Inflamm, 2014, 2014: 873728.
[6]Davis MJ, Tsang TM, Qiu Y,etal. Macrophage M1/M2 polarization dynamically adapts to changes in cytokine microenvironments in Cryptococcus neoformans infection[J]. MBio, 2013, 4(3): e00264-13.
[7]Markwart R, Condotta SA, Requardt RP,etal. Immunosuppression after sepsis: systemic inflammation and sepsis induce a loss of naive T-cells but no enduring cell-autonomous defects in T-cell function[J]. PLoS One, 2014, 9(12): e115094.
[8]Wang Y, Shan X, Chen G,etal. MD-2 as the target of a novel small molecule, L6H21, in the attenuation of LPS-induced inflammatory response and sepsis[J]. Br J Pharmacol, 2015, 172(17): 4391-4405.
[9]Esteban E, Ferrer R, Alsina L,etal. Immunomodulation in Sepsis: The Role of Endotoxin Removal by Polymyxin B-Immobilized Cartridge[J]. Mediators of Inflammation, 2013, 2013: 1-12.
[10] Xiang NL, Liu J, Liao YJ,etal. Abrogating ClC-3 Inhibits LPS-induced Inflammation via Blocking the TLR4/NF-κB Pathway[J]. Scientific Reports, 2016, 6: 27583.
[11] Zhang M, Hutter G, Kahn SA,etal. Anti-CD47 Treatment Stimulates Phagocytosis of Glioblastoma by M1 and M2 Polarized Macrophages and Promotes M1 Polarized Macrophages In Vivo[J]. PLoS One, 2016, 11(4): e0153550.
[12] Nahrendorf M, Swirski FK. Abandoning M1/M2 for a Network Model of Macrophage Function[J]. Circ Res, 2016, 119(3): 414-417.
[13] Lu G, Zhang R, Geng S,etal. Myeloid cell-derived inducible nitric oxide synthase suppresses M1 macrophage polarization[J]. Nat Commun, 2015, 6: 6676.
[14] Zheng Z, Jiang L, Ye L,etal. The accuracy of presepsin for the diagnosis of sepsis from SIRS: a systematic review and meta-analysis[J]. Ann Intensive Care, 2015, 5(1): 48.
[15] Moroishi T, Park HW, Qin B,etal. A YAP/TAZ-induced feedback mechanism regulates Hippo pathway homeostasis[J]. GENES & DEVELOPMENT, 2015, (29): 1271-1284.
[16] Wang Y, Hu G, Liu F,etal. Deletion of yes-associated protein (YAP) specifically in cardiac and vascular smooth muscle cells reveals a crucial role for YAP in mouse cardiovascular development[J]. Circ Res, 2014, 114(6): 957-965.
[17] Konsavage WM, Jr., Kyler SL, Rennoll SA,etal. Wnt/beta-catenin signaling regulates Yes-associated protein (YAP) gene expression in colorectal carcinoma cells[J]. J Biol Chem, 2012, 287(15): 11730-11739.
[18] Taniguchi K, Wu LW, Grivennikov SI,etal. A gp130-Src-YAP module links inflammation to epithelial regeneration[J]. Nature, 2015, 519(7541): 57-62.
[19] Hussain SP, Harris CC. Inflammation and cancer: an ancient link with novel potentials[J]. Int J Cancer, 2007, 121(11): 2373-2380.
[20] Thaventhiran JE, Hoffmann A, Magiera L,etal. Activation of the Hippo pathway by CTLA-4 regulates the expression of Blimp-1 in the CD8+ T cell[J]. Proc Natl Acad Sci U S A, 2012, 109(33): E2223-E2239.
